重组人CLK1的真核表达及鉴定
李超,祖勉,连雯雯,刘艾林,2,3,杜冠华,2,3
1.中国医学科学院北京协和医学院 药物研究所;2.天然药物活性物质与功能国家重点实验室;3.药物靶点研究与新药筛选北京市重点实验室;北京 100050
Cdc2-like kinase 1(CLK1)是一种具有双特异性的丝/苏氨酸和酪氨酸蛋白激酶,是CLK 激酶家族成员,主要与真核生物中mRNA 的选择性剪接相关[1]。选择性剪接是指经过单一的基因可产生结构和功能相异的多种蛋白亚型[2]。近年来全基因序列分析结果显示,选择性剪接使得有限数量的基因可以实现蛋白质水平的高度多样性[3]。基因组分析结果显示,约35%~60%的人类基因可编码至少2种选择性剪接的蛋白亚型。对剪接位点进行选择性调控,为基因表达调控和蛋白质组多样性的产生提供了广泛的机制,这种调控方式也在众多生理过程中发挥重要作用,例如胚胎发育、细胞生长和凋亡。CLK1 的效应蛋白SR 家族是构成前体mRNA 组成性剪接的必要成员,同时在选择性剪接中也发挥了重要作用[4]。
CLK1通过磷酸化SR 蛋白进而影响剪接位点的选择。哺乳动物的CLK蛋白家族包括一个SR区域,能够在体外磷酸化SR 蛋白,在体内磷酸化SF2/ASF(splicing factor 2/alternative splicing factor)。CLK在体外过表达体系中其酪氨酸、丝氨酸和苏氨酸可发生自磷酸化,表明CLK 家族属于双特异性蛋白激酶家族。
CLK1 与多种疾病的发生发展密切相关。我们构建了CLK1基因真核细胞过表达载体,鉴定了重组质粒转染细胞后CLK1蛋白的表达,并对其活性进行了进一步验证,旨在建立CLK1在真核细胞中过表达模型,为研究CLK1在生理病理状态下的作用及药物发现奠定基础。
1 材料和方法
1.1 材料
HEK293A 细胞由本实验室冻存,用于转染重组质粒,生长于含10%胎牛血清的α-MEM 培养基中;大肠杆菌感受态细胞Trans 10购于北京全式金生物技术有限公司;真核表达载体pEGFP-N2(图1)由本实验室以质粒形式冻存于-40℃。
高保真DNA 聚合酶KOD-Plus 购于Toyobo 公司;内切酶BamHⅠ和EcoRⅠ、T4DNA 连接酶、胶回收试剂盒MiniBESTAgarose Gel DNA Extraction Kit Ver.3.0 均购于TaKaRa 公司;逆转录酶TransScript First-Strand cDNA Synthesis SuperMix 购于北京全式金生物技术有限公司;蛋白marker 购于Fermentas公司;高纯度质粒小提试剂盒、无内毒素质粒大提试剂盒均购于天根生物技术有限公司;CLK1抗体购自NOVUS BIOLOGICALS 公司;转染试剂LipofectAMINE2000购于Invitrogen公司。
Spectra Max M5 酶标仪(Molecular Devices);CFX96荧光实时定量PCR仪、蛋白电泳仪及转膜仪、Molecular Imager ChemiDoc XRS+Systerm(Bio-Rad);Allegra X-22R Centrifuge(Beckman)。
1.2 人CLK1基因序列分析及引物设计
在GenBank 中检索人CLK1 mRNA 序列(NM_004071.3)中的CDS 区(182~1636),经Vector NTI软件分析,该序列不含BamHⅠ和EcoRⅠ酶切位点。
用Vector NTI 软件设计引物pEGFP-hCLK1-STTAGAATTCATGAGACACTCAAAGAGAACTTACT、pEGFP-hCLK1-A-ATTTGGATCCGTATACTTTTCT TCAGAAGGTC,由奥科鼎盛公司合成。
1.3 人脐静脉血管内皮细胞(HUVEC)总RNA 提取、cDNA合成及CLK1基因的制备
1.3.1 HUVEC 细胞总RNA 提取与第一链cDNA 合成 取一瓶生长状态良好的HUVEC,用TRIzol 试剂常规提取总RNA,溶于20μL DEPC 水中,以HUVEC 的总RNA 为模板,用cDNA 第一链合成试剂盒(TransScript First-Strand cDNA Synthesis Super-Mix)进行逆转录,反应体系包括总RNA(50 ng~5μg)1μL、AnchoredOligo(dT)181μL、2×TS reaction mix 10μL、Transcript RT/RI Enzyme mix 1μL、无RNA 的水6μL。将以上组分混匀后置于PCR 仪中,42℃孵育30 min,85℃加热5 min 失活TransScript RT。1.3.2 PCR 扩增CLK1 基因序列 PCR 扩增条件为94℃2 min、94℃15 s、55℃30 s、68℃2 min,循环35 次,CLK1 基因片段长度为1455 bp,用1%琼脂糖凝胶电泳及胶回收试剂盒纯化PCR 产物,为下一步双酶切反应做准备。

图1 pEGFP-N2空载体及其部分基因序列和多克隆位点
1.4 CLK1/pEGFP-N2重组表达载体构建
将CLK1 基因PCR 产物及pEGFP-N2 载体分别用BamHⅠ和EcoRⅠ双酶切,胶回收分别纯化双酶切产物,用T4DNA 连接酶于16℃连接16 h,转化感受态大肠杆菌Trans 10 细胞,以含卡那霉素的LB选择性固体培养基37℃过夜培养,挑取单克隆扩大培养,用高纯度质粒小提试剂盒提取菌体质粒,对提取的质粒进行双酶切鉴定后测序。
1.5 提取无内毒素重组载体
将酶切阳性且测序结果吻合的菌液接种于含100μg/mL 卡那霉素的LB 培养基中,37℃振荡培养过夜,收集菌液,用无内毒素质粒大提试剂盒,按照说明书抽提无内毒素重组质粒。
1.6 瞬时转染HEK293A细胞
收获处于对数生长期的HEK293A 细胞,以2×104/孔接种于6 孔培养板中,在37℃、5% CO2环境中培养24 h至细胞长至80%~90%融合,按照质粒与转染试剂为1μg∶3μL的比例进行转染。将细胞分为阴性对照组(转染pEGFP-N2 空载体)和实验组(转染CLK1/pEGFP-N2 重组质粒)。转染24、48、72 h后收集蛋白进行表达水平的检测。
1.7 CLK1蛋白表达水平检测
1.7.1 Western 印迹 将重组质粒CLK1/pEGFP-N2和对照质粒pEGFP-N2 转染细胞后于不同时刻收集的蛋白样品进行SDS-PAGE,将PAGE 胶中的蛋白转移至PVDF 膜上,用5%胎牛血清(BSA)室温下将膜封闭2 h,用一抗及二抗分别于4℃杂交过夜和室温杂交2 h,在膜表面加适量底物发光液,在ECL 凝胶成像仪中曝光。通过考察不同转染时间对目的蛋白表达的影响,找到CLK1 蛋白在HEK293A 细胞中大量表达的转染时间。

图2 PCR扩增CLK1基因琼脂糖电泳
1.7.2 免疫荧光 重组质粒CLK1/pEGFP-N2和对照质粒pEGFP-N2 转染细胞后24、48、72 h,吸除细胞上清,用4%多聚甲醛固定细胞,以0.3% Triton X-100 透化细胞,以5%无菌BSA 于4℃封闭2 h,把抗CLK1 的兔单克隆抗体(用5% BSA 稀释至1/100)加至细胞,4℃杂交过夜,用PBS 洗掉非特异性结合的一抗,把荧光二抗Anti-RabbitIgG(Alexa Fluor 488 Conjugate)用1%无菌BSA 稀释至1/1000,加至细胞,25℃孵育2 h,用DAPI 染细胞核,以PBS 洗掉非特异性结合的荧光二抗,最后在高内涵细胞成像系统中进行细胞核定位和Target 蛋白成像,考察不同时间内蛋白的表达水平。
1.8 磷酸化SF2/ASF蛋白的表达水平检测
重组质粒CLK1/pEGFP-N2和对照质粒pEGFPN2 转染细胞后24 h 收集蛋白样品进行Western 印迹,杂交SF2/ASF 磷酸化抗体,检测过表达后CLK1蛋白激酶的活性。
2 结果
2.1 PCR产物的琼脂糖电泳
1%琼脂糖电泳结果显示,PCR 反应产物在1000~2000 bp 间有特异性条带,与CLK1 基因理论值1455 bp相符(图2)。
2.2 CLK1/pEGFP-N2重组质粒的双酶切鉴定
根据CLK1和pEGFP-N2的浓度,计算二者在连接体系中的加入体积,使得目的基因CLK1的摩尔浓度与载体pEGFP-N2的摩尔浓度之比为10∶1。取适量连接产物转化感受态细胞,经扩增,在固体培养基上挑取4 个单克隆,提取CLK1/pEGFP-N2 重组质粒,用BamHⅠ和EcoRⅠ对重组质粒进行双酶切,电泳结果如图3,重组质粒酶切后产生4700与1500 bp条带,分别与pEGFP-N2和CLK1 基因大小相符,初步确定CLK1/pEGFP-N2重组质粒构建成功。
2.3 CLK1/pEGFP-N2重组质粒的测序分析
提取CLK1/pEGFP-N2重组质粒,经奥科鼎盛生物公司测序,结果与GenBank 中的序列完全一致,无移码,无突变,确定重组质粒构建成功。
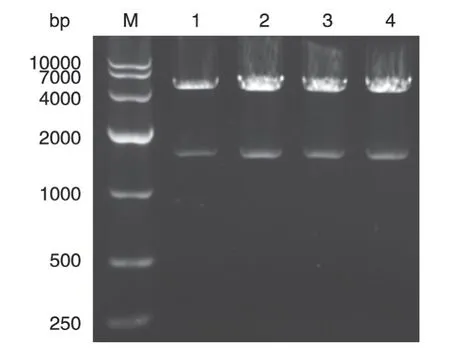
图3 真核重组表达载体CLK1/pEGFP-N2的双酶切鉴定
2.4 Western 印迹检测CLK1 在HEK293A 细胞中的过表达
HEK293A 细胞转染CLK1/pEGFP-N2 后,于24、48、72 h 收集细胞总蛋白,Western 印迹检测细胞中CLK1 的表达情况,以转染pEGFP-N2 组为阴性对照,未加转染试剂和质粒的HEK293A 细胞作为另一阴性对照。结果如图4,HEK293A 细胞自身的CLK1表达量较高,CLK1/pEGFP-N2 转染细胞后24、48、72 h,在相对分子质量82×103附近出现与GFP 标签蛋白融合表达的CLK1蛋白,随着转染时间的延长蛋白表达量下降,转染24 h 后CLK1 的表达量最高。因此,选择转染后24 h 作为CLK1 在HEK293A 细胞中过表达的最佳时间。
2.5 免疫荧光检测CLK1 在HEK293A 细胞中的过表达
用细胞免疫荧光方法检测细胞内CLK1过表达,结果如图5。转染24 h后CLK1荧光强度显著增加,说明CLK1在24 h时表达量最高。

图4 Western印迹检测HEK293A细胞转染CLK1/pEGFP-N2后CLK1的过表达

图5 荧光显微镜观察HEK293A细胞转染CLK1/pEGFP-N2后CLK1的过表达
2.6 磷酸化SF2/ASF蛋白的表达水平
Western 印迹结果显示,与转染了空白质粒的对照组相比,CLK1 过表达组SF2/ASF 蛋白的磷酸化水平显著提高,说明过表达的CLK1 具有良好的活性。见图6。

图6 Western印迹检测过表达24 h后细胞中SF2/ASF蛋白的磷酸化水平
3 讨论
人蛋白激酶有500 多种,负责磷酸化底物蛋白的丝氨酸、苏氨酸或酪氨酸残基,调控细胞内的各种信号传导过程[5]。蛋白激酶活性异常已被证明与多种疾病相关,如癌症、免疫系统疾病、神经退行性疾病、炎症、类风湿性关节炎、牛皮癣、糖尿病、动脉粥样硬化和感染性疾病等[6]。因此,蛋白激酶的研究对我们认识疾病的作用机制及合理地开发药物具有一定的指导意义。CLK1 是广泛存在于哺乳动物细胞中的一种蛋白激酶,可以选择性地磷酸化SR 家族蛋白,从而调控基因的选择性剪接。目前已知CLK1参与多种疾病的发生与发展,而对CLK1的研究主要集中在其通过激活下游的信号通路,从而调节特异性剪接过程。CLK1 在人免疫缺陷病毒(HIV)的基因表达中发挥重要作用[7],同时可以影响流感病毒在宿主细胞内的复制[8]。CLK1 也参与了神经发育过程,其在PC12 细胞中的表达可以影响神经元的分化[9]。CLK1 可以调节人前体脂肪细胞3T3-L1 的选择性剪接及脂肪的生成[10];在低氧损伤的人肺癌细胞缺氧模型中,CLK1可以调控组织增生因子的表达[11]。
我们建立了从CLK1 基因片段的合成到真核表达载体CLK1/pEGFP-N2 的构建及其在真核细胞HEK293A 中过表达的技术方法,该方法未见文献报道。pEGFP-N2 载体表达稳定且拷贝数较高,并且其与目的基因融合表达的GFP可在荧光显微镜下直接检测。通过Western 印迹与免疫荧光共同验证了CLK1 在不同转染时间的过表达情况,发现转染后24 h 时CLK1 的表达量最高,同时发现其下游的磷酸化SF2/ASF 蛋白含量显著上升,说明过表达的CLK1 活性较高。CLK1 真核细胞过表达模型的建立,有助于对其生物学功能及其在生理及病理过程中作用的研究,为新药研发提供理论和实验依据。
[1]Menegay H J,Myers M P,Moeslein F M,et al.Biochemical characterization and localization of the dual specificity kinase CLK1[J].J Cell Sci,2000,113(18):3241-3253.
[2]Zhou Z,Fu X D.Regulation of splicing by SR proteins and SR protein-specific kinases[J].Chromosoma,2013,122(3):191-207.
[3]Laosutthipong C,Kanthong N,Flegel T W.Novel,anionic,antiviral septapeptides from mosquito cells also protect monkey cells against dengue virus[J].Antiviral Res,2013,98(3):449-456.
[4]Black D L.Mechanisms of alternative pre-messenger RNA splicing[J].Ann Rev Biochem,2003,72(1):291-336.
[5]乐志培.蛋白激酶研究进展[J].自然杂志,1999,21(1):24-33.
[6]古国贤.蛋白激酶抑制剂的设计合成及其抗癌活性研究[D].天津:南开大学,2012.
[7]Wong R,Balachandran A,Mao A,et al.Differential effect of CLK SR kinases on HIV-1 gene expression:potential novel targets for therapy[J].Retrovirology,2011,8(1):1-12.
[8]Karlas A,Machuy N,Shin Y,et al.Genome-wide RNAi screen identifies human host factors crucial for influenza virus replication[J].Nature,2010,463(7282):818-822.
[9]Myers M P,Murphy M B,Landreth G.The dual-specificity CLK kinase induces neuronal differentiation of PC12 cells[J].Mol Cell Biol,1994,14(10):6954-6961.
[10]Li P,Carter G,Romero J,et al.Clk/STY(cdc2-like kinase 1) and Akt regulate alternative splicing and adipogenesis in 3T3-L1 pre-adipocytes[J].PLoS One,2013,8(1):e53268.
[11]Eisenreich A,Zakrzewicz A,Huber K,et al.Regulation of pro-angiogenic tissue factor expression in hypoxia-induced human lung cancer cells[J].Oncol Rep,2013,30(1):462-470.

