敲低CTCF腺病毒表达载体的构建及效果检测
王天艺,张彦,师明磊,赵志虎
军事医学科学院 生物工程研究所,北京 100071
CCCTC 结合因 子(CCCTC binding factor,CTCF,又称11-锌指蛋白)是一种进化上高度保守、广泛表达的多功能锌指蛋白,其与靶顺式元件的结合可阻断增强子和启动子的相互作用,是脊椎动物中惟一的绝缘子调节蛋白[1-2]。CTCF 参与很多细胞生物学过程,包括转录调控、绝缘活性、V(D)J重组、RNA 剪接和染色质结构调控[1-3]等。CTCF 作为一个广泛表达的绝缘子调节蛋白,对基因表达和远距离的染色质相互作用具有重要作用[3-5]。通过11 个锌指的不同组合,CTCF识别众多不同的靶标。通过自身的多聚化、多种翻译后修饰,或者与Cohesin、Suz2、YY1 等不同蛋白互作,介导广泛的染色质相互作用,作为基因组高级结构的主要组织者发挥众多不同的功能[6-7]。其异常与前列腺癌、乳腺癌、Wilmington肿瘤等的发生密切相关[8]。据报道,CTCF能与成视网膜细胞瘤发生相关基因Rb2/p130 启动子区结合,形成特定的构象以维持其转录活性,而加速肺癌的进展或有利于肿瘤的复发[9]。另外发现在几种肺癌细胞中,CTCF敲低后能引起端粒酶逆转录酶催化亚单位(TERT)的表达水平也降低,通过依赖于CTCF的增强子-启动子相互作用环,CTCF对于维持TERT表达起到重要作用,因而有利于细胞永生化和致癌作用[10]。但关于CTCF 在肺癌发生发展中的具体功能和其发挥功能的分子机制仍然了解不清。
RNA 干扰技术已被广泛用于基因结构功能和表达调控研究,构建RNA 干扰载体的方法很多,其中腺病毒是一种较为常见且广泛使用的方法[11]。本研究中,我们构建了腺病毒干扰载体敲低CTCF,为肺癌相关发病机制和治疗的研究奠定一定基础。
1 材料与方法
1.1 材料
人胚肾上皮细胞HEK293 细胞(ID:CRL-1573)和人肺腺癌细胞A549 细胞(ID:CCL-185)来自ATCC;人胚肾上皮细胞293A 细胞由本室保存;大肠杆菌DH5α感受态细胞购自北京天根生物公司;质粒pSUPERIOR.retro.puro和pAdTrack-CMV 由本室保存;培养基MEM/EBSS、DMEM/High Glucose和DMEM/F-12 1∶1 购自HyClone 公司;OPTI-MEM 购自Gibco公司;LipofectAMIN E2000试剂购自Invitrogen 公司;胶回收、PCR 产物回收试剂盒和质粒提取试剂盒均购自北京天根生物公司;限制性内切酶、连接酶购自TaKaRa公司;反转录试剂购自北京壹诺金生物科技有限公司;荧光定量检测试剂购自南京盛谱基因科技有限公司;兔抗CTCF抗体购自北京博奥森生物科技有限公司;抗GAPDH兔多克隆抗体和山羊抗兔IgG购自康为试剂公司。
1.2 CTCF小干扰RNA(siRNA)序列设计
CTCF 短发夹RNA(shRNA)1 的上游序列为GC AGAGAAAGTGGTTGGTAAT,下游序列为ATTACC AACCACTTTCTCTGC;CTCF shRNA2 的上游序列为GCGCTCTAAGAAAGAAGATTCCTCT,下游序列为AGAGGAATCTTCTTTCTTAGAGCGC。RT-qPCR 的CTCF 上游引物为5'-ATGTGCGATTACGCCAGTGT A-3',下游引物为5'-TGAAACGGACGCTCTCCAGT A-3';GAPDH 上游引物为5'-CATGAGAAGTATGA CAACAGCCT-3',下游引物为5'-AGTCCTTCCACG ATACCAAAGT-3'。PCR引物由金维智公司合成。
1.3 CTCF的RNA干扰载体构建
从文献[12]中获得CTCF 敲低靶序列,经Blast 比对正确后合成2 对寡核苷酸序列,退火、磷酸化后分别插入pSUPERIOR.retro.puro 载体,PCR 亚克隆H1启动子表达框,酶切连接到pAdTrack-CMV 载体,电转BJ5183 感受态细胞,鉴定重组质粒(30 kb),转染293A细胞,收获腺病毒。
1.4 293A细胞培养和腺病毒包装
新复苏的293A 细胞用含10%胎牛血清的DMEM/High Glucose 培养基于37℃、5% CO2培养箱中培养,每隔3 d换液,将细胞传至60 mm 培养皿至细胞密度达80%~90%后进行转染。将1μg 质粒DNA和3μL LipofectAMINE 2000 分别用无血清、无双抗的Opti-MEM 培养基稀释,室温放置5 min,然后将上述2 种液体混匀,室温放置20 min,加入60 mm 培养皿中,晃动混匀培养液,37℃、5% CO2条件培养5~7 d后收获病毒。
HEK293细胞的培养同上,培养基换为含10%胎牛血清的MEM/EBSS培养基。
1.5 Western印迹检测CTCF的表达
将人胚肾HEK293 传代至生长密度为80%~90%,分别接入包装好的敲低腺病毒和空白对照GFP 病毒,于培养箱中培养,期间用荧光倒置显微镜观察病毒感染比例;2~3 d 后收获细胞,加入RIPA细胞裂解液,收获蛋白;BCA定量后取适量蛋白加入SDS上样缓冲液,煮沸5~10 min,离心后取上清进行SDS-PAGE;电泳结束后转至硝酸纤维素膜,用含5%牛奶的TBST 封闭1 h,加入抗CTCF 多克隆抗体(1∶500 稀释),4℃孵育过夜;用1×TBST 洗5 次,每次6 min,加入辣根过氧化物酶标记的山羊抗兔IgG(1∶3000 稀释),室温孵育1 h;用1×TBST 洗5 次,每次6 min,加入底物发光液进行曝光显影。
1.6 RT-PCR检测CTCF的表达
分别收集感染细胞,加入TRIzol 试剂提取总RNA后定量,取1μg RNA 进行反转录,参照试剂说明合成第一条cDNA链,以其为模板,用RT-qPCR仪进行实时定量,收集荧光信号并检测实验组和对照组中相关基因的表达,分析各组扩增的Ct 值和相对表达丰度。
1.7 A549细胞培养、腺病毒感染和CTCF的检测
将A549 细胞复苏于含10%胎牛血清的DMEM/F-12 1∶1 培养基中,于37℃、5% CO2培养箱中培养,每隔3 d 换液,待细胞生长状态良好,将细胞传代于六孔板,待细胞生长密度达到约80%,分别感染腺病毒和GFP 空白对照病毒,2~3 d 后,在荧光倒置显微镜下观察转染效率并收集细胞。
Western 印迹和RT-PCR 检测CTCF 的表达方法同上。
2 结果
2.1 CTCF shRNA腺病毒载体的构建
将合成的2 对寡核苷酸序列分别进行退火、磷酸化后,连接pSUPERIOR.retro.puro 载体,转化后挑克隆提质粒,经SmaⅠ酶切应产生3 条带,分别为1000、1750、3600 bp(图1),电泳显示完全正确;质粒测序结果表明CTCF shRNA 已插入载体且序列与预期完全一致(图2)。PCR亚克隆H1启动子表达框后连接到pAdTrack-CMV 载体,电转BJ5183 感受态细胞获得正确的重组质粒(30 kb),此重组质粒在293A细胞中将包装为表达CTCF shRNA的腺病毒。
2.2 利用HEK293 细胞检测CTCF shRNA 对CTCF的抑制效果
CTCF shRNA 腺病毒包装完成后,在HEK293细胞中分别感染CTCF shRNA和空白对照GFP 病毒,2~3 d 后分别收获细胞蛋白和提取RNA。蛋白SDS-PAGE 及Western 印迹结果显示,与对照GFP 腺病毒组相比,表达CTCF shRNA 的2 个试验组蛋白水平都明显降低(图3)。对RNA 进行RT-qPCR 检测,发现CTCF shRNA1、shRNA2 号片段都能较好地抑制CTCF 的转录水平。说明这2 株表达CTCF shRNA 的腺病毒在蛋白和mRNA 水平上都具有较好的抑制效果。
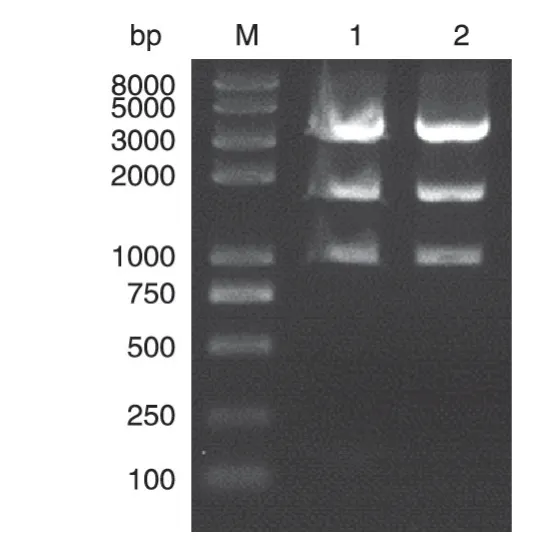
图1 CTCF shRNA片段与pSUPERIOR.retro.puro载体连接后经SmaⅠ酶切产物的电泳图谱

图2 CTCF shRNA重组质粒的测序结果
2.3 在A549 细胞中验证CTCF shRNA 腺病毒对CTCF的蛋白和基因转录水平的抑制效果
在含有内源性CTCF 的人肺腺癌A549 细胞中,分别转染CTCF shRNA和空白对照GFP 病毒后,收获蛋白和RNA 进行检测。Western 印迹和RT-PCR结果表明,与空白对照相比,感染了CTCF shRNA 腺病毒的A549 细胞中CTCF 的蛋白表达(图5)和RNA水平(图6)都明显降低,且shRNA1 的效应更明显。说明构建的2株CTCF shRNA腺病毒均有效。
3 讨论

图3 Western印迹检测HEK293细胞中CTCF shRNA的敲低效果

图4 RT-qPCR检测HEK293细胞中CTCF shRNA的敲低效果

图5 Western印迹检测A549细胞中CTCF shRNA的敲低效果

图6 RT-qPCR检测A549细胞中CTCF shRNA的敲低效果
CTCF 是一种进化上高度保守的多功能锌指蛋白,在不同细胞中广泛表达且结合位点众多[13],并通过调节多种靶蛋白和基因的增强或绝缘作用而发挥重要。据现有报道,CTCF的异常与多种肿瘤发生和生理异常紧密相关。肺癌作为全世界尤其是我国的高发肿瘤疾病之一,了解其发生发展的分子机制和关键调控因子,寻找合适的控制手段和治疗靶标,对于有效预防和控制其发生和恶化尤其重要。在本研究中,我们构建了2 个CTCF shRNA 表达腺病毒载体,其中shRNA1 的效果更为明显。这将为研究和比较CTCF敲低前后,肺癌中关键调控因子和蛋白的表达变化、细胞内染色体构象改变及肺癌细胞的永生和致癌能力变化等提供重要手段,有利于探讨肺癌发生发展的具体机制并进一步寻求控制肺癌进展的有效手段。
[1]Phillips J E,Corces V G.CTCF:master weaver of the genome[J].Cell,2009,137(7):1194-1211.
[2]Yusufzai T M,Tagami H,Nakatani Y,et al.CTCF tethers an insulator to subnuclear sites,suggesting shared insulator mechanisms across species[J].Mol Cell,2004,13(2):291-298.
[3]Hou C,Zhao H,Tanimoto K,et al.CTCF-dependent enhancer-blocking by alternative chromatin loop formation[J].Proc Natl Acad Sci USA,2008,105(51):20398-20403.
[4]Shukla S,Kavak E,Gregory M,et al.CTCF-promoted RNA polymerase II pausing links DNA methylation to splicing[J].Nature,2011,479(7371):74-79.
[5]Bell A C,Felsenfeld G.Methylation of a CTCF-dependent boundary controls imprinted expression of the Igf2 gene[J].Nature,2000,405(6785):482-485.
[6]Rubio E D,Reiss D J,Welcsh P L,et al.CTCF physically links cohesin to chromatin[J].Proc Natl Acad Sci USA,2008,105(24):8309-8314.
[7]Huang K,Jia J,Wu C,et al.Ribosomal RNA gene transcription mediated by the master genome regulator protein CTCF is negatively regulated by condensin complex[J].J Biol Chem,2013,288(36):26067-26077.
[8]Ohlsson R,Renkawitz R,Lobanenkov V.CTCF is a uniquely versatile transcription regulator linked to epigenetics and disease[J].Trends Genet,2001,17(9):520-527.
[9]Fiorentino F P,Macaluso M,Miranda F,et al.CTCF and BORIS regulate Rb2/p130 gene transcription:a novel mechanism and a new paradigm for understanding the biology of lung cancer[J].Mol Cancer Res,2011,9(2):225-233.
[10]Eldholm V,Haugen A,Zienolddiny S.CTCF mediates the TERT enhancer-promoter interactions in lung cancer cells:identification of a novel enhancer region involved in the regulation of TERT gene[J].Int J Cancer,2014,134(10):2305-2313.
[11]He T C,Zhou S,da Costa L T,et al.A simplified system for generating recombinant adenoviruses[J].Proc Natl Acad Sci USA,1998,95(5):2509-2514.
[12]Schmidt D,Schwalie P C,Ross-Innes C S,et al.A CTCF-independent role for cohesin in tissue-specific transcription[J].Genome Res,2010,20(5):578-588.
[13]Kim T H,Abdullaev Z K,Smith A D,et al.Analysis of the vertebrate insulator protein CTCF-binding sites in the human genome[J].Cell,2007,128(6):1231-1245.

