表达小鼠粒细胞-巨噬细胞集落刺激因子的重组非复制型痘苗病毒的构建及鉴定
庞聪,任皎,赵莉,阳静,王平兴,阮力,谭文杰,田厚文
中国疾病预防控制中心 病毒病预防控制所病毒病应急技术中心,北京 102206
粒细胞-巨噬细胞集落刺激因子(granulocytemacrophage colony stimulating factor,GM-CSF)是一种白细胞生长因子,它能刺激干细胞向粒细胞和单核细胞的方向分化,因此,人们常利用病毒载体表达GM-CSF,使其发挥佐剂的作用提高免疫效果,而该领域的许多研究都表现出较好的前景[1-3]。比如,最近Bramante 等报道了一种表达GM-CSF 的不同血清型嵌合腺病毒在人体模型中的肉瘤治疗效果,治疗前12 位病人疾病均在进展中,治疗后其中2 位病情部分缓解,4 位病情稳定,只剩一半病人(6 位)疾病仍在进展中[1]。另一些表达GM-CSF 的单纯疱疹病毒(HSV)和痘苗病毒的研究也取得较好的治疗效果,这些研究还进一步提示,免疫治疗效果的提高似乎与表达的GM-CSF本身介导的肿瘤破坏有关[2]。
痘苗病毒表达系统是广泛使用的真核表达系统,它有长期人体应用历史,病毒在胞浆中复制,无致癌风险,细胞嗜性广泛,可插入大的基因片段(至少25 kb),接种后可引发持久的针对外源抗原的中和抗体和毒性T 细胞反应[4-5]。非复制型痘苗病毒天坛株是将痘苗病毒天坛株C、K片段间的与宿主范围和毒力相关基因缺失而成,与原天坛株痘苗病毒相比,它的毒力明显下降,不能在人源细胞中有效繁殖,不产生或仅产生极低滴度的子代病毒,却保留了与原天坛株痘苗病毒相近的DNA 复制、RNA 转录与蛋白质翻译功能[6]。
我们注意到GM-CSF 有很强的种属特异性。成熟小鼠GM-CSF的氨基酸序列与犬、猫、人和猪GMCSF 有49%~54%的一致性,与大鼠GM-CSF 有69%的一致性[7-8]。而GM-CSF的活性在人和鼠中也存在种属特异性,小鼠GM-CSF 对大鼠细胞只有微弱活性,而大鼠GM-CSF 对小鼠细胞有全部活性[9-10]。因此,为了在小鼠肿瘤模型中准确评价GM-CSF 作为佐剂对病毒载体抑瘤效果的影响,我们选择小鼠GM-CSF作为目的基因。
在本研究中,我们以我国具有自主知识产权的非复制型痘苗病毒天坛株为载体,表达有生物学活性的小鼠GM-CSF,为GM-CSF 作为非复制型病毒病毒载体疫苗佐剂的研究奠定基础。
1 材料和方法
1.1 材料
8 日龄SPF 级鸡胚购自北京梅里亚维通实验动物技术有限公司;FDC-P1细胞购自中国医学科学院基础医学研究所基础医学细胞中心;大肠杆菌DH5α和非复制型痘苗病毒天坛株(NTV)由本实验室保存;小鼠GM-CSF(GI:145301581)基因来自GenBank,本研究采用该基因290~715 bp 的编码序列,共426 bp;pJSBH6LacZ 为H6 启动子带有LacZ基因的痘苗病毒重组质粒,由本科室前期构建。
限制性内切酶购自NEB 公司;脂质体转染所用LipofectAMINE 2000 购自Invitrogen 公司;Taq酶(含dNTP和缓冲液)购自TaKaRa 公司;羊抗鼠GM-CSF抗体购自Santa Cruz 公司;驴抗羊红外标记抗体购自LI-COR Biosciences 公司;小鼠GM-CSF 标准品购自R&D公司。
1.2 小鼠GM-CSF基因的合成
从GenBank 下载小鼠GM-CSF 基因序列(426 bp),在其5'和3'端都加上GGATCC 序列(BamHⅠ酶切位点),然后送公司合成,将合成的基因插入pUC18载体的BamHⅠ酶切位点,得到的质粒命名为pMDGMCSF。
1.3 重组痘苗病毒表达质粒pJSB75GMCSFH6LacZ的构建
用BamHⅠ将pMDGMCSF 中的小鼠GM-CSF 基因切下作为目的基因片段,用BamH Ⅰ将pJSBH6LacZ 酶切作为载体,将二者用快速T4DNA连接酶连接,然后转染大肠杆菌筛选单斑菌落。通过小提酶切鉴定及测序确定正向插入目的基因的质粒,经37℃过夜培养阳性菌株后大提质粒,-20℃保存备用。
1.4 重组痘苗病毒rNTVGMCSFLacZ的构建
用非复制型痘苗病毒天坛株0.1 PFU/细胞感染70%~90%成片的鸡胚成纤维细胞(CEF),33℃吸附2 h 后,将14.4μg pJSB75GMCSFH6LacZ 用LipofectAMINE 2000试剂转染CEF,33℃孵育3 d,-70℃反复冻融3 次,作为重组病毒液;将重组病毒液用CEF 于33℃孵育3 d,用含2%中性红和1‰ X-Gal的营养琼脂铺斑,利用重组病毒携带的蓝色标记挑出蓝病毒斑,于-70℃反复冻融3 次后继续染毒,如此连续单斑纯化4代,获得重组病毒。
1.5 rNTVGMCSFLacZ的PCR鉴定
用0.1 PFU/细胞的重组病毒感染CEF,33℃孵育3 d,用DNeasy Blood&Tissue 试剂盒(QIAGEN 公司)提取病毒DNA,然后以P7.5-1(5'CACTAATTCC AAACCCACCC3')和GMCSF(R)(5'ATCCGCATAG GTGGTAACTTGTGT3')分别作为上、下游引物对病毒DNA 进行PCR 扩增(扩增循环参数:94℃预变性5 min;94℃变性40 s,58℃退火30 s,72℃延伸90 min,30 个循环;72℃延伸10 min)。取PCR 扩增产物进行DNA 电泳,同时将上述引物和PCR 扩增产物各10μL送擎科公司测序,鉴定PCR扩增产物序列。
1.6 rNTVGMCSFLacZ的Western印迹
以10 PFU/细胞的rNTVGMCSFLacZ 感染成片的CEF,24 h 后将5 mL 培养液超滤浓缩至1/10,取100μL 加入SDS-PAGE 上样缓冲液,作为培养液样品;将细胞用冰冷的PBS 洗2 次后刮下离心,收获的细胞沉淀用100μL SDS-PAGE 上样缓冲液重悬,作为细胞样品;将样品煮沸3~5 min 后离心,取上清25μL 进行15%的SDS-PAGE,将蛋白电转移到硝酸纤维素膜,以羊抗鼠GM-CSF抗体(1∶200稀释)为一抗、驴抗羊红外标记抗体(1∶5000 稀释)为二抗,用Odyssey红外扫描仪检测发光信号。
1.7 小鼠GM-CSF的生物学活性检测
将传代的FDC-P1细胞用Hank's液洗3次,用含10%胎牛血清的改良RPMI 1640培养基稀释后接种96 孔板,每孔1×104细胞,再加入rNTVGMCSFLacZ感染CEF 的培养基上清100μL,同时设小鼠GMCSF 标准品(50 ng/mL)作为阳性对照孔,rNTVLacZ感染CEF 的培养基上清作为阴性对照孔,均加入100μL。每天在显微镜下观察记录细胞生长情况。
2 结果
2.1 小鼠GM-CSF基因的合成
小鼠GM-CSF 基因序列(426 bp)由公司合成,将合成的基因插入pUC18 载体的BamHⅠ酶切位点,得到质粒pMDGMCSF,测序结果表明小鼠GMCSF基因序列与设计相符。
2.2 小鼠GM-CSF重组痘苗病毒质粒的构建和鉴定
将pMDGMCSF 中的小鼠GM-CSF 基因酶切回收,插入pJSBH6LacZ 的7.5 启动子下,经酶切电泳后,出现条带的数目和大小与预期相符,测序结果也表明目的基因序列与设计相符。将构建的质粒命名为pJSB75GMCSFH6LacZ(图1)。
2.3 表达小鼠GM-CSF 的重组非复制型痘苗病毒rNTVGMCSFLacZ的构建和鉴定
为了获得表达小鼠GM-CSF 的重组非复制型痘苗病毒,首先用质粒pJSB75GMCSFH6LacZ和非复制型痘苗病毒天坛株在TK区进行同源重组,将质粒中7.5 启动子下的小鼠GM-CSF 基因和H6 启动子下的LacZ 基因同源重组到NTV 的TK 区J片段中,然后利用重组病毒携带的蓝色筛选标记连续单斑纯化4 代后,将获得的重组病毒命名为rNTVGMCSFLacZ,其结构如图2所示。
将病毒DNA进行PCR扩增,其产物进行DNA电泳,以rNTVLacZ(一株非复制型痘苗病毒,J 片段中插入LacZ 基因)作为阴性对照,电泳结果(图3)显示扩增出的片段与预期504 bp 相符,测序结果也显示小鼠GM-CSF基因的序列正确。
将病毒蛋白用抗羊抗鼠GM-CSF 抗体进行Western 印迹,以小鼠GM-CSF 标准品和rNTVLacZ分别作为阳、阴性对照。Western 印迹结果(图4)显示,在病毒培养上清中出现相对分子质量(Mr)约17×103的蛋白,与理论预测的小鼠GM-CSF 的Mr(16×103)接近,证明rNTVGMCSFLacZ 在鸡胚细胞中能够分泌表达小鼠GM-CSF;在病毒感染细胞中未检测到目的蛋白。
以上PCR 鉴定和Western 印迹结果表明,rNTVGMCSFLacZ 中正确插入了小鼠GM-CSF 基因,且该病毒在鸡胚细胞中能分泌表达小鼠GM-CSF。
2.4 rNTVGMCSFLacZ 表达的小鼠GM-CSF 的生物学活性检测
FDC-P1 细胞是一株IL-3 或小鼠GM-CSF 依赖的骨髓细胞系[11],因此可以用rNTVGMCSFLacZ 感染CEF 的培养基上清培养FDC-P1 细胞,根据它的增殖情况反映rNTVGMCSFLacZ 是否能分泌有生物学活性的小鼠GM-CSF。
从培养0和2 d时各孔细胞状况的照片可知,培养2 d 时(图片未显示),rNTVGMCSFLacZ 感染CEF的培养基上清孔和小鼠GM-CSF 标准品孔中的细胞密度明显高于rNTVLacZ 感染CEF的培养基上清孔,100 倍放大视野下的照片(图5)从局部更清楚地显示了这种细胞密度差异和细胞活性状态,而开始培养时(图片未显示)各孔中细胞数大致相同。以上结果说明,rNTVGMCSFLacZ 能够分泌有生物学活性的小鼠GM-CSF。
3 讨论
GM-CSF 是分泌型蛋白,较早表达GM-CSF 的研究都在细胞培养上清中检测GM-CSF[12-13],而本研究也是在病毒感染细胞上清而非病毒感染细胞中检测到目的蛋白,与之前的报道一致。另外,我们检测到的目的蛋白比小鼠GM-CSF 标准品(Mr为14×103)略大,可能与本研究所用的小鼠GM-CSF 标准品是大肠杆菌原核系统表达,而病毒载体表达的小鼠GM-CSF 是真核系统表达,因不同系统加工修饰方式造成了小鼠GM-CSF 大小的差异,根据基因大小,理论推测的小鼠GM-CSF的Mr为16×103。
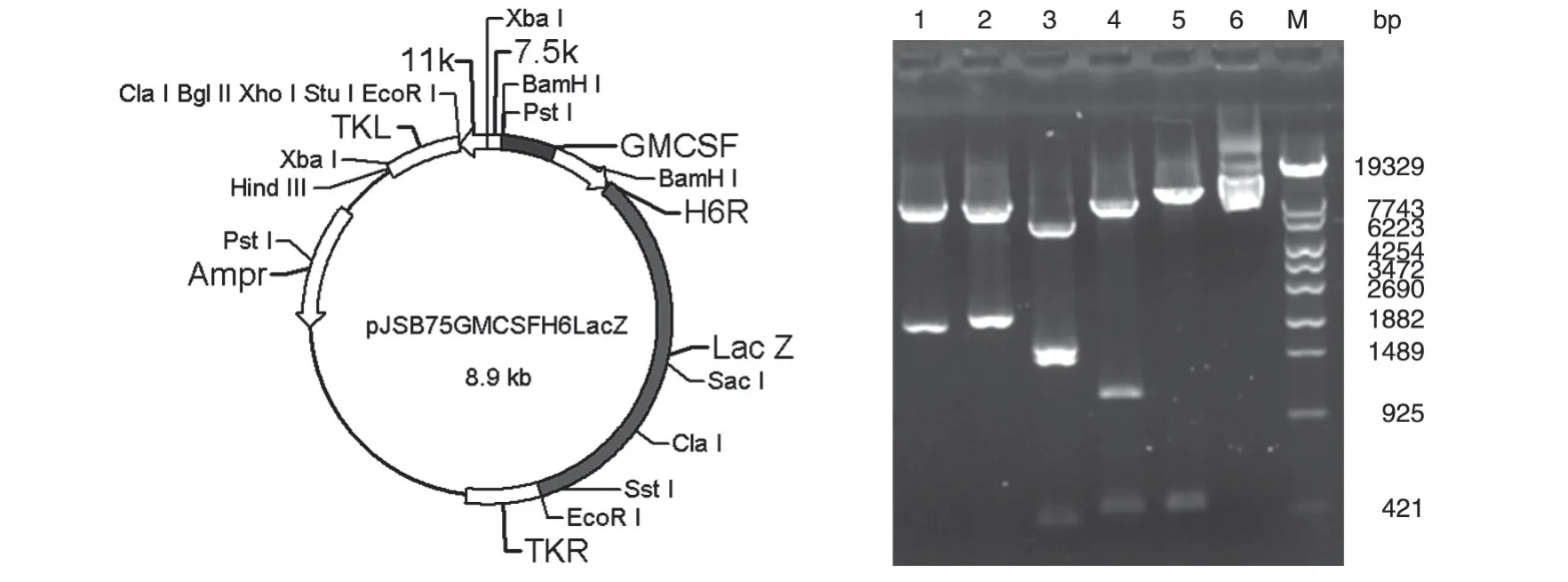
图1 pJSB75GMCSFH6LacZ的结构示意图和酶切电泳图
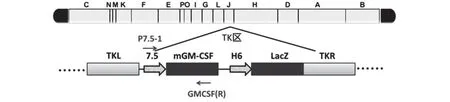
图2 rNTVGMCSFLacZ的结构和引物位置简图
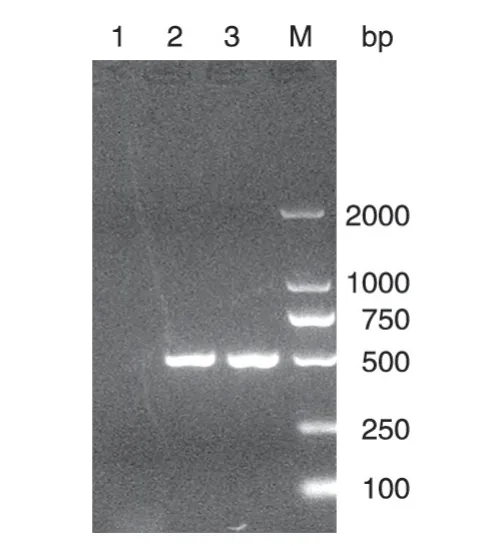
图3 rNTVGMCSFLacZ的PCR鉴定结果

图4 rNTVGMCSFLacZ表达小鼠GM-CSF的Western印迹
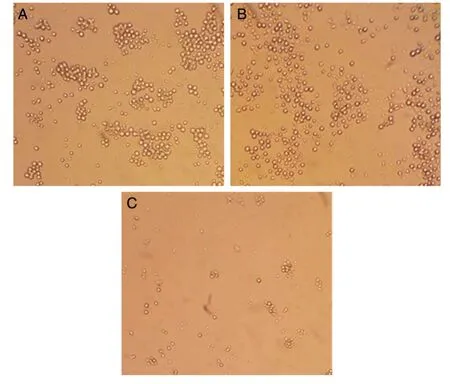
图5 培养2 d时100倍放大视野下各孔中的细胞状况
目前,我们仅通过FDC-P1 细胞培养方法初步检测了rNTVGMCSFLacZ 分泌表达的小鼠GM-CSF的生物学活性,下一步考虑用MTT 法对小鼠GMCSF的表达水平进行定量。
获得能分泌表达有生物学活性的小鼠GM-CSF的重组非复制型痘苗病毒rNTVGMCSFLacZ后,我们将使之与其他肿瘤治疗性疫苗,如表达宫颈癌肿瘤靶抗原HPV16E6、E7的重组非复制型痘苗病毒疫苗[14]或HPV16L2E6E7 融合蛋白疫苗[15]联合免疫小鼠,评价rNTVGMCSFLacZ作为佐剂的效果,以及其在不同剂量下对小鼠免疫反应的影响,同时与原核表达的GM-CSF 作为佐剂进行对比分析,探讨细胞因子在体内表达作为肿瘤免疫治疗佐剂的应用前景。
[1]Bramante S,Koski A,Kipar A,et al.Serotype chimeric oncolytic adenovirus coding for GM-CSF for treatment of sarcoma in rodents and humans[J].Int J Cancer,2014,135(3):720-730.
[2]Thorne S H.The role of GM-CSF in enhancing immunotherapy of cancer[J].Immunotherapy,2013,5(8):817-819.
[3]Kozlowska A,Mackiewicz J,Mackiewicz A.Therapeutic gene modified cell based cancer vaccines[J].Gene,2013,525(2):200-207.
[4]Pastoret P P,Vanderplasschen A.Poxviruses as vaccine vectors[J].Comp Immunol Microbiol Infect Dis,2003,26(5-6):343-355.
[5]Gomez C E,Najera J L,Krupa M,et al.MVA and NYVAC as vaccines against emergent infectious diseases and cancer[J].Curr Gene Ther,2011,11(3):189-217.
[6]阮力,朱既明,娄元梅,等.复制缺陷型天坛株痘苗病毒[P].中国专利,200610056800.0,2008-06-11.
[7]Onetto-Pothier N,Aumont N,Haman A,et al.Characterization of granulocyte-macrophage colony-stimulating factor receptor on the blast cells of acute myeloblastic leukemia[J].Blood,1990,75(1):59-66.
[8]Hayashida K,Kitamura T,Gorman D M,et al.Molecular cloning of a second subunit of the receptor for human granulocyte-macrophage colony-stimulating factor(GM-CSF):reconstitution of a high-affinity GM-CSF receptor[J].Proc Natl Acad Sci USA,1990,87(24):9655-9659.
[9]Oaks M K,Penwell R T,Suh C H,et al.Polymerase chain reaction cloning and expression of the rat granulocyte-macrophage colony-stimulating factor[J].J Interferon Cytokine Res,1995,15(12):1095-1102.
[10]Vandenabeele P,Guisez Y,Declercq W,et al.Response of murine cell lines to an IL-1/IL-2-induced factor in a rat/mouse T hybridoma(PC60):differential induction of cytokines by human IL-1 alpha and IL-1 beta and partial amino acid sequence of rat GM-CSF[J].Lymphokine Res,1990,9(3):381-389.
[11]Dexter T M,Garland J,Scott D,et al.Growth of factor-dependent hemopoietic precursor cell lines[J].J Exp Med,1980,152(4):1036-1047.
[12]Gong J Y,Liu X,Dong Y,et al.Construction and expression of a recombinant eukaryotic expression plasmid containing the genes of hepatitis B virus and the gene:A study of its immunomodulatory effects[J].Biomed Rep,2013,1(2):251-256.
[13]董金凯,高江平,阎瑾琦,等.抗肿瘤免疫基因治疗剂pVAXIL-12-GB 的构建及体内外表达验证[J].南方医科大学学报,2012,32(6):760-765.
[14]田厚文,任皎,黄薇,等.表达人乳头瘤病毒16 型E6/E7 融合蛋白的非复制型重组痘苗病毒的构建及免疫效果观察[J].病毒学报,2006,22(5):358-363.
[15]赵莉,高孟,田厚文,等.人乳头瘤病毒16 型融合蛋白的大肠杆菌高效表达及对肿瘤生长的抑制作用[J].中华肿瘤杂志,2012,34(11):810-815.

