人GST-14-3-3σ融合蛋白的原核表达、纯化及活性检测
黄蓉 ,徐小洁,王涛,冯滢滢,周丽英,李玲,冀全博,杜楠,叶棋浓
1.解放军总医院 第一附属医院,北京 100048;2.军事医学科学院 生物工程研究所,北京 100850
14-3-3 是一个高度保守的基因家族,在真核细胞中广泛分布,并参与许多重要的细胞生理过程,如生长分化、周期调控和凋亡、信号传导和迁移,以及恶性肿瘤的形成等[1]。14-3-3 蛋白最初是在哺乳动物的大脑中发现的[2],目前在哺乳动物中至少存在7 个亚型(β,ε,η,γ,τ,ζ和σ)[3]。14-3-3 蛋白相对分子质量为(25~30)×103,是一个调节蛋白家族[4],可通过与靶蛋白结合,调控蛋白活性及蛋白胞内定位等,从而调节细胞G2/M 期和G1/S 期转换[5],参与肿瘤的发生发展[6-7]。为了深入研究14-3-3 在调控细胞周期中的相互作用蛋白,我们从人乳腺文库中扩增出14-3-3σ基因的全长编码序列,通过连接原核表达载体构建含14-3-3σ基因的重组质粒,在原核系统中表达并纯化得到14-3-3σ蛋白,检测其生物活性,为后续探讨14-3-3σ蛋白在调控细胞周期运行与肿瘤发生发展中的作用奠定了实验学基础。
1 材料和方法[8]
1.1 材料
人乳腺文库,人胚肾细胞293T,大肠杆菌DH5α、Rossate,原核表达载体pGEX-KG 为本室保存;BamHⅠ和EcoRⅠ限制性核酸内切酶、高保真Primer STAR HS DNA 聚合酶、T4DNA 连接酶为TaKaRa 公司产品;VigoFect 为威格拉斯生物技术有限公司产品;质粒提取试剂盒为Promega 公司产品;GST-Sepharose 4B珠子购自Pharmacia公司;DNA胶回收试剂盒、PCR 产物回收试剂盒为北京天根生物科技有限公司产品;辣根过氧化物酶偶联的抗GST、FLAG 单克隆抗体(mAb)购自Sigma 公司;其余化学试剂为国产分析纯产品;测序由北京华大基因公司完成。
1.2 人14-3-3σ全长编码区基因的扩增
以人乳腺文库为模板,根据文献报道的人14-3-3σ基因序列合成上游引物(5'-CGGGATCCATG GAGAGAGCCAGTCTGATCCA-3')和下游引物(5'-CGGAATTCTCAGCTCTGGGGCTCCTGGGG-3'),用Primer STAR HS DNA 聚合酶,PCR 扩增人14-3-3σ基因片段(扩增条件:95℃5 min 预变性,然后以94℃ 1 min、62℃ 45 s、72℃ 1 min 行30 个循环,72℃延伸7 min)。扩增产物经10 g/L 琼脂糖DNA胶检测,以琼脂糖DNA胶回收试剂盒回收。
1.3 重组质粒的构建及原核表达鉴定
胶回收的扩增产物用BamHⅠ、EcoRⅠ双酶切,载体pGEX-KG也用相同酶双酶切,胶回收载体大片段,将2 个酶切产物用T4DNA 连接酶于16℃连接12 h后转化大肠杆菌DH5α,涂LB(Amp抗性)平板,37℃培养过夜,挑选单克隆,提取质粒,经BamHⅠ、EcoRⅠ双酶切鉴定,将正确质粒送北京华大基因公司测序。
1.4 融合蛋白GST-14-3-3σ在大肠杆菌中的小量诱导表达及鉴定
将鉴定正确的重组表达质粒pGEX-KG-14-3-3σ转化大肠杆菌Rossate 感受态细胞,挑取菌落,37℃振荡培养至D600nm为0.6~1.0,加入IPTG 至终浓度为1 mmol/L,37℃继续培养4~6 h,离心收集菌体,进行SDS-PAGE和Western印迹检测。
1.5 融合蛋白GST-14-3-3σ的纯化
分别将含pGEX-KG-14-3-3σ和含pGEX-KG空载体的Rossate 菌株同时接种于Amp 抗性的LB 液体培养基中,37℃振荡培养过夜活化,按2%的比例转接于同种液体培养基中,30℃振荡培养至D600nm为0.4~0.6,加入IPTG 至终浓度为0.1 mmol/L,20℃继续培养20 h 以上,离心收集菌体,按Pharmacia 公司提供的方法进行GST 融合蛋白的纯化,加入裂解液进行超声波破碎,12 000 r/min 离心收集上清,加入适量GST-Sepharose 4B 珠子,4℃旋转结合4 h 后3000 r/min 低速离心收集GST-Sepharose 4B 小颗粒,缓冲液充分洗脱未结合蛋白质,最后以SDSPAGE鉴定纯化蛋白。
1.6 GST pull-down分析
将人胚肾细胞293T 以70%的密度,用含双抗、10%胎牛血清的DMEM 培养基接种于直径为6 cm的培养皿中,培养24 h后,用VigoFect转染试剂将带Flag 标签的AKT 真核表达质粒转染293T 细胞,4~6 h 后换培养液,在37℃、5% CO2条件下培养24 h,收细胞后加入IP 缓冲液500μL,冰上裂解细胞30 min,将裂解的细胞于冰上超声波破碎,12 000 r/min、4℃离心10 min,收集上清,将上步纯化的GST-14-3-3σ蛋白及GST 蛋白分别加到细胞裂解后的上清中,4℃旋转结合3~6 h,3000 r/min 离心收集珠子,缓冲液充分洗脱未结合蛋白,Western印迹检测2种蛋白质之间是否存在体外直接相互作用。
2 结果
2.1 人14-3-3σ编码区基因的克隆
以人乳腺文库为模板扩增获得约750 bp 的PCR产物,与预期片段大小一致(图1)。
2.2 重组表达载体pGEX-14-3-3σ的构建与鉴定
将PCR 产物和pGEX-KG 载体分别用BamHⅠ和EcoRⅠ双酶切,将2 个酶切产物用T4DNA 连接酶连接,转化大肠杆菌DH5α,挑选阳性克隆,提质粒后酶切鉴定,DNA 凝胶电泳可见约750 bp 的条带(图2),表明14-3-3σ基因编码序列已插入pGEXKG 上游的多克隆位点中。DNA 序列测定结果显示与已知序列完全一致,且无突变发生(数据略)。

图1 目的基因14-3-3σ的PCR扩增
2.3 融合蛋白GST-14-3-3σ的诱导表达及鉴定
将pGEX-KG 空载体和鉴定正确的重组质粒pGST-14-3-3σ分别转化Rossate 感受态细胞,挑选克隆并振荡培养,经IPTG 于37℃小量诱导3~4 h 后收集菌体,对诱导前后的菌体用考马斯亮蓝染色鉴定和Western 印迹检测,发现GST-14-3-3σ融合蛋白表达正确(图3)。
2.4 融合蛋白GST-14-3-3σ的纯化
用GST-Sepharose 4B 亲和珠纯化获得融合蛋白GST-14-3-3σ,考马斯亮蓝染色鉴定结果显示纯化效果较好,得到纯度较高的GST-14-3-3σ融合蛋白和GST蛋白(图4)。
2.5 GST pull-down分析
根据文献报道,14-3-3蛋白可与AKT 蛋白相互作用,可据此进一步证实纯化的GST-14-3-3σ融合蛋白是否具有生物学活性。将带有GST-14-3-3σ的纯化珠子与过表达Flag-AKT 的293T 细胞裂解液于4℃结合3~4 h,用抗Flag-HRP 抗体(1∶2000 稀释)行Western 印迹检测,结果显示AKT 蛋白(Mr约57 000)位置有特异性条带(图5),而GST 载体蛋白在同一位置无此条带,说明14-3-3σ蛋白与AKT 蛋白能够在体外特异性结合并相互作用,且GST 标签并不影响14-3-3σ蛋白的结构及其生物学功能。
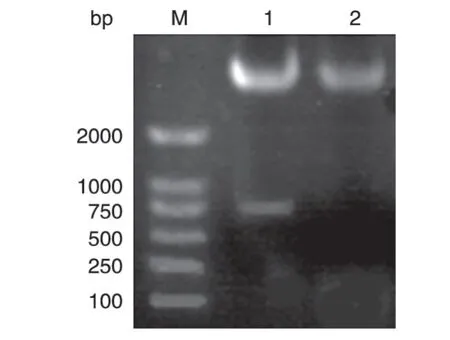
图2 重组质粒GST-14-3-3σ的酶切鉴定

图3 GST-14-3-3σ融合蛋白的SDS-PAGE(A)和Western印迹(B)
3 讨论
哺乳动物的14-3-3 蛋白是由2 个单体连接形成的杯状二聚体结构,每个单体由9个α螺旋反向平行排列成“L”型结构,其二聚体界面主要由一个单体的αA 与另一个单体的αC和αD 构成,疏水性残基和极性残基共同形成高度保守的兼性沟槽,是调节14-3-3 与靶蛋白结合的结构基础[9-10]。目前已发现200 多种蛋白可与14-3-3 蛋白家族成员相互作用,作用方式主要有2 种,即磷酸化和非磷酸化。大多数蛋白通过磷酸化途径与14-3-3蛋白相互作用,这类蛋白主要包括受体蛋白(IGF-1)、转录调控蛋白、细胞周期调控蛋白(Cdc25、P53)等[11];还有少数蛋白如Bax以非磷酸化途径和14-3-3蛋白相互作用。
14-3-3 蛋白调控靶蛋白的方式主要有以下几种:①改变靶蛋白与其他结合蛋白的相互作用,如14-3-3 蛋白和Bad 结合,促使Bad和Bcl-xL/Bcl-2分离[12];②保护靶蛋白,使其免于蛋白酶或磷酸酶的作用,如14-3-3 蛋白可使Raf 免于磷酸酶的去磷酸化作用[13];③抑制或增强靶蛋白的催化活性,如14-3-3蛋白可抑制ASK-1的活性[14];④调控靶蛋白核浆转运及亚细胞定位,如14-3-3 蛋白可促进Cdc2/周期蛋白B1 复合物由细胞核向胞浆转运[15];⑤作为支架蛋白/接头蛋白,介导靶蛋白之间的相互作用,如14-3-3 蛋白可以介导Raf和Brc、Raf和PKC 的相互作用[16];⑥改变靶蛋白DNA 结合活性,如DNA 损伤后,14-3-3蛋白可与P53结合,增强P53的DNA结合活性[17]。以上几种调控机制既可以单独作用,也能够同时发生,如14-3-3 蛋白与Bad 结合后,一方面使Bad 与Bcl-2/Bcl-xL 分离,促使其从细胞线粒体转运到细胞浆,另一方面又可保护其免受钙调磷酸酶的水解作用[18]。
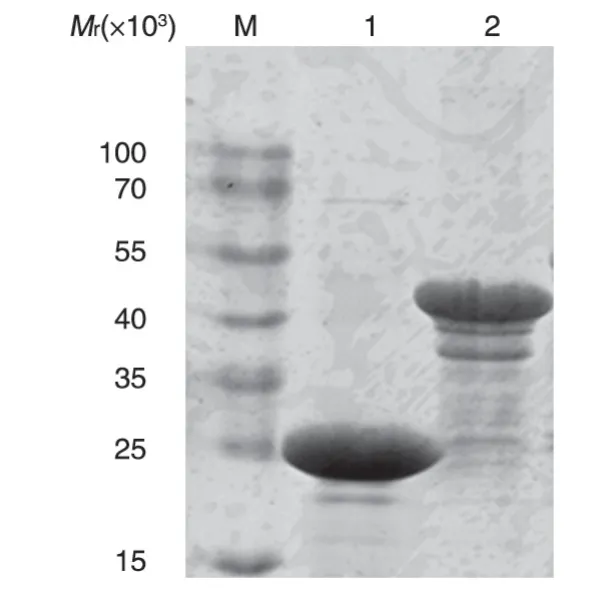
图4 纯化的GST-14-3-3σ融合蛋白的SDS-PAGE分析

图5 GST pull-down实验检测14-3-3σ和AKT蛋白的相互作用
AKT 又称蛋白激酶B(protein kinase B,PKB),是一种丝氨酸/苏氨酸蛋白激酶,与肿瘤的发生、发展、转移及预后密切相关。有实验报道,14-3-3σ可负调控AKT 进而影响细胞的成瘤性[19]。AKT/PKB是Bad(Bcl-xL/Bcl-2-assosiated death promotor)强有力的激酶,活化的AKT 能在体外使Bad 中与14-3-3 蛋白结合相关的S112 或S136 位点磷酸化[20],导致14-3-3 蛋白与Bad 结合进而抑制细胞凋亡。本实验主要利用AKT 与14-3-3 蛋白的体外相互作用证实了融合蛋白14-3-3的生物学活性。
综上所述,我们用原核表达系统获取并纯化得到GST-14-3-3σ融合蛋白,用GST pull-down 技术检测了目的蛋白的生物学活性,为后续深入研究14-3-3σ蛋白在调控细胞周期运行、蛋白质相互作用、细胞凋亡及肿瘤生长扩散通路中的作用奠定了实验学基础。
[1]Yaffe M B.How do 14-3-3 proteins work?--Gatekeeper phosphorylation and the molecular anvil hypothesis[J].FEBS Lett,2002,513(1):53-57.
[2]Takahashi Y.The 14-3-3 proteins:gene,gene expression,and function[J].Neurochem Res,2003,28(8):1265-1273.
[3]Wilker E,Yaffe M B.14-3-3 Proteins--a focus on cancer and human disease[J].J Mol Cell Cardiol,2004,37(3):633-642.
[4]Urschel S,Bassermann F,Bai R Y,et al.Phosphorylation of grb10 regulates its interaction with 14-3-3[J].J Biol Chem,2005,280(17):16987-16993.
[5]Hermeking H,Benzinger A.14-3-3 proteins in cell cycle regulation[J].Semin Cancer Biol,2006,16(3):183-192.
[6]Freeman A K,Morrison D K.14-3-3 proteins:diverse functions in cell proliferation and cancer progression[J].SeminCell Dev Biol,2011,22(7):681-687.
[7]邹向阳,李连宏.细胞周期调控与肿瘤[J].国际遗传学杂志,2006,29(1):70-73.
[8]徐小洁,范忠义,王凌雪,等.人组蛋白H1 基因的原核表达、纯化及活性检测[J].细胞与分子免疫学杂志,2011,27(8):843-845.
[9]Wang H,Zhang L,Liddingtion R,et al.Mutations in the hydrophobic surface of an amphipathic groove of 14-3-3zeta disrupt its interaction with Ra-f 1 kinase[J].J Biol Chem,1998,273(26):16297-16304.
[10]潘伟男,陈锋,封芬,等.14-3-3蛋白的研究进展[J].国际病理科学与临床杂志,2007,27(3):262-265.
[11]Yaffe M B,Rittinger K,Volinia S,et al.The structural basis for14-3-3:phosphopeptide binding specificity[J].Cell,1997,91(7):961-971.
[12]Datta S R,Katsov A,Hu L,et al.14-3-3 proteins and survival kinases cooperate to inactivate BAD by BH3 domain phosphorylation[J].Mol Cell,2000,6(1):41-51.
[13]Thorson J A,Yu L W,Hsu A L,et al.14-3-3 proteins are required for maintenance of Raf-1 phosphorylation and kinase activity[J].Mol Cell Biol,1998,18(9):5229-5238.
[14]Liu Y,Yin G,Surapisitchat J,et al.Laminar flow inhibits TNF-induced ASK1 activation by preventing dissociation of ASK1 from its inhibitor 14-3-3[J].J Clin Invest,2001,107(7):917-923.
[15]Chan T A,Hermeking H,Lengauer C,et al.14-3-3Sigma is required to prevent mitotic catastrophe after DNA damage[J].Nature,1999,401(6753):616-620.
[16]Tzivion G,Avruch J.14-3-3 proteins:active cofactors in cellular regulation by serine/threonine phosphorylation[J].J Biol Chem,2002,277(5):3061-3064.
[17]Hermeking H.The 14-3-3 cancer connection[J].Nat Rev Cancer,2003,3(12):931-943.
[18]Fu H,Subramanian R R,Masters S C.14-3-3 proteins:structure,function,and regulation[J].Annu Rev Pharmacol Toxicol,2000,40(1):617-647.
[19]杨惠玲,夏洪平,赵睿颖,等.14-3-3σ调控p27 抑制Rat1-Akt细胞增殖[J].中国病理生理杂志,2007,23(10):2035-2038.
[20]Hsu S Y,Kaipia A,Zhu L,et al.Interference of BAD(BclxL/Bcl-2-associated death promoter)-induced apoptosis in mammalian cells by 14-3-3 isoforms and P11[J].Mol Endocrinol,1997,11(12):1858-1867.

