金结合多肽及其在生物传感领域的应用
余涛,郭磊,应天翼,宋云扬,吴方晖
1.防化研究院,北京 102205;2.国民核生化灾害防护国家重点实验室,北京 102205;3.军事医学科学院 毒物药物研究所,北京 100850
金单质(即零价态的金)是一种非常重要的传感材料,因其良好的延展性、成膜性和生物相容性,常用于电化学、压电晶体微天平、表面等离子体共振(surface plasmon resonance,SPR)等传感器的基底,及基于金纳米粒子(gold nanoparticles,AuNP)的传感器件等[1]。生物功能分子与传感器金基底或金纳米粒子的偶联效果直接决定了生物传感体系的性能,物理吸附法和化学共价法是目前广泛使用的偶联方法,但这2 种方法都存在着生物活性分子无法实现定向有序排列、偶联步骤较为复杂、对实验条件要求较高等技术屏障。随着生物技术的迅猛发展,将肽作为一种生物自组装材料,引导生物功能分子进行金表面固定化的方法日益受到重视,这种方法具有易于定向自组装、易修饰、成膜方法简单、绿色等技术优势,因而,金结合多肽及以其为核心的表面固定化技术无疑是当前传感领域研究的热点之一。
1 主要的金结合多肽序列
现阶段,已有多条金结合多肽被用于实际传感体系中,这些多肽的获得来自2 条技术途径,一是通过生物展示技术筛选获得,另一条途径是利用半胱氨酸的巯基与金之间特殊的反应特性,人工设计含半胱氨酸的肽段获得。其中,前者的研究成果现阶段报道较多。
生物展示技术是一种新的基因工程技术,其筛选过程是将外源蛋白或肽以融合蛋白的形式展示表达在噬菌体或微生物的表面,再与配体分子进行亲合结合,达到筛选具有亲合能力的蛋白或多肽的目的。自1992年Brown等通过细胞展示技术筛选到可结合氧化铁的多肽以来[2],这种筛选技术得到长足发展,已获得用于结合不同无机/有机材料的多肽或蛋白分子[3-5],所结合的对象包括无机硅、金属、氧化物、半导体、碳酸盐、高聚物等不同性质的材料[2,6-8]。这些蛋白或多肽分子均表现出特异性强、亲和力高、易于修饰、生物相容性好、适用范围广泛、结合过程绿色及使用条件温和等技术优点,其应用范围已逐步拓展到生物传感、生物纳米材料(诊断和药物递送)、组织工程和生物治疗等诸多领域[4,7,9]。
最先报道的可以识别金的多肽是Brown 于1997年通过细胞展示技术筛选获得的,其在筛选过程中以带有双酶切位点的质粒为载体,在酶切位点之间设计引物并构建文库,将此带有文库的载体导入选择的宿主细胞后进行诱导培养,进入对数生长期后,在菌液中加入金单质,再结合离心的方法加以富集,收集结合在金表面的具有结合能力的细胞,再通过几轮重复筛选过程,最终从这些细胞中筛选到一组具有较高结合能力的多肽,再从中选择活性最强的一条多肽,此肽由14 个氨基酸残基组成,命名为GBP1,该序列对金、银、铂均有结合能力,但对金的结合能力远超过其他2种金属[10]。
迄今,通过展示技术已发现多条具有金结合能力的多肽,均具有特异性结合到金表面并自组装的能力。如Naik 等于2005 年筛选到一组对银具有良好结合能力的多肽,其中命名为A3的多肽同样具有很好的金结合能力[11];2008年,Sarikaya等也报道了2条序列AuBP1和AuBP2[12]。
需要强调的是,单条金结合多肽和串联后的多条金结合多肽在与金结合能力方面存在差异,而相关研究正在进行中,尚无定论,但并不妨碍金结合多肽在多个领域中的应用[13-21],这一点在生物传感领域尤为突出。随着技术的发展,通过展示技术也获得了具有金结合能力的蛋白[22],但相关应用工作刚起步[23]。相关金结合多肽序列见表1。
2 金结合多肽与金的亲和识别机理
金结合多肽与金的亲和识别机理的研究,对于金结合多肽的应用至关重要。体外筛选和人工设计2 条途径所获得的金结合多肽与金的亲和识别机理的研究过程不尽相同。
众所周知,半胱氨酸的巯基具有与金结合的能力,但值得注意的是,在上述这些经生物筛选方法所得到的,具有较好应用前景的序列中均未发现半胱氨酸残基的存在。实验表明,单纯地增加半胱氨酸的数量,并不能观察到明显的金结合能力提高[27],将半胱氨酸的位置经过特殊设计后,可以获得具有较好结合活性的的多肽。曾有国外学者设计了一段用于偶联2种蛋白的多肽[28],但后来发现其具有金定位结合能力,该序列仅由6 个氨基酸残基构成,中间2个残基为非半胱氨酸,Metallo 等证明这条多肽与其他蛋白融合表达后,可以将不同类型的蛋白偶联至不同粒径的金纳米表面[26]。
虽历经十余载,但体外筛选获得的金结合多肽与金单质间的识别机理仍未有定论,目前的机理研究工作大多遵循自金结合多肽与金结合的相关影响因素进行分析的模式。从序列组成来讲,目前报道的金结合多肽序列多数不含半胱氨酸,表明其与金间的特异性识别并非通过末端巯基与金间的作用来进行[29-30]。研究认为,物理构象(构象变化、大小和拓扑)和化学作用(静电、极性、氢键)在金结合多肽与金之间的结合过程中同时存在[31]。一方面,与特定的氨基酸残基相关,如碱性氨基酸、芳香族氨基酸等。Liu等证明,组氨酸的咪唑基团具有较好的金结合能力[32];Knecht 等指出,赖氨酸、谷氨酸、丝氨酸、苏氨酸和甲硫氨酸也具有金结合能力[3];Sarikaya 等分析筛选的多条序列后指出,半胱氨酸、色氨酸和酪氨酸在高结合能力的肽段中比例较高[12];Ohuchi 等利用质谱技术研究表明,金结合肽中部分序列在结合过程中始终与金保持紧密连接[33]。另一方面,多肽的高级结构在识别过程中发挥了更重要的作用。Sarikaya等认为,GBP1序列中存在的反式β折叠二级结构对结合能力贡献更高[34];Maranas 等研究表明,由于金结合多肽中的二级结构单元短,且彼此之间由柔性较大的氨基酸连接,因此,在溶液状态时,其构象具有高灵活性,当其在金表面结合时,易因构象变化推斥金表面的水分子[35];Sarikaya 等通过分析解离常数和结合能发现,成环后的AuBP2 由于构象变化,其与金结合的能力高于GBP1、线性的AuBP1和AuBP2 及环状的AuBP1[12]。对于多肽在金表面的结合过程,Carri 认为分为三步:首先,多肽扩散到金表面的水层;然后,多肽中的一个氨基酸残基穿透水层,在金表面上形成一个锚定位点;最后,则是形成特定的结构或构象与金结合[36]。此外,金结合多肽序列重复次数的增加不一定有助于提高其与金的结合能力,如GBP1 序列在重复数为3 时结合能力最好,再增加数量结合能力反而下降[24,34,37-38],这与巯基-金的识别类似[30]。
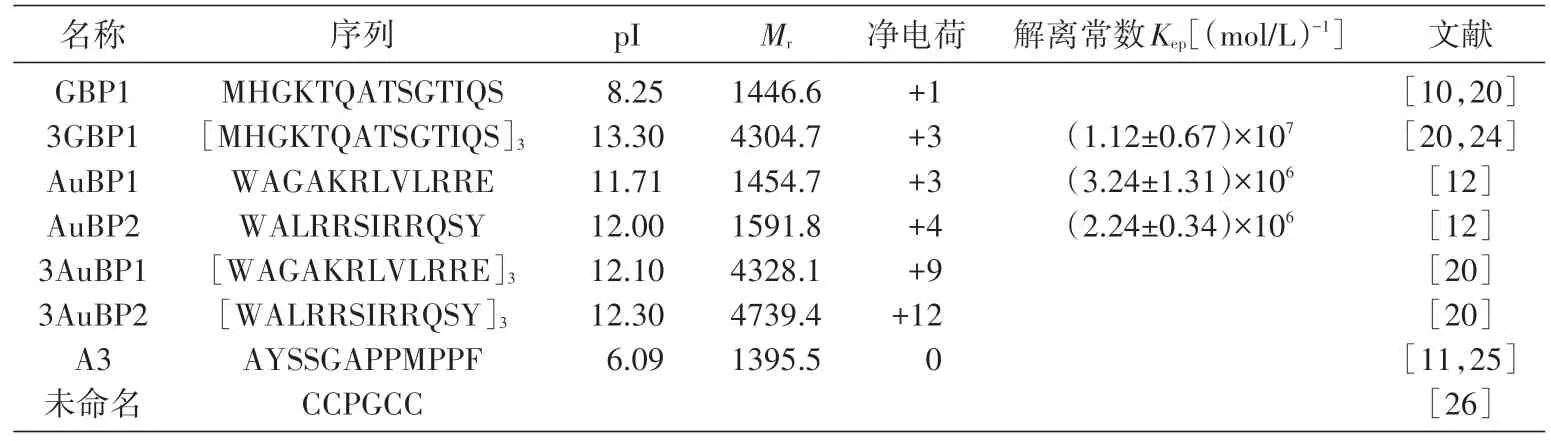
表1 金结合多肽的序列及主要性质
对人工设计的多肽,因在设计之初就已有一定规矩,且肽段较短,组成相对单一,其与金亲和过程较为清楚。如对CCPGCC这条序列来说,所包含的4个半胱氨酸残基在空间上形成了一个反式β折叠的桶状结构,4 个巯基均暴露在桶外侧,因而具有良好的金结合特性[26,39]。
3 金结合多肽在生物传感中的应用
自1998年以来,Furlong、Tamerler、Lee和Metallo等先后开展了金结合多肽亲和力、结合特异性、稳定性、融合蛋白表达,以及用于蛋白、DNA 检测等方面的基础工作,显示了金结合多肽在生物传感中具有广泛的应用前景[26,40-42]。从目前的报道来分析,这类多肽的应用集中在两方面:其一是用于在传感器的金基底表面制备传感器敏感膜,其成膜方法可以分为化学偶联成膜法和基于基因工程的融合蛋白成膜法两种;其二则为引导制备金纳米粒子。
3.1 基于金结合多肽的化学偶联成膜法
化学偶联成膜法研究较早,其成膜原理是,利用金结合多肽与金的特异性亲合特性,先将多肽分子自组装在传感器表面,再将抗体、酶等生物识别分子共价偶联到多肽分子上。与基底上直接共价偶联生物识别分子相比,经由金结合多肽的表面改性方法更为简单有效,在提高金表面生物相容性的同时,有利于偶联效率和检测灵敏度的提高。多经1-乙基-3-[3-二甲基氨基丙基]碳化二亚胺盐酸化物(1-ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride,EDC)/N-羟基硫代琥珀酰亚胺(N-hydroxysulfosuccinimide,sulfo-NHS)偶联步骤。Furlong 等利用该法制备了SPR 传感器的敏感膜,检测了多种敏感物分子,如将B 型金黄色葡萄球菌肠毒素(Staphylococcus aureusenterotoxin B,SEB)的抗体固定于GBP1 基底层上,对SEB 的检测限(limit of detection,LOD)达到fmol/L 级(约10μg/mL)[43];同样,以固定抗体到GBP1 层的方法,将SPR 传感器安置于飞机表面,对空气中呈气溶胶态的卵清蛋白和辣根过氧化物酶实现了灵敏检测[44];这种免疫检测策略亦可应用于蟹肉样品中小分子藻类毒素软藻酸(domoic acid)的检测,其LOD 达到3 ppb(约3 ng/mL)[45]。Itamo 等先通过EDC 反应将对抗体非识别区Fc 片段有特异结合能力的蛋白A 固定于金结合多肽的基底膜上,再利用蛋白A 来结合抗体,上述方法虽然增加了反应步骤,但可以有效降低对抗体活性的影响,对二噁英的LOD可达20 ng/mL[46]。
3.2 基于基因工程的融合蛋白成膜法
融合蛋白成膜法,指在成膜前,先通过基因工程技术,将金结合多肽和生物识别蛋白(酶、抗体及其他蛋白)融合表达,制备兼具金表面结合能力和目标分子识别能力的双功能蛋白,成膜过程仅须将这种双功能蛋白配于溶液中,滴加于金表面,静置几十分钟即可。此种成膜方法与传统的物理吸附和化学共价偶联法,以及间接成膜法相比,具有三方面的技术优势[23,26,40,47-49]:①通过金结合多肽的结合过程,实现了生物识别分子在传感器基质表面的定向、有序排列,克服了传统成膜方法所造成的部分识别位点被遮蔽,无法参与识别反应的缺点;②反应条件简单、温和、快速、步骤少,成膜过程不影响生物分子的生物活性,避免了偶联反应对识别分子生物功能的破坏;③制备所得膜的稳定性优于传统方法。由于上述优点,使得基于这种新方法制备的传感器敏感膜可以保护生物识别分子活性,其检测灵敏度较之以往方法有显著提高[23,26,40,42,49,50]。Metallo 等利用基因工程技术表达了带有CCPGCC 序列的绿色荧光蛋白和不带此序列的对照绿色荧光蛋白,偶联结果表明,带有金结合多肽的样品组对金纳米粒子表面的包覆率比对照组高出2 倍[26];Park 等表达了钙调蛋白与GBP1连接的融合蛋白,将此蛋白分别通过共价偶联法固定在玻璃表面和金识别法固定在金表面,结果表明后者的生物活性较前者高出近1 倍[50];Ko 等将GBP1 序列与一种传染病的膜表面识别肽段融合表达后,通过GBP1 的识别作用与传感器的金基底结合,加入抗体所形成的响应信号比直接将表面识别肽段共价偶联到金基底增加了1 倍[49];在另一报道中,将GBP1 序列与蛋白A 融合表达,利用蛋白A 与抗体之间的特异识别将抗体固定在传感器基底膜上,其检测限比直接将抗体固定在基底膜上高了10倍[51]。目前,利用基因工程技术表达含有金结合多肽的融合蛋白,再行制备传感器敏感膜的方式已得到广泛应用,从含有金结合多肽的融合蛋白构成来区分,可以分为2类。
其一,融合表达可适应免疫识别反应的通用型金结合多肽融合蛋白。由于蛋白A 具有特异识别抗体Fc 片段的功能,因此,将金结合多肽与蛋白A 的抗体识别亚基融合表达,即可结合各种抗体,从而设计发展出针对各种不同对象的通用型免疫传感平台。如Ko 等融合表达了GBP1-蛋白A 亚基,并利用此蛋白修饰了金纳米粒子的SPR 传感器表面,成膜后结合上特异性识别沙门菌的抗体,用于鼠伤寒沙门菌的检测,LOD可达104细胞/mL[51];Hong等在电极上修饰碳纳米管-金纳米粒子的复合材料,再利用GBP1-蛋白A 亚基结合识别C 反应蛋白的抗体,制得的电化学传感器对C 反应蛋白的LOD 达到了100 ng/mL[52];Lechuga 等在融合蛋白的克隆策略上进行了改进,设计了2 个连续的蛋白A 识别亚基,兼顾反应活性和空间位阻,克服了传统传感器基质表面蛋白A 的4 个亚基的空间位阻较大的缺点,利用此种融合蛋白构建的SPR 传感器对人生长激素的LOD达到了90 ng/mL[47]。
其二,针对靶分子特性,特异性地表达含有金结合多肽的融合蛋白。Kang 等将禽流感特征表面抗原肽段(CRDNWKGSNRPI)与GBP1 片段融合表达,用于制备传感器敏感膜,对目标物的LOD 可分别达到1 pg/mL和10 fg/mL[53-54];Park 等将可以识别乙肝表面抗原的单链抗体、乙肝表面抗原的特征序列分别与GBP1 融合表达,利用这2 种蛋白构建了可以同时分析样品中乙肝表面抗原和抗体的传感体系,LOD 均可达到ng/mL 量级,可用于乙肝的早期发现和确诊[55]。SCVme 片段是严重急性呼吸综合征(severe acute respiratory syndrome,SARS)病毒感染机体后,所表达的一种特征蛋白的膜外区,Park和Lee等构建了一个同时编码SCVme 膜外区序列、绿色荧光蛋白和GBP1序列的质粒,将表达后的融合蛋白分别用于研制检测体内相应抗体的SPR传感器和微流控生物芯片,有望用于对SARS 患者的筛查[49,56]。相似的工作还包括:Park 等将一段钙调蛋白的底物多肽序列与连接蛋白和GBP1融合表达,组装在生物芯片上,用于监测钙调蛋白的生物活性[48,50];Gralnick等直接将GBP1 序列与来自大肠杆菌的膜蛋白Lam 融合后转入斯瓦尼菌中,通过展示技术表达在斯瓦尼菌的细胞膜上,使得细胞可以直接固定在电极表面,用于检测这种细菌的电化学生物特性[57];Lee 等在大肠杆菌细胞表面,通过展示技术同时表达了GBP1序列与亲合素蛋白,通过GBP1序列使细胞结合在生物芯片表面,再利用亲合素与生物素化的其他分子结合,用于制备全细胞生物传感器[58]。
对含有金结合多肽序列的融合蛋白而言,多肽功能区保持对金表面的定向自组装能力,且对生物识别蛋白的功能不产生干扰,是其直接制备敏感膜的关键。分析已有的研究报道不难得出,不同的金结合多肽(GBP1和GGPGCC 序列)与多种不同蛋白融合表达后,均保持了金结合活性,其传感效果均优于化学修饰法[26,40,49-50],表明此类多肽在表达过程中未参与蛋白质的折叠过程,有较好的结构独立性;从另一方面分析,在不同的融合蛋白中,尽管功能蛋白来自不同种属,如病毒[40,55]、细菌[40,51,57]、动物[26,40,42],分子大小差异明显,但表达后其识别目标分子活性均未受到影响,这意味着金结合多肽在表达过程中,同样不会影响其他蛋白的正确折叠。由此可以判断,目前报道的这些多肽适合于基因工程表达。
从具体蛋白克隆策略来分析,无论是将金结合多肽序列设计在融合表达蛋白的N 端[13,40,48-50,52-56]还是C端[26,47,51,57-58],融合蛋白的2种功能均可有效实现,因此推测金结合多肽对于N 端或C 端可能不具备明显选择性。在融合蛋白表达中,为了纯化方便,通常要设计一些用于亲合纯化的蛋白或多肽标签,Park等以可被钙调蛋白识别的多肽与钙调蛋白之间的磷酸化反应活性为标准,分别考察了与GBP1序列融合表达时,谷胱甘肽S 转移酶、麦芽糖结合蛋白和精脒合酶等3 种常用的蛋白类亲合纯化标签对应蛋白的活性,结果表明GST 标签的活性较好[50]。更广泛的是以多聚组氨酸(poly-His)作为多肽纯化标签,此类标签分子小,一般不涉及三级结构,在纯化中应用较广[42,48-49,51-56];类似的多肽纯化标签还有LYTAG 系统[47]。尽管许多研究工作指出,金结合多肽的适当多次重复有助于提高与金的结合能力,但在融合表达中对该问题没有定论,Kang[53]、Park[48,50,56]、Hong和Park[52]、Park和Lee[42,54,55,58]、Ko 等[51]在融合表达中没有选择GBP1 重复表达;Lechuga[47]、Ko[49]等将GBP1 的重复数设置为3;Gralnick 选择的重复数为5[57];Ibii等比较了分别选择GBP1、3GBP1和7GBP1与蛋白融合后所形成敏感膜的解离常数,结果表明GBP1序列的重复数量设计为7 时效果更好[23];而Tameler 等将GBP1 与碱性磷酸酶融合表达时发现,重复数为5 时的效果比7和9好[40]。
3.3 金结合多肽制备具有响应能力的金纳米粒子
金纳米粒子是近年来深受重视的一种纳米材料,在传感领域已得到广泛应用。金结合多肽与金纳米粒子可以成为完美搭档,主要表现在利用金结合多肽引导制备金纳米粒子,同时赋予其识别功能方面。Naik 等合成了一段多肽,其C 端序列为可以识别金的A3 序列,N 端序列为可以识别金属离子的标签序列,将此肽与氯金酸混合后,A3 直接诱导氯金酸生成金纳米粒子,并包被在金纳米粒子的表面,标签序列参与识别金属离子,该传感体系对Co2+、Hg2+、Pb2+、Pd2+和Pt2+均有良好的响应[59]。另一代表性范例为,Metallo 等利用基因工程技术,将CCPGCC序列分别与绿色荧光蛋白、泛素蛋白融合表达,再与已合成的不同粒径的金纳米粒子反应,结果表明这些蛋白都可以结合在金纳米粒子的表面,用于进一步的传感,当然,不同蛋白与金纳米粒子结合的能力与后者的粒径直接相关[26]。
4 结语
金结合多肽自身的特性决定了其在传感领域中有较好的应用前景和发展空间。目前,基于该原理发展起来的生物传感器敏感膜制备方法已经体现出明显的技术优势。当然,我们应该看到这方面研究及应用刚刚起步,仍有诸多有待深入探讨的空间,如新的金结合多肽肽段的筛选、不同基因工程表达体系(如真核表达体系、昆虫表达体系及动物表达体系等)的应用、具有复杂功能及复杂结构(如糖修饰、多亚基蛋白、膜蛋白)的融合蛋白的获得等。现阶段,金结合多肽的研究更多地集中于敏感膜的制备,而将这种多肽与金纳米粒子为代表的新型纳米材料相结合,直接构建高灵敏度、高选择性传感响应体系的研究工作,必将是另一重要发展方向。
[1]Aust S D.Mechanisms of degradation by white rot fungi[J].Environ Health Persp,1995,103:59-61.
[2]Brown S.Engineered iron oxide-adhesion mutants of the Escherichia coli phage lambda receptor[J].Proc Natl Acad Sci USA,1992,89:8651-8655.
[3]Sethi M,Pacardo D B,Knecht M R.Biological surface effects of metallic nanomaterials for applications in assembly and catalysis[J].Langmuir,2010,26:15121-15134.
[4]Chen C L,Rosi N L.Peptide-based methods for the preparation of nanostructured inorganic materials[J].Angew Chem Int Ed,2010,49:1924-1942.
[5]Fu G,Chen W,Yue X,et al.Highly sensitive colorimetric detection of organophosphate pesticides using copper catalyzed click chemistry[J].Talanta,2013,103:110-115.
[6]Tamerler C,Dincer S,Heidel D,et al.Biomimetic multifunctional molecular coatings using engineered proteins[J].Pro Org Coat,2003,47:267-274.
[7]Tamerler C,Kacar T,Sahin D,et al.Genetically engineered polypeptides for inorganics:a utility in biological materials science and engineering[J].Mat Sci Eng C,2007,27:558-564.
[8]Date T,Sekine J,Matsuno H,et al.Polymer-binding peptides for the noncovalent modification of polymer surfaces:effects of peptide density on the subsequent immobilization of functional proteins[J].ACS Appl Mater Inter,2011,3:351-359.
[9]Tamerler C,Sarikaya M.Molecular biomimetics:utilizing nature's molecular ways in practical engineering[J].Acta Biomater,2007,3:289-299.
[10]Brown S.Metal-recognition by repeating polypeptides[J].Nat Biotechnol,1997,15:269-272.
[11]Slocik J M,Stone M O,Naik R R.Synthesis of gold nanoparticles using multifunctional peptides[J].Small,2005,1:1048-1052.
[12]Hnilova M,Oren E E,Seker U O,et al.Effect of molecular conformations on the adsorption behavior of gold-binding peptides[J].Langmuir,2008,24:12440-12445.
[13]Jahns A C,Haverkamp R G,Rehm B H.Multifunctional inorganic-binding beads self-assembled inside engineered bacteria[J].Bioconjug Chem,2008,19:2072-2080.
[14]Carter J D,LaBean T H.Organization of inorganic nanomaterials via programmable DNA self-assembly and peptide molecular recognition[J].ACS Nano,2011,5:2200-2205.
[15]Leong K,Chen Y,Masiello D J,et al.Cooperative near-field surface plasmon enhanced quantum dot nanoarrays[J].Adv Func Mater,2010,20:2675-2682.
[16]Leong K,Zin M T,Ma H,et al.Surface plasmon enhanced fluorescence of cationic conjugated polymer on periodic nanoarrays[J].ACS Appl Mater Inter,2010,2:3153-3159.
[17]Chen C L,Zhang P,Rosi N L.A new peptide-based method for the design and synthesis of nanoparticle superstructures:construction of highly ordered gold nanoparticle double helices[J].J Am Chem Soc,2008,130:13555-13557.
[18]Min P W,Gill C B,Suk H Y,et al.Facile functionalization of colloidal gold nanorods by the specific binding of an engineered protein that is preferred over CTAB bilayers[J].Chem Plus Chem,2013,78:48-51.
[19]Song C,Zhao G,Zhang P,et al.Expeditious synthesis and assembly of sub-100 nm hollow spherical gold nanoparticle superstructures[J].J Am Chem Soc,2010,132:14033-14035.
[20]Khatayevich D,Gungormus M,Yazici H,et al.Biofunctionalization of materials for implants using engineered peptides[J].Acta Biomater,2010,6:4634-4641.
[21]Xie J,Lee J Y,Wang D I C.Seedless,surfactantless,highyield synthesis of branched gold nanocrystals in HEPES buffer solution[J].Chem Mat,2007,19:2823-2830.
[22]Watanabe H,Nakanishi T,Umetsu M,et al.Human antigold antibodies:biofunctionalization of gold nanoparticles and surfaces with anti-gold antibodies[J].J Biol Chem,2008,283:36031-36038.
[23]Ibii T,Kaieda M,Hatakeyama S,et al.Direct immobilization of gold-binding antibody fragments for immunosensor applications[J].Anal Chem,2010,82:4229-4235.
[24]Tamerler C,Duman M,Oren E E,et al.Materials specificity and directed assembly of a gold-binding peptide[J].Small,2006,2:1372-1378.
[25]Naik R R,Stringer S J,Agarwal G,et al.Biomimetic synthesis and patterning of silver nanoparticles[J].Nat Mater,2002,1:169-172.
[26]Reed A M,Metallo S J.Oriented protein adsorption to gold nanoparticles through a genetically encodable binding motif[J].Langmuir,2010,26:18945-18950.
[27]Lee J M,Park H K,Jung Y,et al.Direct immobilization of protein g variants with various numbers of cysteine residues on a gold surface[J].Anal Chem,2007,79:2680-2687.
[28]Adams S R,Campbell R E,Gross L A,et al.New biarsenical ligands and tetracysteine motifs for protein labeling in vitro and in vivo:synthesis and biological applications[J].J Am Chem Soc,2002,124:6063-6076.
[29]Andreescu S,Luck L A.Studies of the binding and signaling of surface-immobilized periplasmic glucose receptors on gold nanoparticles:a glucose biosensor application[J].Anal Biochem,2008,375:282-290.
[30]Lee J M,Park H K,Jung Y,et al..Direct immobilization of protein g variants with various numbers of cysteine residues on a gold surface[J].Ana Chem,2007,79:2680-2687.
[31]Tamerler C,Sarikaya M.Genetically designed peptide-based molecular materials[J].ACS Nano,2009,3:1606-1615.
[32]Xu Z,Yuan S L,Yan H,et al.Adsorption of histidine and histidine-containing peptides on Au[111]:a molecular dynamics study[J].Colloids Surf A,2011,380:135-142.
[33]Suzuki N,Gamble L,Tamerler C,et al.Adsorption of genetically engineered proteins studied by time-of-flight secondary ion mass spectrometry.Part A:data acquisition and principal component analysis[J].Surf Interface Anal,2007,39:419-426.
[34]Tamerler C,Oren E E,Duman M,et al.Adsorption kinetics of an engineered gold binding Peptide by surface plasmon resonance spectroscopy and a quartz crystal microbalance[J].Langmui,2006,22:7712-7718.
[35]Verde A V,Acres J M,Maranas J K.Investigating the specificity of peptide adsorption on gold using molecular dynamics simulations[J].Biomacromolecules,2009,10:2118-2128.
[36]Yu J,Becker M L,Carri G A.The influence of amino acid sequence and functionality on the binding process of peptides onto gold surfaces[J].Langmuir,2012,28:1408-1417.
[37]Seker U O,Wilson B,Sahin D,et al.Quantitative affinity of genetically engineered repeating polypeptides to inorganic surfaces[J].Biomacromolecules,2009,10:250-257.
[38]Zourob M,Simonian A,Wild J,et al.Optical leaky waveguide biosensors for the detection of organophosphorus pesticides[J].Analyst,2007,132:114-120.
[39]Madani F,Lind J,Damberg P,et al.Hairpin structure of a biarsenical-tetracysteine motif determined by NMR spectroscopy[J].J Am Chem Soc,2009,131:4613-4615.
[40]Kacar T,Zin M T,So C,et al.Directed self-immobilization of alkaline phosphatase on micro-patterned substrates via genetically fused metal-binding peptide[J].Biotechnol Bioeng,2009,103:696-705.
[41]Woodbury R G,Wendin C,Clendenning J,et al.Construction of biosensors using a gold-binding polypeptide and a miniature integrated surface plasmon resonance sensor[J].Biosens Bioelectron,1998,13:1117-1126.
[42]Park T J,Lee S Y,Lee S J,et al.Protein nanopatterns and biosensors using gold binding polypeptide as a fusion partner[J].Anal Chem,2006,78:7197-7205.
[43]Naimushin A N,Soelberg S D,Nguye D K,et al.Detection of Staphylococcus aureus enterotoxin B at femtomolar levels with a miniature integrated two-channel surface plasmon resonance sensor[J].Biosens Bioelectron,2002,17:573-584.
[44]Naimushin A N,Spinelli C B,Soelberg S D,et al.Airborne analyte detection with an aircraft-adapted surface plasmon resonance sensor system[J].Sens Actuators A,2005,104:237-248.
[45]Stevens R C,Soelberg S D,Eberhart B L,et al.Detection of the toxin domoic acid from clam extracts using a portable sur-face plasmon resonance biosensor[J].Harmful Algae,2007,6:166-174.
[46]Soh N,Tokuda T,Watanabe T,et al.A surface plasmon resonance immunosensor for detecting a dioxin precursor using a gold binding polypeptide[J].Talanta,2003,60:733-745.
[47]de Juan-Franco E,Caruz A,Pedrajas J R,et al.Site-directed antibody immobilization using a protein A-gold binding domain fusion protein for enhanced SPR immunosensing[J].Analyst,2013,138:2023-2031.
[48]Ko Kyong-Cheol,Choi Mi Hee,Rho Jong Kook,et al.A facile method for detecting calcium/calmodulin-dependentprotein kinase using radio phosphorylation of a GBP-fused enzyme substrate in a lab-on-a-chip[J].Sens Actuators A,2013,178:434-442.
[49]Park T J,Hyun M S,Lee H J,et al.A self-assembled fusion protein-based surface plasmon resonance biosensor for rapid diagnosis of severe acute respiratory syndrome[J].Talanta,2009,79:295-301.
[50]Rho J K,Kang J A,Choi M H,et al.Enhanced kinase sensing by radio-phosphorylation and oriented immobilization of a GBP-linked kinase substrate on a gold surface[J].Sens Actuators,A,2011,160:632-636.
[51]Ko S,Park T J,Kim H S,et al.Directed self-assembly of gold binding polypeptide-protein A fusion proteins for development of gold nanoparticle-based SPR immunosensors[J].Biosens Bioelectron,2009,24:2592-2597.
[52]Park H,Park T J,Huh,Y S,et al.Immobilization of genetically engineered fusion proteins on gold-decorated carbon nanotube hybrid films for the fabrication of biosensor platforms[J].J Colloid Interface Sci,2010,350:453-458.
[53]Choi K M,Lee S J,Choi J H,et al.Facile fabrication of networked patterns and their superior application to realize the virus immobilized networked pattern circuit[J].Chem Commun,2010,46:8609-8611.
[54]Park T J,Lee S J,Kim D K,et al.Development of labelfree optical diagnosis for sensitive detection of influenza virus with genetically engineered fusion protein[J].Talanta,2012,89:246-252.
[55]Zheng S,Kim D K,Park T J,et al.Label-free optical diagnosis of hepatitis B virus with genetically engineered fusion proteins[J].Talanta,2010,82:803-809.
[56]Huh Y S,Park T J,Lee E Z,et al.Development of a fully integrated microfluidic system for sensing infectious viral disease[J].Electrophoresis,2008,29:2960-2969.
[57]Kane A L,Bond D R,Gralnick J A.Electrochemical analysis of Shewanella oneidensis engineered to bind gold electrodes[J].ACS Synth Biol,2013,2:93-101.
[58]Park T J,Zheng S,Kang Y J,et al.Development of a wholecell biosensor by cell surface display of a gold-binding polypeptide on the gold surface[J].FEMS Microbiol Lett,2009,293:141-147.
[59]Slocik J M,Zabinski J S,Phillips D M Jr,et al.Colorimetric response of peptide-functionalized gold nanoparticles to metal ions[J].Small,2008,4:548-551.

