人乳头瘤病毒11 型L2NE7E6 融合蛋白的原核表达及其诱发的T细胞免疫反应
任皎,赵莉,张卉,郝明强,周玲,田厚文,谭文杰,阮力
中国疾病预防控制中心 病毒病预防控制所,北京 102206
人乳头瘤病毒(human papillomavirs,HPV)6 型和11 型在该家族中属于低危型(low risk,LR),90%的肛门-生殖器疣(ano-genital warts,GW),即熟知的尖锐湿疣(condyloma acuminatum,CA)由这2型引起[1-2],欧洲每年都有1.5%~2.5%的患者,美国每年有100~300 万新发病例。我国改革开放以来GW 发病率逐年上升,现仅次于淋病位居性传播疾病的第二位。虽然Merk 公司的6/11/16/18VLP 四价疫苗能很好地预防HPV6、HPV11 的感染,但并不清楚已存在的感染和病变,此外由于价格和宗教问题等原因,在一定时间内该疫苗较难在发展中国家推广使用。这意味着在相当长的一段时间内仍旧会存在尖锐湿疣病人。目前尖锐湿疣的传统治疗没有从根本上解决复发问题[3],因为患者细胞免疫反应受到不同程度的抑制,而细胞免疫恰恰在疣体清除中起重要作用[4]。近几年的研究表明,HPV E6 蛋白在清除HPV 相关病变中起重要作用[5]。因此,我们在前期构建的尖锐湿疣治疗疫苗HPV11 L2E7融合蛋白的基础上[6],将E6 抗原加入,为了提高表达水平,我们将L2 蛋白N端具有中和活性的120 个氨基酸残基保留,其余删除。新的融合蛋白L2NE7E6 在原核系统中得到表达,在小鼠体内观察了其诱发的T 细胞免疫反应,并对E6、E7 的T 细胞表位进行筛选,确定优势表位。本研究可为HPV11 型尖锐湿疣治疗性疫苗的筛选评价提供实验依据及候选疫苗株。
1 材料和方法
1.1 材料
C57BL/6(H-2b)小鼠,6~8周龄,雌性,购自中国医学科学院实验动物繁育中心,在中国医学科学院药物研究所SPF2 级动物房饲养;大肠杆菌BL21(DE3+)和DH5α菌株由本室保存;pMD18-T 载体购自TaKaRa 公 司;pET9a 载体购自Invitrogen 公司;pETHPV11L2E7E6 由本室构建保存;限制性内切酶和T4DNA 连接酶购自Biolab公司;DNA 提取试剂盒购自北京天根公司;小鼠IFN-γ ELISPOT 试剂盒购自BD公司;HPV16 L2多抗由本室制备;CpG-ODN[7](5'TCCATGACGTTCCTGACGT T3')和小鼠CpG 寡脱氧核苷酸由上海生工公司合成;CM Sepharosetm FastFlow介质购自Amersham Pharmacia公司。
HPV11 E7、E6多肽设计按照氨基酸序列,每15个氨基酸残基为一条肽段,相邻肽段重叠11 个氨基酸残基。其中E6共35条肽,只合成单号肽段;E7共22条肽段,全部合成,但第15、16、20、21号肽段未能合成。由北京中科亚光生物技术有限公司合成。
1.2 L2NE7E6融合基因的构建
为将HPV11 L2E7E6 融合基因中的L2 基因C端缺失,仅保留N 段360 bp(编码120 个氨基酸),以含HPV11 L2E7E6 融合基因的质粒pET9aHPV11L2E7E6 为模板,用引物P1/P2和P3/P4 分别扩增L2N120(~360 bp)和E7E6(~747 bp)目的基因片段(扩增条件:94℃3 min 预变性,然后以94℃30 s、56℃30 s、72℃50 s 行30 个循环,最后72℃10 min)。PCR 扩增片段L2N120和E7E6 经凝胶回收,将2片段混合作为模板,以P1/P4为引物进行PCR扩增(扩增条件:94℃4 min 预变性,然后以94℃50 s、65℃ 40 s、72℃ 1 min 行30 个循环,最后72℃10 min),扩增出目的片段L2NE7E6(~1107 bp)。将目的片段克隆到pMD18-T 载体,经限制性内切酶酶切鉴定正确后送擎科公司测序确认,命名为pMD18T-11L2NE7E6。引物序列见表1。
1.3 重组表达质粒pETHPV11L2NE7E6的构建
质粒pMD18T-11L2NE7E6 经NdeⅠ和BamHⅠ酶切消化后,用琼脂糖凝胶电泳回收L2NE7E6 基因片段,与经相同酶消化的pET9a载体连接,然后转化DH5α大肠杆菌,挑单斑扩增后提取质粒,酶切鉴定后筛选有正确插入的质粒测序,测序结果与设计一致,将该质粒命名为pETHPV11L2NE7E6。
1.4 HPV11 L2NE7E6融合蛋白的表达与鉴定
将重组表达质粒转化大肠杆菌BL21(DE3+),挑单斑在3 mL LB(含卡那霉素)培养基中于37℃培养至D600nm值达0.6~0.8,加入IPTG(终浓度0.8 mmol/L)诱导表达2 h,取适量培养液离心收集菌体,取约30μg细菌裂解蛋白进行SDS-PAGE,考马斯亮蓝染色后分析。将SDS-PAGE 胶上蛋白电转至硝酸纤维素膜,过夜封闭,以抗HPV16 L2 豚鼠多抗为第一抗体、辣根过氧化物酶标记的蛋白A/G 为第二抗体,进行目的蛋白表达的特异性鉴定。
1.5 HPV11 L2NE7E6融合蛋白的纯化
将表达鉴定正确的克隆株菌种按1/100 的比例接种于含卡那霉素(100μg/mL)的200 mL LB 培养基中,37℃振荡培养至D600nm值为0.8,加入IPTG 至终浓度为0.8 mmol/L,25℃诱导表达6 h,收集菌体沉淀,用裂解液(50 mmol/L Tris,200 mmol/L NaCl,10 mmol/L EDTA,0.5% Triton,pH8.0)悬起,经超声波裂解后离心收集包涵体,分别用Tris 缓冲液(50 mmol/L Tris,pH8.0)、1 mol/L和2 mol/L 尿素Tris 缓冲液各洗涤一次,再用8 mol/L 尿素(50 mmol/L Tris,pH8.3)悬起,超声波裂解后离心取上清,用Q 柱纯化目的蛋白,最后透析至Tris 缓冲液(50 mmol/L,pH8.3)中,分装存放于-20℃备用。

表1 PCR引物及序列
1.6 动物免疫方案
设对照组和实验组。对照组每只小鼠左后下肢肌注100μL 20 mmol/L Tris和10μg CpG 的混合液,实验组每只小鼠左后下肢肌注50μg L2NE7E6蛋白和10μg CpG 的混合液。免疫程序为第1 d初免,第14 d加强。
1.7 酶联免疫斑点检测(ELISPOT)
加强免疫后2 周,按照BD 公司小鼠IFN-γ ELISPOT 试剂盒说明书检测HPV11 E6、E7 肽库或单肽刺激小鼠脾细胞产生的分泌IFN-γ的效应T 细胞数,筛选E7、E6蛋白在C57BL/6小鼠的T细胞表位肽序列。
2 结果
2.1 HPV11 L2NE7E6融合基因的构建
以含有HPV11 E7E6 基因片段的质粒pETHPV11L2E7E6 为模板,分别扩增出HPV11 L2N和HPV11 E7E6 基因片段,再以重叠PCR 方法扩增出约1107 bp 的HPV11 L2NE7E6 融合基因,结果见图1。将目的片段插入pMD18-T 载体,经限制性内切酶酶切鉴定正确后送擎科公司测序,测序结果表明重组质粒pMD18T-11L2NE7E6 正确插入与设计相符的HPV11 L2NE7E6基因。
2.2 重组表达质粒pETHPV11L2NE7E6的构建
将pMD18T-HPV11L2NE7E6 用NdeⅠ、BamHⅠ酶切消化后回收1107 bp 的L2NE7E6 片段,插入pET9a 载体的相应酶切位点,经挑斑酶切鉴定及测序正确后,将重组质粒命名为pETHPV11L2NE7E6。
2.3 蛋白的表达、纯化和鉴定
将质粒pETHPV11L2NE7E6 转化大肠杆菌BL21(DE3+),挑取单斑培养并诱导表达,经SDSPAGE 胶分析,在相对分子质量约41×103处可见明显新增表达带(图2A),大小与理论值接近。将诱导表达菌体的SDS-PAGE 胶上蛋白转移至硝酸纤维素膜,Western 印迹结果表明该条带与HPV16 L2 多抗有特异性反应,说明新增表达带是目的基因表达蛋白(图2B)。
诱导表达菌体用裂解液裂解后,收集包涵体用Tris 缓冲液及尿素洗涤,最后用8 mol/L 尿素悬起超声波裂解,离心取上清上Q 柱,分别用pH8.3 的100 mmol/L NaCl 洗脱杂蛋白、300 mmol/L NaCl 洗脱目的蛋白,将含有目的蛋白的样品于4℃透析复性、浓缩,经10% SDS-PAGE 分析蛋白(图2C),扫描分析蛋白纯度约90%。
2.4 重组蛋白L2NE7E6 诱发的特异性T 细胞免疫反应
ELISPOT 检测HPV11 E7、E6 肽池刺激产生的分泌IFN-γ的效应T细胞数,结果如图3、4。从图3A可看出,对照组PBS和L2NE7E6 重组蛋白组产生针对E6 全合成肽库的特异性平均斑点数分别为3和630,说明重组蛋白L2NE7E6能诱发C57BL/6小鼠产生强的针对HPV11 E6 蛋白的特异性T 细胞免疫反应。HPV11 E6 肽池ELISPOT 筛选结果显示,E6 的11 号肽反应最强,位于E6 氨基酸序列的41~55 位,序列为AEIYAYAYKNLKVVW,这与文献[10]报道的HPV11 E6 T细胞表位44~51正好重叠;C2、R2肽池反应次之,根据图5A 的矩阵设计判断第13、15、17号肽可能为弱表位肽。图3B 表明,经单肽刺激可筛选出另外2 个E6 弱表位肽13 号和17 号,分别位于49~63和65~79 位,序列分别为KNLKVVWRDNFPF AA和ACCLELQGKINQYRH。
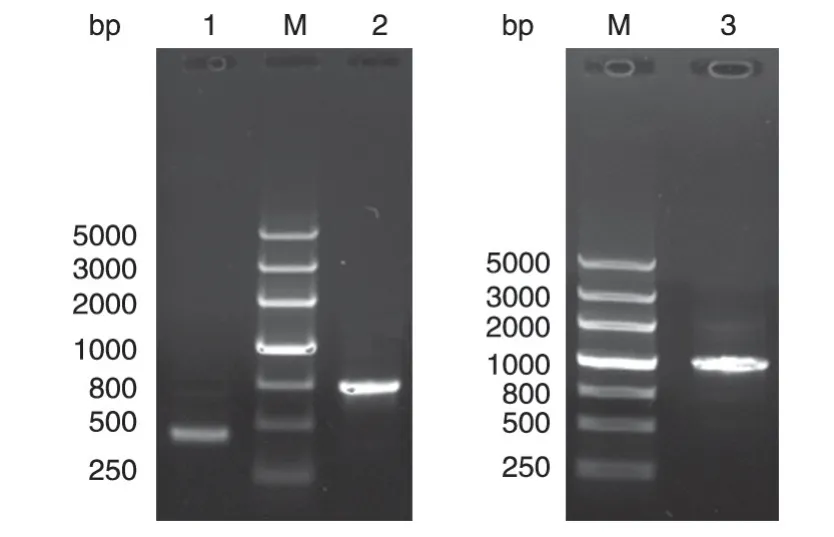
图1 HPV11 L2NE7E6融合基因的PCR扩增结果
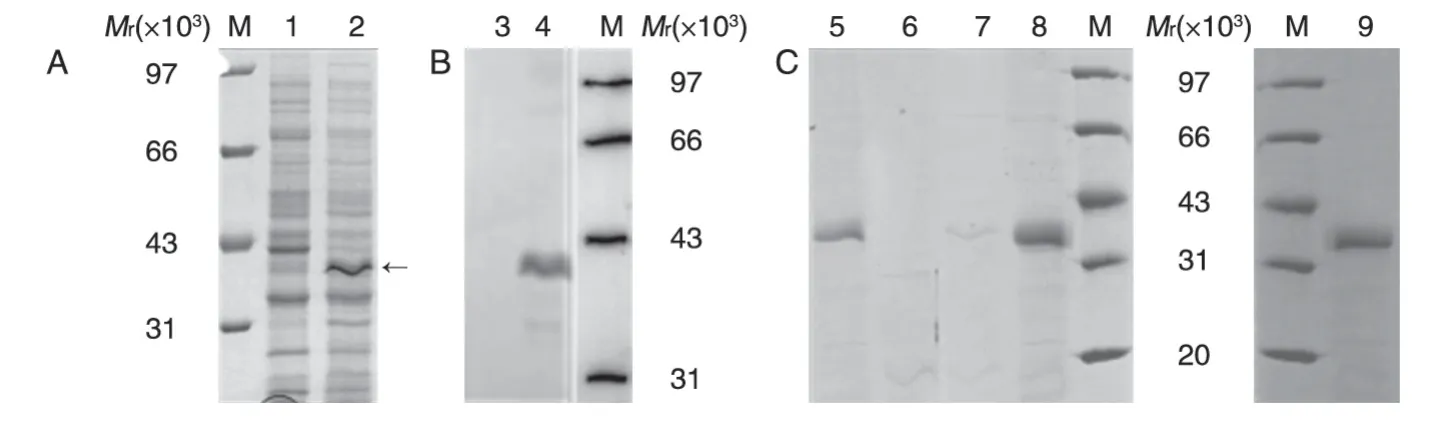
图2 HPV11 L2NE7E6蛋白的原核表达和纯化的SDS-PAGE(A,C)及Western印迹(B)
E7 肽池ELISPOT 检测结果如图4A,仅有R2和C4 肽池及19 号单肽有弱反应,结合图5B 的矩阵设计分析第11 号肽可能为活性肽段,图4B 也证明上述分析正确。因此筛选到2 条弱的E7 T 细胞表位肽,14 号肽位于53~67 残基,序列为QILTCCCGCDS NVRL,19 号肽位于73~87,序列为DGDIRQLQDLL LGTL。总之,图4 表明重组蛋白HPV11 L2NE7E6能诱发C57BL/6 小鼠产生较弱的针对HPV11 E7 蛋白的特异性T细胞免疫反应。
3 讨论
HPV6、HPV11 主要引起尖锐湿疣和复发性呼吸道乳头瘤病(recurrent respiratory papillomatosis,RRP)。目前GW 的临床治疗方法主要有药物、损毁性治疗、免疫调节剂等,治疗费用高、疗程长,复发率高。而RRP 的治疗也面临同样问题,患者需要多次接受疣体切除手术以保证呼吸道通畅。鉴于目前仍无有效的GW 根治方法,研究治疗性疫苗成为能解决复发从而根治GW/RRP 的希望。临床研究表明,尖锐湿疣患者细胞免疫功能低下,外周血CD4+/CD8+T 细胞比例下降,Th1/Th2 比值不平衡,而且疾病持续期愈长细胞免疫功能愈低下;反之,自然或医源性所致疣体消退时,则出现细胞免疫功能恢复或增强[8]。因此,成功的免疫治疗应该能打破机体的免疫耐受,并诱发强的细胞免疫反应。
在本研究中,我们在前期构建的HPV11L2E7 融合蛋白[6]中再融入E6 抗原,因为对健康者的HPV 感染流行性记忆免疫反应(prevalent memory immune response)调查检测显示,HPV 早期蛋白E6 诱发的免疫反应比E7 更常见且更强[4],因而加入E6 抗原后融合蛋白疫苗在临床试验中免疫反应可能会增强。此外,多个蛋白抗原的融合能包含更多的病毒细胞免疫反应抗原表位,从而能尽可能减少由于HLA 分子多态性带来的无应答反应。考虑到融合后形成的分子太大,会影响表达水平,我们将具有前导蛋白作用的L2 蛋白C 端缺失,只保留具有中和抗体表位的N端120 个氨基酸残基,以期获得新融合蛋白的高表达。但从本研究结果来看,融合蛋白的表达水平还待进一步提高。后期,我们将通过密码子优化或换用其他原核表达载体等途径来提高表达水平。
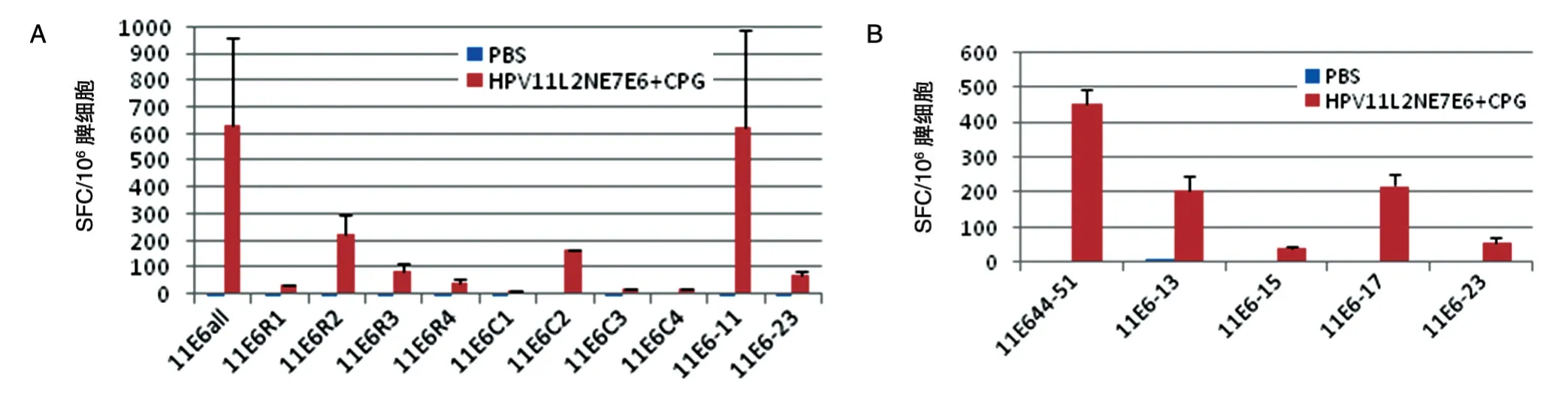
图3 HPV11 E6肽刺激产生的特异性细胞免疫反应ELISPOT结果(A)及HPV11 E6多肽表位筛选(B)
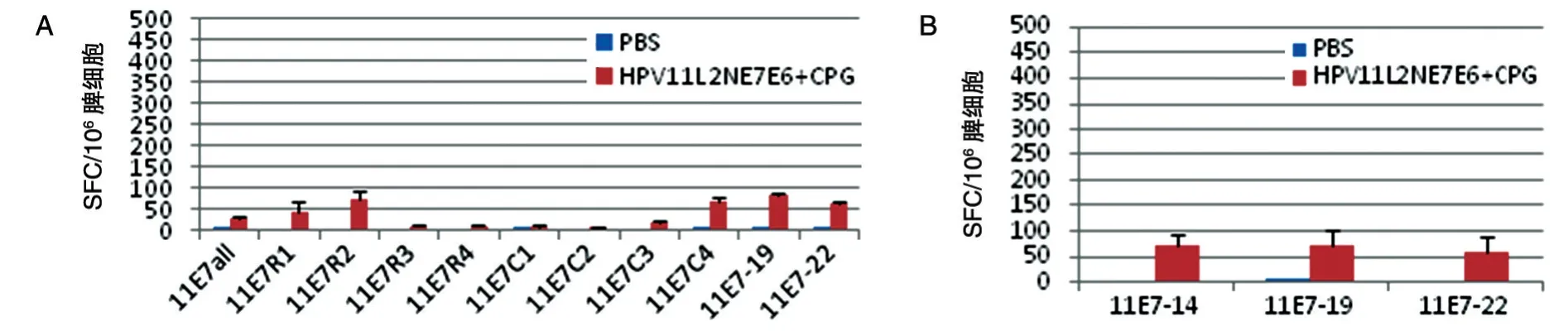
图4 HPV11 E7肽刺激产生的特异性细胞免疫反应ELISPOT结果(A)及HPV11 E7多肽表位筛选(B)

图5 HPV11 E6(A)、E7(B)肽池混合方案
HPV11 L2NE7E6融合蛋白免疫小鼠后,检测到针对E7、E6 的特异性T 细胞免疫反应。筛选到的E6 11 号肽表位E6aa41-55 与Peng[9]、Shin[10]发表的肽段位置一致。在Peng 的研究中未发现E7 活性表位肽,在Shin 的研究中却发现了1 条强的E7 肽段,序列为HCYEQLEDSSEDEVD。但在我们的研究中只发现了2 条反应较弱的E7 肽段,序列分别为KNLKVVWRDNFPFAA、ACCLELQGKINQYRH。这可能与疫苗种类不同有关,Peng和Shin 均为DNA 疫苗,而我们是重组蛋白疫苗,在抗原的递呈上DNA疫苗属内源性递呈,而蛋白疫苗是外源递呈,可能导致提呈出的表位不同。
由于至今没有公认的评价尖锐湿疣治疗性疫苗效果的动物模型,主要通过一些免疫学指标间接反映疫苗效果。后续我们将在瘤细胞中导入并表达HPV11 E6、E7 基因,以此建立肿瘤动物模型,评价HPV11 L2NE7E6疫苗的抑制肿瘤生长作用。
此次工作为HPV11 尖锐湿疣治疗疫苗研究建立了初步的实验室基础,对于面临的如何提高细胞免疫水平问题,可从新型免疫佐剂的使用、免疫程序的改进及不同载体疫苗联合使用等方面逐步完善。
[1]Koutsky L.Epidemiology of genital human papillomavirus in-fection[J].Am J Med,1997,102:3-8.
[2]Oh S T,Longworth M S,Laimins L A.Roles of the E6 and E7 proteins in the life cycle of low-risk human papillomavirus type 11[J].J Virol,2004,78:2620-2626.
[3]Beutner K R,Ferenczy A.Therapeutic approaches to genital warts[J].Am J Med,1997,102:28-37.
[4]Coleman N,Birley H D L,Renton A M,et al.Immunological events in regressing genital warts[J].Am J Clin Pathol,1994,102:768-774.
[5]Welters M J,de Jong A,van den Eeden S J,et al.Frequent display of human papillomavirus type 16 E6-specfic memory T-helper cells in the healthy population as witness of previous viral encounter[J].Cancer Res,2003,63:636-641.
[6]张卉,赵莉,任皎.HPV11型L2E7融合蛋白的原核表达及其免疫效果观察[J].中国实验和临床病毒学杂志,2007,21(2):156-158.
[7]Klinman D M.Immunotherapeutic uses of CpG oligodeoxynucleotides[J].Nature Rev,2004,4:1-10.
[8]Stanley M,Coleman N,Chambers M.The host response to lesions induced by human papillomavirus[J].Ciba Found Symp,1994,187:21-32.
[9]Peng Shiwen,Best S R,Hung Chien-Fu,et al.Characterization of human papillomavirus type 11-specific immune responses in a preclinical model[J].Laryngoscope,2010,120(3):504-510.
[10]Shin T H,Pankhong P,Yan J,et al,Induction of robust cellular immunity against HPV6 and HPV11 in mice by DNA vaccine encoding for E6/E7 antigen[J].Hum Vaccin Immunother,2012,8(4):470-478.

