水稻病程相关基因OsPR1b启动子的表达特性研究
虞飞博 ,周洁,王栩鸣,杨勇,余初浪,程晔,严成其,陈剑平
1.浙江师范大学 生化学院,浙江 金华 321000;2.浙江省农业科学院 省部共建国家重点实验室培育基地,农业部植物保护与生物技术重点实验室,浙江省植物病毒重点实验室,浙江 杭州 310021
水稻(Oryza sativa)是世界上最重要的农作物之一,为全球半数以上人口特别是发展中国家提供粮食和蛋白质的来源。然而,由于农作物单一的种植方式使它的生长过程更容易受到外界病原菌的影响,而干旱和盐渍是影响世界水稻产量的两个主要的非生物因素。
水稻在受病原菌感染、物理伤害和防卫相关信号等刺激后,会诱导自身的抗病防卫体系,从而激活表达下游相应的病程相关(pathogenesis-related,PR)基因。PR基因的诱导表达可以增强植株的抗病性,在水稻病害防御相关的研究中常被作为特征分子标记而广泛使用[1]。同时,PR基因在衰老、逆境及生长发育过程中也发挥着重要作用。由于PR 蛋白是在植物受到胁迫后诱导合成的一类蛋白,它的表达关键在于转录水平[2]。在拟南芥和烟草中,关于PR基因的诱导表达调控机制已有较多报道[2-5],对于它们启动子的活性及其顺式作用元件和转录因子的作用也分析得较为详尽。而水稻作为单子叶植物研究的模式生物,了解PR基因的表达调控及功能,对研究植物的抗病性具有重要的现实意义。
PR1基因是PR基因家族的重要组成部分,它的表达经常被作为系统获得性抗性(systemic acquired resistance,SAR)建立的标志。最早发现的水稻PR1家族成员OsPR1a和OsPR1b被报道受稻瘟病菌及环境胁迫和一些化学物质的广泛诱导[6],但有关它们在水稻各个组织中的具体表达模式和诱导特性的信息仍然非常有限。启动子的起始往往间接反映基因的表达情况,因此,我们通过构建OsPR1bp::GUS表达载体和Real-time PCR,分析了OsPR1b的活性和表达特征,旨在进一步探索水稻SAR 诱导过程和OsPR1b基因表达的内在关系。
1 材料与方法
1.1 材料
水稻品种日本晴(O.sativaL.ssp.japonicacv.Nipponbare)和石狩白毛(O.sativaL.ssp.japonicacv.Ishikari-shiroge,I-S)由本实验室提供;大肠杆菌DH5α、根瘤农杆菌EHA105和水稻白叶枯菌(Xanthomonas oryzaepv.oryzae,Xoo)菲律宾生理小种P10(PXO124)均为本实验室保存;双元载体Pnos-HPT-T35S-GUS-Tnos 由本实验室在pCAMBIA0380载体基础上改造获得;pMD19-T载体、Pyrobest DNA聚合酶购自TaKaRa 公司;总DNA 提取试剂盒DNeasy Plant Mini Kit 购 自Qiagen 公 司;TRIzol 试剂购自Invitrogen 公司;iScript 逆转录试剂盒和Sso-Fast EvaGreen Supermix 试剂盒均购自Bio-Rad 公司;DNA 片段及质粒回收试剂盒购自Promega 公司;BamHⅠ和KpnⅠ内切酶购自NEB 公司;T4DNA 快速连接酶购自Fermentas 公司;X-gluc(5-溴-4-氯-3-吲哚基-β-D-葡萄糖醛酸)购自PhytoTechnology Laboratories 公司;甲基茉莉酸(methyl jasmonate,JA)购自TCI公司;乙酰水杨酸(salicylic acid,SA)购自BBI公司;激动素(kinetin,KT)购自Sigma公司;3-吲哚乙酸(3-indole-acetic acid,IAA)、赤霉素(gibberellic acid,GA)、脱落酸(abscisic acid,ABA)和乙烯利(ethephon,ETH)均购自生工公司。
1.2 启动子的克隆与载体构建
根 据 NCBI 中的水 稻OsPR1b(LOC_Os01g28450.1)基因组序列,利用Oligo 软件设计引物,用于扩增基因启始密码子ATG 前约2.5 kb 的启动子序列,并在上、下游引物中分别引入BamHⅠ和KpnⅠ酶切位点,便于和GUS报告基因表达载体连接。引物由上海生工生物工程公司合成,序列见表1。按照DNeasy Plant Mini 试剂盒说明书提取水稻日本晴总DNA,并以此DNA 为模板、OsPR1bp-F/R为引物进行PCR 扩增,体系参照Pyrobest DNA 聚合酶说明书。扩增条件为94℃ 5 min,然后以94℃30 s、58℃30 s、72℃2.5 min 行33 个循环。扩增结束后,加入rTaq DNA 聚合酶,继续在72℃反应10 min 加“A”,获得的启动子片段大小为2593 bp。用T4DNA 连接酶于25℃连接30 min,将回收纯化的启动子片段连入pMD19-T 载体中。PCR 鉴定正确后送铂尚生物技术(上海)有限公司测序,测序结果与GenBank 中的日本晴序列一致。将连有启动子片段的pMD19-T 载体用BamHⅠ和KpnⅠ酶切,回收片段后,连入经同样酶切的GUS表达载体中。
1.3 农杆菌介导的水稻转化
将构建得到的OsPR1bp::GUS表达载体通过电击转入农杆菌EHA105 中,参考Hiei 等[7]的转基因方法,再将农杆菌转入石狩白毛成熟胚诱导的愈伤组织中,获得相应的OsPR1bp::GUS转基因植株。
1.4 GUS组织化学染色
GUS 组织化学染色法参照Jefferson 等[8]报道的方法进行。转入OsPR1bp::GUS的愈伤组织经首轮筛选21 d 后,随机挑选抗性愈伤进行染色,其他植物组织取自T2代转基因植株。用Nikon SMZ1000立体显微镜拍摄,拍摄前将含有叶绿素的样品置于100%酒精中进行脱色处理。染色液成分包括1 mmol/L X-gluc[溶于0.1 mol/L 磷酸缓冲液(pH7.0)中]、10 mmol/L Na2EDTA、1 mmol/L 铁氰化钾、1 mmol/L 亚铁氰化钾、20%甲醇和0.5% Triton X-100。

表1 引物及序列
1.5 试验水稻的处理
水稻石狩白毛种植于浙江省农科院病毒学与生物技术研究所温室内,采用国际水稻所(IRRI)水稻营养液配方进行培养。水稻胚性愈伤用含2 mg/L 2,4-D 的NB 培养基诱导获得。取2 周龄根、茎、叶(第四叶),抽穗期带花幼穗和剑叶,1 月龄胚性愈伤组织进行RNA 提取和定量PCR,分析OsPR1b基因的组织表达特性。
转基因水稻石狩白毛种子溶液培养于温室内(生长条件:白天30℃,夜晚25℃,相对湿度60%~80%,光周期12 h/d),待长至四叶一心期时,分别移至含0.1 mmol/L 激素、100 mmol/L NaCl 及10% 聚乙二醇(PEG)的溶液中,以无菌去离子水为对照,处理根部24 h 后分别采集叶片,制备样品,用于分析OsPR1b基因启动子的非生物学应答反应。
培养条件同上,取3 周龄水稻幼苗。将培养好的水稻白叶枯菌致病菌株P10(PXO124)调至D600nm值为0.6~1.0,利用剪切接种法接种水稻幼苗,以无菌去离子水剪切为对照,接种24 h 后分别采集叶片,进行样品制备,用于分析OsPR1b基因启动子的生物学应答反应。以上所取的每个材料均有3 个不同的生物学重复。
1.6 RNA的提取及逆转录反应
样品用液氮速冻充分研磨后,加入1~2 mL TRIzol,按照TRIzol 试剂盒说明书提取RNA,待沉淀适度干燥后,用20~40μL 无RNase 的水溶解RNA。随后采用iScript cDNA Synthesis 试剂盒进行逆转录反应,合成第一链cDNA。
1.7 荧光定量PCR检测
Real-time PCR 反应体系按SsoFast EvaGreen Supermix 试剂盒说明书配制。扩增条件为95℃ 5 min,以95℃10 s、58℃10 s、72℃20 s 行45 个循环,最后72℃ 10 min。在40℃~95℃温度范围内,95℃10 min,40℃10 min,再缓慢提高至95℃,反应结束冷却至40℃绘制熔解曲线。Real-time PCR所用仪器为LightCycler 480 real-time PCR 仪(Roche公司)。采用比较Ct值的方法进行相对定量,以管家基因OsActin作为内标校正模板量,计算公式为2-ΔΔCt。Real-time PCR 引物见表1。
2 结果
2.1 启动子的序列分析
以已知的OsPR1b基因(LOC_Os01g28450.1)5'端上游3 kb的区域作为启动子搜索对象,在PLACE网站(http://www.dna.affrc.go.jp/PLACE/signalscan.html)进行搜索和扫描,对其中潜在的一些顺式作用元件进行分析(图1)。结果表明,OsPR1b启动子序列除了包含核心启动元件及CAAT 盒之外[9],还包含W box、TGA element、A box、-624 box、AuxRE 等一些被报道的顺式调控元件(表2)。表明OsPR1b基因可能受多重信号分子的调控。
2.2 启动子表达载体的构建
用BamH Ⅰ和KpnⅠ分别双酶切Pnos-HPTT35S-GUS-Tnos 载体和重组质粒pMD19-T-Os-PR1bp(图2B),再经连接、转化和PCR验证后获得相应的启动子表达分析载体OsPR1bp::GUS(图2A)。
2.3 转基因植株的获得
通过根癌农杆菌介导的遗传转化、转化子筛选和转基因植株的再生,共获得了68 个T0代株系,经PCR 分子鉴定及GUS 组织染色分析,得到58 个转基因阳性株系,其中24 个株系GUS 组织染色呈阳性;随机挑选部分具有GUS 活性的株系进行繁种,得到T2代株系后进行系统的GUS组织化学分析。
2.4 OsPR1b 基因启动子在器官或组织中的特异性表达

图1 OsPR1b启动子中所预测的部分胁迫响应元件位置

表2 OsPR1b启动子中的顺式作用元件详情
特定的启动子起始过程常常决定了某个基因是否应当表达或表达量的多少。通过分析OsPR1b启动子在各个器官或组织中驱动GUS基因的表达情况,可以在一定程度上反映它所控制的OsPR1b基因的时空表达特性。为此,我们对转OsPR1bp::GUS抗性愈伤组织、T1代转基因植株的种子及T2代植株的不同部位进行了GUS 组织化学分析,同时,利用Real-time PCR 对野生型愈伤组织和水稻不同时期各组织(14 d 根、茎、叶;开花期剑叶、小花)中OsPR1b基因的表达量进行了分析(图3)。结果表明,GUS基因在各组织中的表达差异很大,大部分组织均呈现低水平的GUS 活性,叶片中的GUS 染色较为明显,在5 日龄的幼苗中主要集中在叶尖处,叶缘及节间上也有部分活性(图3,a~e),在2 周龄的植株叶片及开花期的剑叶中则可以观察到较为明显GUS 染色,这些叶片上的染色模式基本上表现为不规则斑点状分布(图3,f~i)。另外,在抗性愈伤及萌发的种胚中也存在GUS基因表达的迹象(图3,l、m)。而在其他部位,如茎、根、花中均未观察到明显的GUS活性(图3,a、j、k)。Real-time PCR 的结果也显示,OsPR1b在叶片中的表达量远远高于其他组织(图3n)。这些结果证明,OsPR1b基因主要在叶片部位表达,从而发挥其抗病的生物学功能。

图2 OsPR1bp::GUS表达载体的构建(A)及质粒酶切电泳图(B)
2.5 OsPR1bp的诱导表达特性
为了了解所分离的启动子片段对不同信号分子的响应变化,我们对2 周龄水稻苗的根部进行了各种处理,并利用Real-time PCR 技术对水稻第四叶和根部OsPR1b基因的表达变化进行分析(图4)。结果显示,在直接接触激素的根部,MeJA和KT 可诱导OsPR1b表达增强,诱导倍数分别为17.91±2.27和4.13±2.14;盐胁迫处理也可显著提高基因的表达水平,达到了33.09±2.01 倍;其他信号分子,除了H2O2的处理没有明显差异外,基因的表达量均出现了不同程度的下调。在水稻的第四叶,KT和ABA可以强烈诱导OsPR1b的表达改变,基因的表达量分别提高了196.8±5.19和62.85±9.12 倍;盐胁迫和H2O2处理时则分别提高了4.81±1.68和3.00±0.47 倍;其他处理情况下,除了GA 处理抑制外,均出现了不同程度的上调趋势,其中,抗病信号分子SA和MeJA 的上调变化并不显著。不论是在根中还是叶片,经过不同激素和非生物胁迫的处理,OsPR1b基因的表达差异变化不大,只有少数几种激素和盐胁迫的处理较为显著,这暗示着OsPR1b基因的表达主要受少数信号途径的调控。
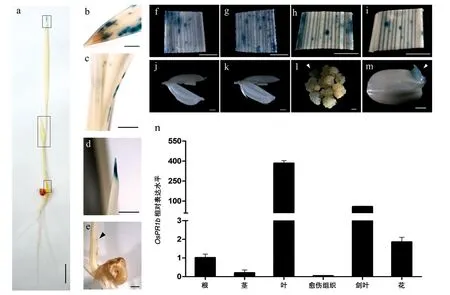
图3 OsPR1bp::GUS转基因水稻的GUS染色和OsPR1b基因在健康组织中的表达情况

图4 激素和非生物胁迫处理24 h后OsPR1b的诱导表达特征
为了阐明水稻致病菌与OsPR1b基因的互作关系,以及抗病信号分子SA和MeJA 在此过程中的作用,我们利用水稻白叶枯菌毒性菌株P10(PXO124)对2 周龄水稻苗第四叶和第五叶进行接种,同时用SA和MeJA 溶液处理其根部。共同处理24 h 后,分别取第四叶和第五叶进行相对表达量的分析(图5),结果发现,与接水对照相比,单独接种Xoo后Os-PR1b基因的表达量变化并不显著;而SA 共同处理组则表现为微弱的上调趋势,其中第四叶的变化较为明显;有意思的是,当同时进行接种Xoo和MeJA处理后,OsPR1b基因的表达量受到了明显的诱导,与对照相比,第四叶和第五叶中分别提高了约17 倍和8倍。这表明MeJA很可能在植物对抗Xoo侵染的过程中起着某种重要的作用。

图5 水稻白叶枯菌PXO124菌株和SA、MeJA共同处理24 h后OsPR1b基因表达水平的变化
3 讨论
作为一种分子标记基因,OsPR1b的表达在健康植物的叶片中几乎是沉默的[6],在OsPR1bp转基因水稻中,我们也仅在叶片中观察到了明显的GUS活性,而在其他所有组织中的表达十分微弱,甚至不能被检测到。Real-time PCR 结果也显示,在同一组织如根中,OsPR1b基因的Ct值和管家基因Actin相比较,有10个循环以上的差异。OsPR1bp在幼叶中的表达主要分布在叶尖和叶缘等一些细胞分裂较为旺盛的部位,这表明OsPR1bp很可能参与了水稻幼苗的生长发育过程。同样,在萌动的种胚内也出现了GUS活性,事实上,通过进一步的扫描启动子序列,我们发现在基因的上游存在数个与种子萌发相关的POLASIG1 元件(核心序列为AATAAA)[15]。到了水稻秧苗期和开花期,叶片上的GUS 染色呈现斑点状的随机分布,我们推测这种表达模式可能和OsPR1b的抗病性有关。
茉莉酸(JA)和茉莉酸甲酯是脂源性激素分子,调节生长发育的许多方面,调控对非生物及生物胁迫的应答反应。用JA 处理水稻后会诱导许多PR基因如OsPR1b 基因的表达[16]。然而,PR 的诱导表达属于较晚期的事件[17],我们的实验表明接种Xoo或JA 单独处理根部24 h 后,叶片中OsPR1b的表达水平没有出现明显的上调变化,但在水稻受到Xoo侵染时,外源施加JA 可以显著增强OsPR1b基因的表达量,从而增强植株的抗病性,这与已报道的外源施加JA 确实能提高水稻植株抗白叶枯病能力的实验结果相符[18]。
通常,水稻叶片中存在高水平的自由态SA[19],内源性SA 水平的提高对于水稻防御反应的影响似乎并不显著[20],PR基因在SA 缺陷的NahG 水稻中的表达也并没有因为SA 的缺乏而显著减弱[21],而我们的实验结果也显示,在Xoo侵染后24 h,SA 的外源施加也不能引起OsPR1b表达量的显著增加。然而,SA信号通路的一个重要调节者NPR1,被证明在水稻抗白叶枯病的过程中起重要作用,它能够和许多TGA家族转录因子相互作用,将其在水稻中超表达后能够极大地提高水稻对Xoo的抗性,同时也激活了一系列防御相关基因[22]。在拟南芥中,TGA3 能够诱导细胞分裂素(CTK)的转录激活因子ARR2 结合于PR1启动子上,从而激活CTK 响应的防御基因的转录[23]。在OsPR1b基因启动子上我们也发现了数个TGA结合的顺式作用元件,Real-time PCR 结果也证明KT 确实能够显著增强OsPR1b的表达水平,所以我们推测在水稻中KT 对OsPR1b基因的诱导变化很可能也是通过调节SA-NPR1 的信号路径,最终影响水稻对病原菌的免疫反应。
值得注意的是,在根中盐胁迫的诱导非常明显,2个模拟干旱的非生物因子NaCl和PEG 均能不同程度地提高叶片中OsPR1b的表达水平。ABA 调节着植物生长和发育的许多生理过程,它在水稻对盐、干旱和寒冷等非生物胁迫的耐受性方面所起的作用已得到广泛研究[24],近期的研究也表明,干旱条件下水稻植株会产生MeJA,进而刺激产生ABA[25],而我们的研究结果也证明根部施加ABA 确实能够显著增强OsPR1b在叶片的表达。因此,我们推断干旱条件诱导OsPR1b基因的表达很可能是通过刺激水稻植株产生ABA来实现的。
GA 通常被认为是水稻内部免疫反应的负控调节者[26],据报道调节GA 水平的OsGA20ox3转基因植株可改变水稻对Xoo及稻瘟病的抗性,PR1的诱导表达水平及SA和JA 的积累水平也确实受到了GA水平的影响[27]。这和我们的实验结果相符,即GA 有可能通过抑制如OsPR1b基因的表达而增加水稻的感病性。
总之,根据我们现阶段的实验结果和前人的研究,我们推测,OsPR1b基因可通过JA、KT和ABA 等激素水平的调控整合到了水稻生物和非生物信号传导的网络,从而对Xoo侵染或盐/干旱胁迫做出响应,同时SA-NPR1 的信号通路可能在其中发挥重要作用。当然,我们也应该认识到,PR基因作为一种较为敏感的基因,它的表达还受到多种因素如生理因素的影响[28]。目前,我们已构建和积累了部分突变体材料,希望通过研究OsPR1b基因在这些突变体中的表达变化,以进一步明确OsPR1b基因在水稻中的表达调控机制。
[1]Gnanamanickam S,Priyadarisini V B,Narayanan N,et al.An overview of bacterial blight disease of rice and strategies for its management[J].Curr Sci,1999,77(11):1435-1444.
[2]Datta S K,Muthukrishnan S.Pathogenesis-related proteins in plants[M].CRC press,1999.
[3]Niki T,Mitsuhara I,Seo S,et al.Antagonistic effect of salicylic acid and jasmonic acid on the expression of pathogenesis-related(PR) protein genes in wounded mature tobacco leaves[J].Plant Cell Physiol,1998,39(5):500-507.
[4]Van Loon L,Pierpoint W,Boller T,et al.Recommendations for naming plant pathogenesis-related proteins[J].Plant Mol Biol Rep,1994,12(3):245-264.
[5]Cao H,Bowling S A,Gordon A S,et al.Characterization of an Arabidopsis mutant that is nonresponsive to inducers of systemic acquired resistance[J].Plant Cell Online,1994,6(11):1583-1592.
[6]Agrawal G K,Rakwal R,Jwa N-S,et al.Signalling molecules and blast pathogen attack activates rice OsPR1a and Os-PR1b genes:a model illustrating components participating during defence/stress response[J].Plant Physiol Biochem,2001,39(12):1095-1103.
[7]Hiei Y,Komari T.Agrobacterium-mediated transformation of rice using immature embryos or calli induced from mature seed[J].Nat Protocols,2008,3(5):824-834.
[8]Jefferson R A,Kavanagh T A,Bevan M W.GUS fusions:beta-glucuronidase as a sensitive and versatile gene fusion marker in higher plants[J].EMBO J,1987,6(13):3901.
[9]Yamaguchi-Shinozaki K,Shinozaki K.Arabidopsis DNA encoding two desiccation-responsive rd29 genes[J].Plant Physiol,1993,101(3):1119.
[10]Eulgem T,Somssich I E.Networks of WRKY transcription factors in defense signaling[J].Curr Opin Plant Biol,2007,10(4):366-371.
[11]Lebel E,Heifetz P,Thorne L,et al.Functional analysis of regulatory sequences controlling PR? 1 gene expression in Arabidopsis[J].Plant J,1998,16(2):223-233.
[12]Niu X,Renshaw-Gegg L,Miller L,et al.Bipartite determinants of DNA-binding specificity of plant basic leucine zipper proteins[J].Plant Mol Biol,1999,41(1):1-13.
[13]Hennig J,Dewey R E,Cutt J R,et al.Pathogen,salicylic acid and developmental dependent expression of a β-1,3-glucanase/GUS gene fusion in transgenic tobacco plants[J].Plant J,1993,4(3):481-493.
[14]Ulmasov T,Hagen G,Guilfoyle T J.ARF1,a transcription factor that binds to auxin response elements[J].Science,1997,276(5320):1865-1868.
[15]O'Neill S D,Kumagai M H,Majumdar A,et al.The α-amylase genes in Oryza sativa:characterization of cDNA clones and mRNA expression during seed germination[J].Mol Gen Genet,1990,221(2):235-244.
[16]Browse J.Jasmonate passes muster:a receptor and targets for the defense hormone[J].Ann Rev Plant Biol,2009,60:183-205.
[17]Ku J.Concepts and direction of induced systemic resistance in plants and its application[J].Eur J Plant Pathol,2001,107(1):7-12.
[18]Mei C,Qi M,Sheng G,et al.Inducible overexpression of a rice allene oxide synthase gene increases the endogenous jasmonic acid level,PR gene expression,and host resistance to fungal infection[J].Mol Plant Microbe In,2006,19(10):1127-1137.
[19]Silverman P,Seskar M,Kanter D,et al.Salicylic acid in rice(biosynthesis,conjugation,and possible role)[J].Plant Physiol,1995,108(2):633-639.
[20]Yuan Y,Zhong S,Li Q,et al.Functional analysis of rice NPR1 like genes reveals that OsNPR1/NH1 is the rice orthologue conferring disease resistance with enhanced herbivore susceptibility[J].Plant Biotechnol J,2007,5(2):313-324.
[21]Yang Y,Qi M,Mei C.Endogenous salicylic acid protects rice plants from oxidative damage caused by aging as well as biotic and abiotic stress[J].Plant J,2004,40(6):909-919.
[22]Chern M,Fitzgerald H A,Canlas P E,et al.Overexpression of a rice NPR1 homolog leads to constitutive activation of defense response and hypersensitivity to light[J].Mol Plant Microbe In,2005,18(6):511-520.
[23]Choi J,Huh S U,Kojima M,et al.The cytokinin-activated transcription factor ARR2 promotes plant immunity via TGA3/NPR1-dependent salicylic acid signaling in Arabidopsis[J].Dev Cell,2010,19(2):284-295.
[24]Cutler S R,Rodriguez P L,Finkelstein R R,et al.Abscisic acid:emergence of a core signaling network[J].Ann Rev Plant Biol,2010,61:651-679.
[25]Kim E H,Kim Y S,Park S-H,et al.Methyl jasmonate reduces grain yield by mediating stress signals to alter spikelet development in rice[J].Plant Physiol,2009,149(4):1751-1760.
[26]Yang D L,Yang Y,He Z.Roles of plant hormones and their interplay in rice immunity[J].Mol Plant,2013,6(3):675-685.
[27]Yang D-L,Li Q,Deng Y-W,et al.Altered disease development in the eui mutants and Eui overexpressors indicates that gibberellins negatively regulate rice basal disease resistance[J].Mol Plant,2008,1(3):528-537.
[28]Davoine C,Le Deunff E,Ledger N,et al.Specific and constitutive expression of oxalate oxidase during the ageing of leaf sheaths of ryegrass stubble[J].Plant Cell Environ,2001,24(10):1033-1043.

