辣椒素及二氢辣椒素对神经胶质瘤C6细胞和骨肉瘤ROS 17/2.8细胞的抑制作用
谢 乐,周 慎*,伍大华,刘 冬,向光红,唐 涛,唐劲天
(1.湖南中医药大学研究生院,湖南 长沙410208;2.湖南省中医药研究院附属医院脑病科,湖南 长沙410006;3.贵阳中医学院,贵州 贵阳550002;4.湖南省脑科医院神经内科,湖南 长沙410007;5.北京大北农科技集团股份有限公司饲用微生物工程国家重点实验室,北京100192;6.清华大学工程物理系医学物理与工程研究所,北京100084)
辣椒被亚洲和南美洲等世界各地广泛食用,其产生辣味的物质统称为辣椒素类似物, 属于香草酰胺类生物碱,包括辣椒素(Capsacin,Cap)、二氢辣椒素(Dihydrocapsaicin,DHC)、高辣椒素、高二氢辣椒素、降二氢辣椒素等。 其中辣椒素以及二氢辣椒素是辣椒呈辣味的主要成分, 占辣椒素类似物的90%[1]。现代药理学研究表明辣椒素以及二氢辣椒素能镇痛、抗炎、止痒、降压、调脂及抗癌等[2-3],随着研究的深入, 辣椒素抗肿瘤作用正逐渐成为研究的热点。已有研究报道辣椒素对肝癌、乳腺癌、胰腺癌、前列腺癌等[4-6]多种癌细胞具有抑制作用,本文报道辣椒素及二氢辣椒素对大鼠神经胶质瘤C6 细胞、 骨肉瘤ROS 17/2.8 细胞增殖的影响,并对其机制进行初步探讨。
1 材料与方法
1.1 主要试药与仪器
辣椒素、二氢辣椒素(美国sigma,纯度99%);大鼠神经胶质瘤C6 细胞、骨肉瘤ROS 17/2.8 细胞(中国医学科学院基础医学研究所细胞中心);DMEM 培养基(美国Gibco BRL)、牛胎血清、L-谷氨酰胺、HEPES、 二甲基亚砜(美国Thermo 公司)、CCK-8(日本同仁化学研究所)、活性氧检测试剂盒(碧云天生物技术研究所)、Annexin V-FITC 细胞凋亡检测试剂盒(南京凯基生物科技发展有限公司)、CO2细胞培养箱(美国Thermo 公司)、酶联免疫检测仪 (美国BIO-RAD 公司,BIO-RAD 680 型)、BD Calibur 型流式细胞分析仪(美国BD 公司)。
1.2 方法
1.2.1 细胞培养 将C6、ROS17/2.8 细胞接种于含10%胎牛血清、2 mmol/L L-谷氨酰胺、2 mmol/L HEPES 的DMEM 培养基中。 在37 ℃、5%CO2、饱和湿度的培养箱中培养,取对数期生长良好的细胞进行实验。
1.2.2 CCK-8 法检测辣椒素及二氢辣椒素对C6 细胞、ROS17/2.8 细胞的抑制作用 辣椒素以及二氢辣椒素分别溶解于含0.5%DMSO 的DMEM 培养基中。 取对数生长期的细胞, 调整细胞浓度为5×104/mL,在无菌96 孔培养板中每孔加入100 μL 细胞悬浮液,37 ℃孵箱中培养24 h 后, 吸弃培养基,分别加入浓度为50、100、150、200 μmol/L 的Cap/DHC 培养液,另设溶剂对照组(含0.5%DMSO 的细胞培养液100 μL) 及空白对照组 (细胞培养液100 μL), 每组设6个复孔。 分别继续培养12、24、48、72 h 后检测细胞抑制率。吸弃培养液,每孔加入含10 μL CCK-8 的细胞培养液100 μL,继续培养2 h 后, 用酶标仪检测450 nm 波长的吸光度(OD值),计算细胞抑制率。
细胞抑制率(%)=[(Ac-As)/(Ac-Ab)]×100%
As:实验孔(含有细胞的培养液、CCK-8、药物),Ac:对照孔(含有细胞的培养液、CCK-8、不含药物),Ab:空白孔(不含细胞和药物的培养液、CCK-8)。
1.2.3 辣椒素及二氢辣椒素对C6 细胞凋亡率的检测 取对数生长期的C6 细胞, 调细胞浓度为1×105个/mL,接种于6 孔细胞培养板,每孔含细胞悬浮液2 mL。37 ℃、5%CO2细胞培养箱中培养24 h 后加入200 μmol/L 的Cap/DHC。 继续培养12 h 后,收集细胞,PBS 洗涤2 次,重新悬浮细胞并计数,取含5×105个细胞的悬浮液,1 000 r/min 离心5 min 后弃上清,加入500 μL 的Binding Buffer 悬浮细胞, 再加入5 μL Annexin V-FITC 及5 μL PI,混匀,室温,避光反应5~15 min, 用流式细胞仪检测平均荧光强度(MFI),激发波长488 nm;发射波长530 nm。
1.2.4 辣椒素及二氢辣椒素对C6 细胞活性氧自由基(ROS)的影响 取对数生长期的C6 细胞,调细胞浓度为1×105个/mL,接种于6 孔细胞培养板,每孔含 细 胞 悬 浮 液2 mL。 培 养24 h 后, 加 入200 μmol/L 的Cap/DHC,继续培养12 h,吸弃培养液,加入含有10 μmol/Lol/L DCFH-DA(二氯二氢荧光素-乙酰乙酸酯) 的无血清细胞培养液1 mL,37 ℃细胞培养箱内孵育20 min。 用无血清细胞培养液洗涤3 次,充分除去未进入细胞的DCFH-DA。收集细胞,用PBS 重悬并计数,取含2×105个细胞的悬浮液,用流式细胞仪检测,激发波长488 nm。
1.3 统计学分析
2 结果
2.1 CCK-8 法检测辣椒素及二氢辣椒素对大鼠神经胶质瘤C6 细胞的抑制作用
CCK-8 实验结果显示,Cap/DHC 对大鼠神经胶质瘤C6 细胞具有良好抑制作用, 且与时间和浓度呈正相关。在12 h 后Cap/DHC 对C6 细胞的抑制作用即具有统计学意义,在72 h 后,Cap/DHC 对大鼠神经胶质瘤C6 细胞的抑制作用最强, 分别为Cap(200 μmol/L)80.29%, DHC(200 μmol/L)73.92%,见图1-A、B, 说明Cap/DHC 对大鼠神经胶质瘤C6细胞具有良好的抑制作用。 溶剂对照组(0.5%DMSO)的抑制率始终在5%以下,且与空白对照组相比较,差异无统计学意义(P>0.05)。
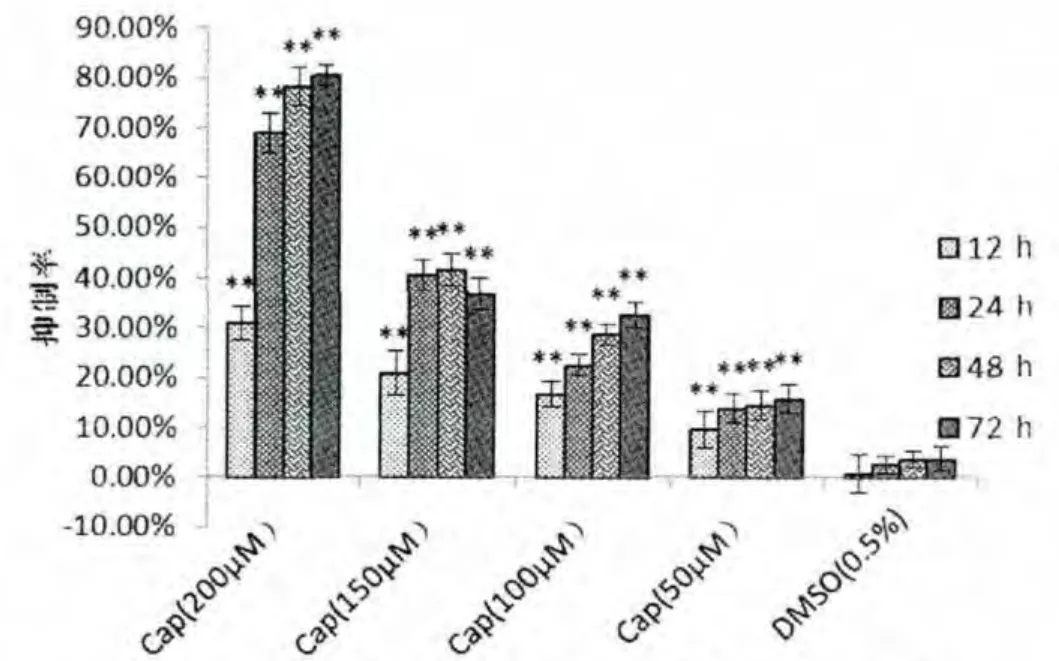
图1-A 辣椒素对大鼠神经胶质瘤C6 细胞增殖的抑制作用(n=5,±s)
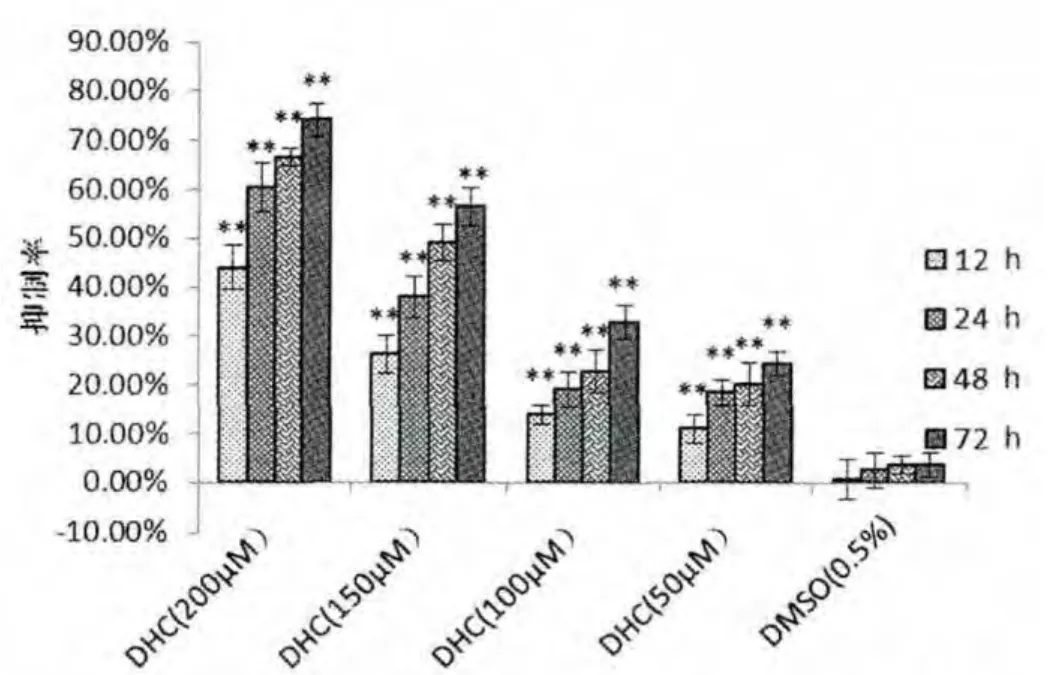
图1-B 二氢辣椒素对大鼠神经胶质瘤C6 细胞增殖的抑制作用(n=5,±s)
2.2 CCK-8 法检测辣椒素及二氢辣椒素对大鼠骨肉瘤ROS 17/2.8 细胞的抑制作用
CCK-8 实验结果显示,随作用时间和Cap/DHC浓度的变化,Cap/DHC 对大鼠骨肉瘤ROS 17/2.8 细胞抑制作用随时间和浓度的增加而逐渐增强。 在12 h 后Cap/DHC 对C6 细胞的抑制作用即具有统计学意义,在72 h 后,Cap/DHC 对大鼠骨肉瘤ROS 17/2.8 细胞的抑制作用达到最大, 分别为: Cap(200 μmol/L)67.27%,DHC(200 μmol/L)66.14%,见图2-A、B, 说明Cap/DHC 对大鼠骨肉瘤ROS 17/2.8 细胞具有较好的抑制作用。 溶剂对照组(0.5%DMSO)的抑制率始终在5%以下,且与空白对照组相比较,差异无统计学意义(P>0.05)。
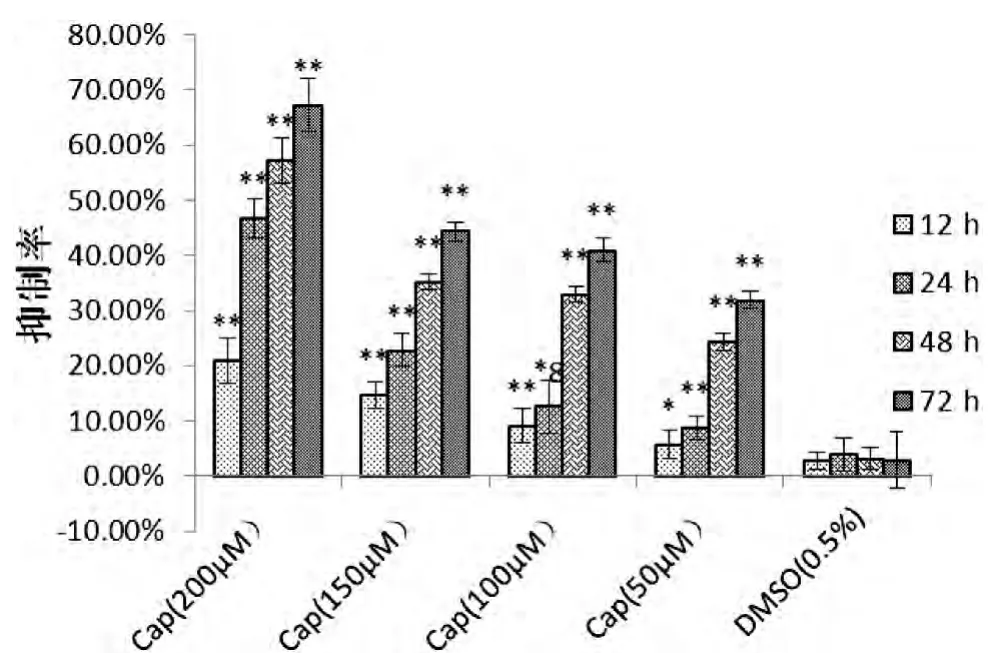
图2-A 辣椒素对大鼠骨肉瘤ROS 17/2.8 细胞增殖的抑制作用(n=5,±s)

图2-B 二氢辣椒素对大鼠骨肉瘤ROS 17/2.8 细胞增殖的抑制作用(n=5,±s)
2.3 辣椒素及二氢辣椒素促进C6 细胞凋亡
流式细胞仪检测结果显示, 经Cap/DHC 处理12 h 后,C6 细胞存活率 明显下降, 由 (81.18±3.254)%分 别 下 降 至25.847%(Cap,200 μmol/L)、18.743%(DHC,200 μmol/L), 早期凋亡率显著增加,晚期凋亡率无明显变化,说明Cap/DHC 能促进C6 细胞发生早期凋亡。 见表1、图3。
2.4 辣椒素及二氢辣椒素提高C6 细胞内ROS水平
流式细胞仪检测结果表明, 经Cap/DHC 处理12 h 后,C6 细胞内ROS 的荧光强度明显增加,波峰右移,提示Cap/DHC 处理后C6 细胞内ROS 水平明显升高,统计分析后MFI 之间的差异具有显著统计学意义(P<0.01)。 见表2,图3。
表1 辣椒素及二氢辣椒素处理12 h 后对C6 细胞凋亡的影响 (n=3,±s,%)
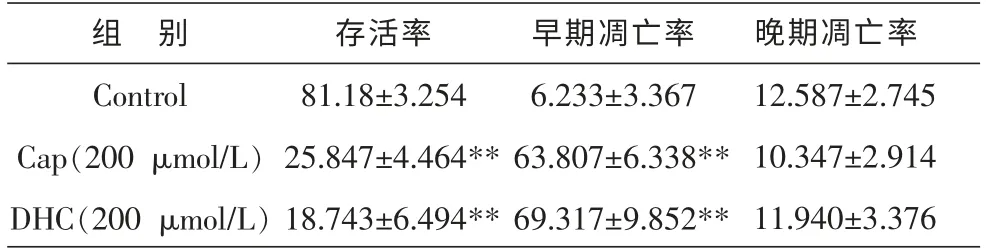
表1 辣椒素及二氢辣椒素处理12 h 后对C6 细胞凋亡的影响 (n=3,±s,%)
注:与对照组比较**P<0.01。 下表同。
组 别Control Cap(200 μmol/L)DHC(200 μmol/L)存活率81.18±3.254 25.847±4.464**18.743±6.494**早期凋亡率6.233±3.367 63.807±6.338**69.317±9.852**晚期凋亡率12.587±2.745 10.347±2.914 11.940±3.376
表2 辣椒素及二氢辣椒素处理12 h 后C6 细胞内ROS 含量的比较 (n=3,±s)

表2 辣椒素及二氢辣椒素处理12 h 后C6 细胞内ROS 含量的比较 (n=3,±s)
MFI 2.603±0.370 14.813±2.326**11.785±2.185**组 别Control Cap(200 μmol/L)DHC(200 μmol/L)
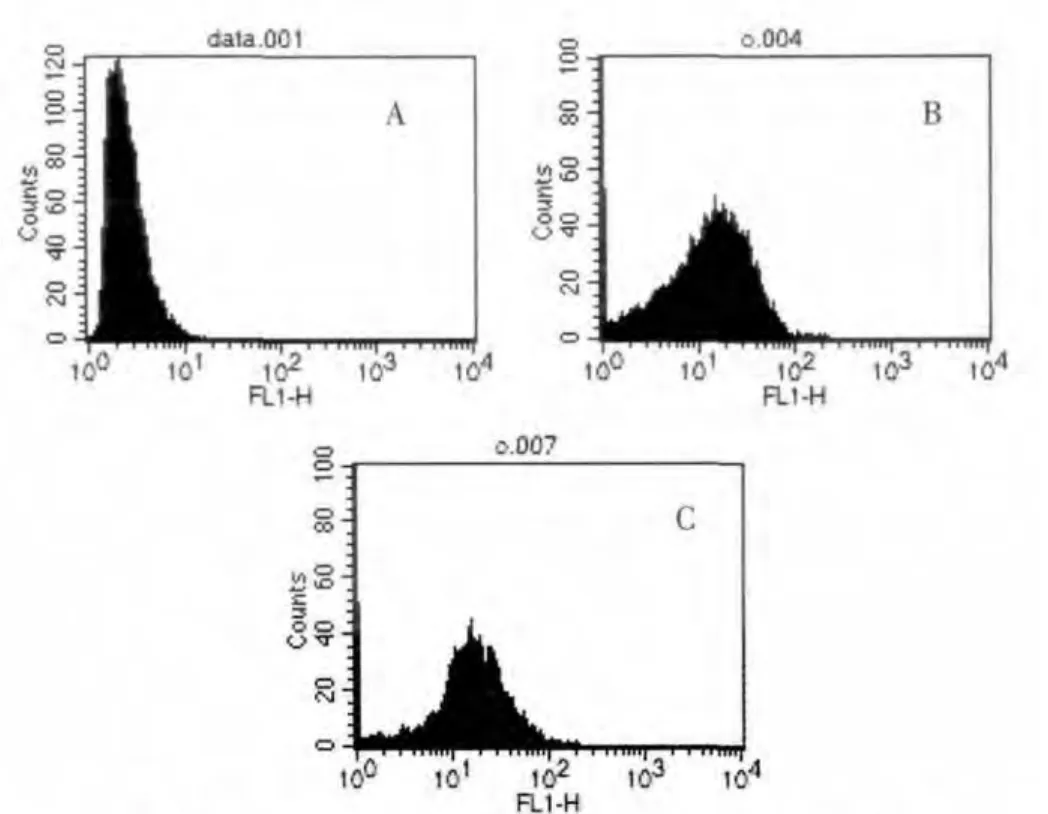
图3 流式细胞仪检测C6 细胞凋亡
3 讨论
神经胶质瘤是发生于神经外胚叶组织的肿瘤,占所有颅内肿瘤的40%~50%[7]。 世界卫生组织将神经胶质瘤依组织学分为:星形细胞肿瘤、少突胶质细胞肿瘤、室管膜肿瘤、脉络丛肿瘤、混合型神经胶质瘤等。 多生长于额叶、顶叶、小脑丘脑及松果体等部位。 具有高发病率、高复发率、高病死率和低治愈率“三高一低”的特点,所以寻求一种安全良效的抗神经胶质瘤药物成为当务之急。 本研究证明辣椒素及二氢辣椒素对大鼠神经胶质瘤细胞具有良好的抑制作用,最大抑制率可分别达80.29%、73.92%,能促进C6 细胞凋亡, 且证明其抗肿瘤机制与促进ROS 的产生相关。
骨肉瘤是最常见的恶性成骨性肿瘤之一,多发生于青年男性,其恶性程度极高,治疗难度大,预后极差[8]。 绝大部分发现时就已经发生肺部转移,导致其术后5年生存率低至5%~20%左右[9]。 骨肉瘤的治疗进展主要分为两方面:一是以大剂量化疗为主的综合治疗,化疗药物常用环磷酰胺、长春新碱、博莱霉素等;二是保肢手术的开展,明显降低患者截肢的概率,且对生存率及复发率无明显影响。 本研究用CCK-8 法证明辣椒素及二氢辣椒素对骨肉瘤ROS 17/2.8 细胞具有良好抑制作用,最大抑制率可达67.27%、66.14%, 辣椒素及二氢辣椒素有潜力成为骨肉瘤治疗的辅助用药。
细胞凋亡(apoptosis)又名程序性细胞死亡,是机体为维持自身内环境的稳定,在多种基因调控下细胞主动的、严密完整的、程序性的死亡过程[10-11]。细胞凋亡的诱导途径有3 种,分别为:死亡受体途径(细胞外途径)、线粒体途径(细胞内途径)和内质网途径。 三种途径最终汇聚到同一通路,激活caspase-3,损伤肿瘤细胞DNA,最终导致细胞凋亡[12]。ROS 是细胞有氧代谢的产物, 对细胞内的大分子物质具有较大的毒性,能氧化脂质和蛋白质,以及损伤DNA 等[13]。 ROS 还作为体内氧化还原分子的重要一员, 在细胞的增殖、 分化和凋亡过程中发挥重要作用,细胞内ROS 的升高能促进细胞凋亡和坏死[14],研究表明多种抗肿瘤药物的机制都与ROS 的产生相关。
综上所述,辣椒素及二氢辣椒素对大鼠神经胶质瘤C6 细胞、骨肉瘤ROS 17/2.8 细胞具有良好抑制作用,其抑制C6 细胞机制与促进肿瘤细胞凋亡,增加ROS 的产生密切相关,辣椒素及二氢辣椒素有望成为新型抗肿瘤药物。
[1]Reyes-Escogido MDL,Gonzalez-Mondragon EG,Vazquez-Tzompantzi E. Chemical and pharmacological aspects of capsaicin [J].Molecules,2011,16(2):1 253-1 270.
[2]Bode AM,Dong Z. The two faces of capsaicin [J]. Cancer Research,2011,71(8):2 809-2 814.
[3]Oyagbemi A,Saba A,Azeez O. Capsaicin:a novel chemopreventive molecule and its underlying molecular mechanisms of action[J]. Indian Journal of Cancer,2010,47(1):53-58.
[4]Malagarie-Cazenave S,Olea-Herrero N,Vara D,et al. The vanilloid capsaicin induces IL-6 secretion in prostate PC-3 cancer cells [J]. Cytokine,2011,54(3):330-337.
[5]Zhang JH,Lai FJ,Chen H,et al. Involvement of the phosphoinositide 3-kinase/Akt pathway in apoptosis induced by capsaicin in the human pancreatic cancer cell line PANC-1[J].Oncology Letters,2013,5(1):43-48.
[6]Bley K,Boorman G,Mohammad B,et al. A comprehensive review of the carcinogenic and anticarcinogenic potential of capsaicin[J]. Toxicologic Pathology,2012,40(6):847-873.
[7]Sathornsumetee S,Rich JN,Reardon DA. Diagnosis and treatment of high-grade astrocytoma [J]. Neurologic Clinics,2007,25(4):1 111-1 139.
[8]Poletajew S,Fus L,Wasiutynski A. Current concepts on pathogenesis and biology of metastatic osteosarcoma tumors [J]. Ortop Fraumatol Rehabil,2011,13(6):537-545.
[9]Fernandez-Pineda I,Bahrami A,Green JF,et al. Isolated subcutaneous metastasis of osteosarcoma 5 years after initial diagnosis[J]. Journal of Pediatric Surgery,2011,46(10):2 029-2 031.
[10]Chan D,Van Dyke W,Bahls M,et al. Mechanostasis in apoptosis and medicine [J]. Progress in biophysics and molecular biology,2011,106(3):517-524.
[11]孙丽华,党海霞,卜兰兰,等.Zeylenone 对急性淋巴细胞白血病细胞增殖及凋亡的影响[J].湖南中医药大学学报,2012,32(9):15-20.
[12]Ulukaya E,Acilan C,Yilmaz Y. Apoptosis:why and how does it occur in biology?[J]. Cell Biochemistry and Function,2011,29(6):468-480.
[13]Circu ML,Aw TY. Reactive oxygen species,cellular redox systems,and apoptosis [J]. Free Radical Biology and Medicine,2010,48(6):749-762.
[14]Ki YW,Lee JE,Park JH,et al. Reactive oxygen species and mitogen-activated protein kinase induce apoptotic death of SH-SY5Y cells in response to fipronil [J]. Toxicology Letters,2012,211(1):18-28.

