黄芪多糖与总黄酮抗小鼠四环素肝毒性的比较研究
姚晓敏,李 越,张小莉,李本勇,林爱斌,李宏伟
(1.浙江医药高等专科学校药学系,浙江 宁波315100;2.北京市理化分析测试中心,北京100050;3.吉林省四平市中心医院小儿外科,吉林 四平136000)
目前已知数以千计的药物可引起肝毒性[1],其表现与人类各种肝病的表现相同, 可以表现为肝细胞坏死、胆汁瘀积、细胞内微脂滴沉积或慢性肝炎、肝硬化等。 其中,四环素是引起肝毒性的药物之一,可诱发小泡性脂肪肝。 临床上根据患者是否饮酒将脂肪肝分为酒精性脂肪肝 (ALD) 和非酒精性脂肪肝(NAFLD),NAFLD 是无过量饮酒史(男性<140 g 乙醇/周,女性<70 g 乙醇/周)、肝组织学病变与ALD 相似的临床综合征,包括单纯性脂肪肝、非酒精性脂肪性肝炎(NASH)和脂肪肝性肝硬化。 据报道,该病的患病率正在迅速上升, 已成为世界性公共卫生问题之一[2]。 对于脂肪肝的治疗,尚无疗效确切的药物,寻找有效的药物治疗NAFLD 十分必要。中药有着多靶点、多环节综合作用的特点,在治疗脂肪肝方面有着自身的优势。 因此,本研究采用四环素建立小鼠肝毒性模型, 考察中药黄芪主要有效组分多糖和总黄酮对NAFLD 的保护作用, 并比较二者对NAFLD 的保护作用,为黄芪的临床应用提供实验依据。
1 材料与方法
1.1 动物
ICR 小鼠50 只, 雄性, 体质量20~22 g,SPF级,购自北京维通利华实验动物技术公司,动物许可证编号No.SCXK(京)2012-0001。 所有动物实验期间饲养于北京实验动物研究中心,即屏蔽级动物房,每日明暗室各12 h,恒温恒湿,标准饲料,自由饮水。
1.2 药物与试剂
盐酸四环素(CAS:64-75-5)购自Ameresco 公司;谷丙转氨酶(ALT)(货号C009-2)、谷草转氨酶(AST)(货号C010-2)、甘油三酯(TG)(货号F001-1)、胆固醇(CHO)(货号F002-2)、丙二醛(MDA)(货号A003-1)、超氧化物歧化酶(SOD)(货号A001-1)和谷胱甘肽(GSH)(货号A006-2)测定试剂盒均购自南京建成生物工程研究所;黄芪多糖和黄芪总黄酮均购自南京泽朗医药科技有限公司, 纯度大于90%;联苯双酯滴丸(批号:13010104)购自北京市地坛医院;其他试剂均为分析纯化学试剂。
1.3 主要仪器
IKA T10 匀浆机(basic);GD120-S12 加热制冷水 浴 槽(Grant);多 功 能 酶 标 仪(varianscan Flash,Thermo);电子天平(LA5002,上海精天电子仪器公司);PHS-3C 酸度计(上海精密科学仪器厂);80i 电子显微镜(Nikon)。
1.4 实验方法
1.4.1 动物分组 将ICR 小鼠随机分为5 组,每组10 只,分别为正常对照组、四环素模型组、黄芪多糖组、黄芪总黄酮组和联苯双酯阳性对照组。
1.4.2 给药方法 黄芪多糖、总黄酮和联苯双酯分别采用0.5%羧甲基纤维素钠(CMC-Na)溶液配成浓度分别为62.5、62.5、18.75 mg/mL 的溶液,给药组分别按体质量给予黄芪多糖(500 mg/kg)、黄芪总黄酮(500 mg/kg)和联苯双酯(150 mg/kg),连续灌胃10 d, 正常组和模型组给予同体积0.5% CMC-Na溶液。
1.4.3 造模方法[3]在第10 天给药后1 h 时腹腔注射四环素200 mg/kg, 对照组给予等体积生理盐水。 给毒后24 h 眼球取血,并取肝脏进行检测。
1.4.4 检测指标 利用试剂盒,采用比色法测定小鼠血清ALT、AST、TG 和CHO 水平, 以及 肝组织TG、CHO、MDA、SOD 和GSH 水平;取肝组织经10%中性福尔马林溶液固定后做病理切片。 酒精梯度脱水,常规石蜡包埋,连续切片(厚度约5 μm),经苏木素-伊红(HE)染色后,光学显微镜下观察肝组织病理学改变。
1.5 统计学分析
采用SPSS 13.0 统计软件处理分析数据, 采用Student-Newman-Keuls(SNK)检验对各组同一时间点的同一指标进行比较,实验数据以“±s”表示,P<0.05 具有统计学意义。
2 结果
2.1 黄芪多糖与总黄酮对四环素所致小鼠血清转氨酶和血脂异常的影响
本研究给予小鼠腹腔注射四环素24 h 后血清ALT 和AST 显著升高(P<0.01),分别为正常对照组的4.4 和1.5 倍。 黄芪多糖和黄芪总黄酮预防性治疗均能够显著抑制ALT 水平的升高(P<0.01),但是对于AST 水平的变化,只有黄芪多糖能抑制其升高(P<0.01)。
此外, 本实验给予小鼠腹腔注射四环素24 h后, 还可见血清TG 和CHO 出现显著下降 (P<0.01),分别下降为对照组的39.5%和53.1%。而给予黄芪多糖预防性干预能明显抑制小鼠血脂异常降低(P<0.01,P<0.05),但是黄芪总黄酮预防性治疗对其血脂的变化无显著影响。 见表1。
表1 黄芪对四环素所致小鼠血清转氨酶和血脂改变的影响 (n=10,±s)
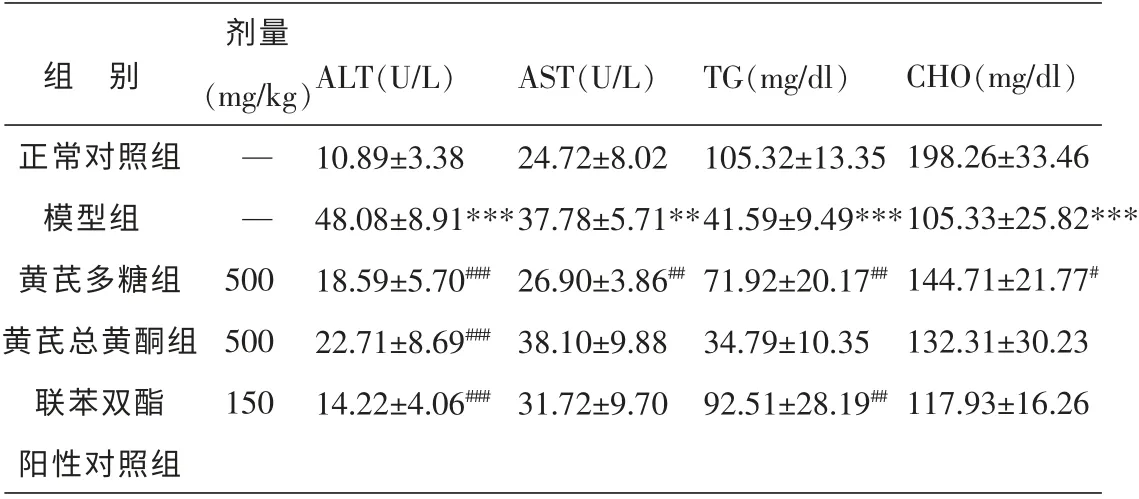
表1 黄芪对四环素所致小鼠血清转氨酶和血脂改变的影响 (n=10,±s)
注: 与正常对照组比较**P<0.01,***P<0.001; 与模型组比较#P<0.05,##P<0.01,###P<0.001。 下表同。
组 别正常对照组模型组黄芪多糖组黄芪总黄酮组联苯双酯阳性对照组剂量(mg/kg)— —500 500 150 ALT(U/L)10.89±3.38 48.08±8.91***18.59±5.70###22.71±8.69###14.22±4.06###AST(U/L)24.72±8.02 37.78±5.71**26.90±3.86##38.10±9.88 31.72±9.70 TG(mg/dl)105.32±13.35 41.59±9.49***71.92±20.17##34.79±10.35 92.51±28.19##CHO(mg/dl)198.26±33.46 105.33±25.82***144.71±21.77#132.31±30.23 117.93±16.26
2.2 黄芪多糖与总黄酮对四环素所致小鼠肝脏脂质蓄积的作用
给予小鼠腹腔注射四环素24 h 后, 肝脏出现明显的TG 和CHO 蓄积(P<0.01),分别为对照组的2.4 和1.3 倍。黄芪多糖和总黄酮均只能显著减轻四环素引起的小鼠肝脏CHO 蓄积(P<0.01)。 见表2。
表2 黄芪对四环素所致小鼠肝脂改变的影响(n=10,±s)
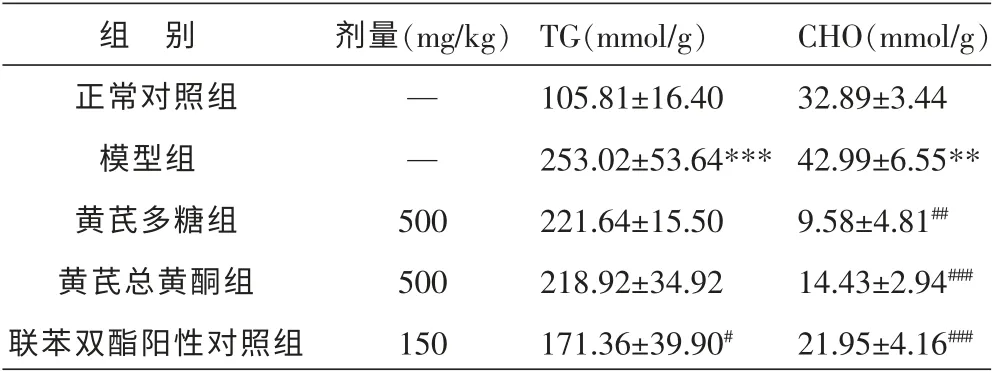
表2 黄芪对四环素所致小鼠肝脂改变的影响(n=10,±s)
组 别正常对照组模型组黄芪多糖组黄芪总黄酮组联苯双酯阳性对照组剂量(mg/kg)— —500 500 150 TG(mmol/g)105.81±16.40 253.02±53.64***221.64±15.50 218.92±34.92 171.36±39.90#CHO(mmol/g)32.89±3.44 42.99±6.55**9.58±4.81##14.43±2.94###21.95±4.16###
2.3 黄芪多糖与总黄酮对四环素所致小鼠肝脏氧化损伤的作用
模型组腹腔注射四环素24 h 时肝匀浆MDA水平显著升高为正常组的3.5 倍(P<0.01)。 而黄芪多糖和总黄酮组对MDA 升高有抑制趋势, 但无统计学意义(P>0.05)。 模型组小鼠肝脏抗氧化酶SOD活性升高了10.8%,GSH 显著升高了73.1%,黄芪总黄酮(500 mg/kg)可进一步显著升高GSH 水平(P<0.05),对抗氧化物SOD 活性影响不明显。 而黄芪多糖只是有升高SOD 活性和GSH 水平趋势, 但无统计学意义(P>0.05)。 见表3。
表3 黄芪对四环素所致小鼠肝组织MDA 形成和抗氧化物水平改变的影响 (n=10,±s)

表3 黄芪对四环素所致小鼠肝组织MDA 形成和抗氧化物水平改变的影响 (n=10,±s)
组 别正常对照组模型组黄芪多糖组黄芪总黄酮组联苯双酯阳性对照组剂量(mg/kg)— —500 500 150 MDA(nmol/mg)0.60±0.15 2.10±0.53***1.84±0.59 1.59±0.29 1.32±0.57#SOD(U/mg)89.01±15.05 98.65±5.75 98.92±6.41 96.83±5.19 82.87±4.41###GSH(mg/g)0.93±0.13 1.61±0.68*1.47±0.44 2.39±0.32#2.84±0.80#
2.4 黄芪多糖与总黄酮对四环素所致小鼠肝脏病理组织学改变的作用
ICR 小鼠腹腔注射四环素后24 h 取肝脏,经10%甲醛固定,石蜡包埋,HE 染色。光镜下可见正常组小鼠肝组织结构正常,肝小叶、中央静脉、汇管区结构清晰,肝细胞索排列整齐;模型组动物肝脏的中央静脉和小叶间静脉周围出现肝细胞肿胀、水样变性、小泡性脂变等;黄芪多糖和总黄酮(500 mg/kg)可明显减轻上述肝组织损伤、坏死和小泡性脂变程度,如图1 所示,见封三彩图。
3 讨论
黄芪的主要化学成分是多糖、黄酮及皂苷。 药用历史悠久,应用广泛。 黄芪在肝脏疾病的治疗中显现出很好的疗效。 如在乙肝、肝损伤、脂肪肝和肝纤维化治疗方面,黄芪注射液及黄芪复方汤药都显示出疗效明显的保肝作用[4-8]。 但是,黄芪注射液对脂肪肝的改善作用的有效组分,以及对药物所致脂肪肝的作用和作用机制等尚不清。
本研究首先建立四环素诱导脂肪肝模型,即腹腔注射单剂量四环素(200 mg/kg)能够引起小鼠肝脏脂肪变性,表现为血清转氨酶ALT 和AST 明显升高、 血脂TG 和CHO 显著降低、 肝脏脂质TG 和CHO 聚积,以及肝细胞出现小泡性脂质聚集和水样变性,上述结果均可反映出腹腔注射四环素引起小鼠发生脂肪肝的早期变化。 以往研究表明,过量四环素造成急性肝细胞脂肪变的原因之一是:抑制微粒体甘油三酯转移蛋白(MTP)活力,阻断极低密度脂蛋白(VLDL)组装,导致脂质不能以脂蛋白的形式运送出肝脏,引起TG 和CHO 分泌减少[9-10],从而使血清TG 和CHO 下降, 而肝组织TG 和CHO 增多。而黄芪多糖可明显降低升高的血清ALT 和AST 水平,抑制血清TG 和CHO 水平的下降,并降低肝脏脂质CHO 的聚集。 而黄芪总黄酮只抑制血清ALT和肝组织CHO 水平的异常升高, 对血清AST、TG、CHO 以及肝组织TG 无明显作用。此外,黄芪多糖和总黄酮均可明显改善四环素所致肝细胞肿胀、水样变性和小泡性脂变等病理学改变。 从而提示,黄芪的这两个组分均可明显改善四环素所致小鼠肝组织脂肪变的发生,但是,黄芪总黄酮对四环素所致小鼠肝组织脂肪变性的作用明显弱于多糖的作用。此结果与以往报道黄芪多糖的作用基本一致[11],说明黄芪抗脂肪肝作用的最主要有效组分可能是多糖,其次是黄酮。
对于NAFLD 的发病机制,目前以Day[12]提出的“二次打击学说”最为著名。 第一次打击为各种原因导致的胰岛素抵抗,游离脂肪酸(FFA)增加,肝脏脂肪代谢障碍, 从而使肝细胞内合成TG 增加而输出减少,导致肝细胞脂肪变性。 第二次打击是在第一次的基础上,出现氧化应激和脂质过氧化,线粒体功能失调,呼吸链复合物活性降低等。 四环素是引起肝细胞脂肪变性的药物之一,可诱发小泡性脂肪肝。过量ROS 生成或抗氧化物的缺失会导致细胞损伤[13]。丙二醛(MDA)是肝细胞内脂质过氧化终产物,其含量可以反映脂质过氧化程度。 而SOD 和GSH是体内防御氧化损伤的重要抗氧化物。 本研究结果显示,小鼠腹腔注射四环素后肝组织脂质过氧化产物MDA 明显增多, 抗氧化物GSH 含量出现升高,可考虑为抗氧化物的升高属于代偿性,以利于自由基清除。 而黄芪多糖和总黄酮预防给药虽然没有显著地抑制MDA 增多, 但是二者预防给药均有明显升高GSH 和SOD 水平的趋势, 尤其是总黄酮可进一步显著升高肝组织GSH 水平。 由此推测,黄芪多糖和总黄酮抗四环素所致小鼠肝细胞脂肪变性的机制可能与其抗氧化作用相关。
综上所述,单剂量腹腔注射四环素可引起小鼠肝组织出现明显的脂肪变性,其发生机制与氧化应激有关。 黄芪多糖和总黄酮预防给药对四环素引起肝细胞脂肪变性均显示出不同程度的保护作用,黄芪多糖作用明显强于总黄酮,与其抗氧化作用密切相关,其作用的最主要有效组分是多糖,其次是总黄酮。 此研究将为NAFLD 的临床治疗,以及进一步开发黄芪有效组分为保肝降脂药的应用提供科学的实验依据。
致谢:本实验过程中动物饲养于北京实验动物研究中心,感谢北京实验动物研究中心对本实验的完成所提供的所有帮助!
[1]刘 蕾,张晓岚.药物性肝损伤诊断与防治进展[J].临床肝胆病杂志,2012,28(6):477-479.
[2]Kelishadi R,Poursafa P. Obesity and air pollution:global risk factors for pediatric non-alcoholic fatty liver disease [J]. Hepat Mon,2011,11(10):794-802.
[3]Yu HY,Wang BL,Zhao J,et al. Protective effect of bicyclol on tetracycline-induced fatty liver in mice [J]. Toxicology,2009,261(1):112-118.
[4]吴士杰.黄苠柴胡汤治疗慢性乙型肝炎80 例[J].陕西中医,2004,25(1):36-36.
[5]王要军,权启镇,孙百勤,等.黄芪对实验性肝纤维化组织ICAM-l表达影响的免疫化研究[J].中国临床药理学与治疗学杂志,2000,5(1):49-49.
[6]程 鹏,刘素侠,孙晋浩,等.黄芪抗肝纤维化的作用与转化生长因子βl 及干扰素γ 的关系[J].临床军医杂志,2000,28(3):22-22.
[7]阮明凤,郝君梅.黄芪对大鼠酒精性肝病肝组织ICAM-1 表达的影响[J].时珍国医国药,2007,18(5):1 119-1 120.
[8]何卫美,宋育林,方 芳,等.黄芪提取物对大鼠非酒精性脂肪性肝病SREBP-1 表达的影响[J].安徽医药,2010,14(3):273-274.
[9]Letteron P,Sutton A,Mansouri A,et al. Inhibition of microsomal triglyceride transfer protein:another mechanism for drug-induced steatosis in mice [J]. Hepatology,2003,38(1):133-140.
[10]Breen K,Schenker S,Heimberg M. The effect of tetracycline on the hepatic secretion of triglyceride [J]. Biochim Biophys Acta,1972,270(1):74-80.
[11]孙善坤.静脉滴注黄芪治疗酒精性脂肪肝150 例临床观察[J].山西医药杂志,2002,31(6):459-459.
[12]Day CP. Pathogenesis of steatohepatitis [J]. Best Pract Res Clin Gastroenterol,2002,16(5):663-678.
[13]Harrison SA,Kadakia S,Lang KA,et al. Nonalcoholic steatohepatitis:what we know in the new millennium [J]. Am J Gastroenterol,2002,97(11):2 714-2 724.

