一株泡叶藻降解菌的筛选及其发酵条件优化
刘露,公春艳,赵宏涛,王鹏,李园园
一株泡叶藻降解菌的筛选及其发酵条件优化
刘露,公春艳,赵宏涛,王鹏,李园园*
青岛明月蓝海生物科技有限公司,山东青岛266400
为了利用微生物降解泡叶藻,本研究以泡叶藻为唯一营养物质从土壤中筛选到一株对泡叶藻有明显降解效果的菌株,编号2-2。根据其形态学特征、生理生化特性和16S rDNA序列分析鉴定该菌株为巨大芽孢杆菌(Bacillus megaterium)。对菌株的发酵条件进行了优化,最优发酵培养基为:泡叶藻30 g/L、酵母粉6 g/L和葡萄糖4 g/L。摇瓶最佳培养条件为:250 mL三角瓶装液量50 mL,起始pH 7.5,发酵温度32℃,发酵48 h有效活菌数为2.4×109CFU/mL。并对发酵液酶活进行了测定,其中纤维素酶活为47.7 U/mL,蛋白酶活为3.4 U/mL,海藻胶裂解酶活为0.721 U/mL。研究结果表明巨大芽孢杆菌2-2同时具有海藻胶裂解酶、蛋白酶和纤维素酶活性,具有良好的应用前景。
泡叶藻降解菌;巨大芽孢杆菌;海藻胶裂解酶;发酵条件
我国海洋资源丰富,海藻加工及其高值化利用成为我国海洋资源综合利用的重要领域。海藻生长在海洋的环境中,造就了海藻细胞的结构及其化学组成不同于陆地植物。海藻富含糖、蛋白质、脂肪、无机盐、各种维生素和微量元素[1]。海藻具有促进早期种子萌发与成苗、改善作物形态与产量、提高作物的抗性和延长采收后易腐产品贮存期的作用。海藻除了具有促进作物生长的特性外,还会影响土壤物理、化学和生物特性,进而影响作物的生长[2]。泡叶藻是泡叶藻属的一种海藻,是比较好的生产海藻肥的原料。
泡叶藻降解的方法有化学法、物理法和生物发酵法。目前最常用的方法是化学提取法,但采用化学提取法最大的劣势在于强碱高温会破坏海藻内源物质的活性。生物发酵法是利用微生物在以海藻等为养分的代谢过程中产生的多种酶,将构成海藻的大分子物质降解成小分子、水溶性的物质,最大限度完整地保留了海藻中的生物活性物质和营养物质。以生物降解取代传统的化学降解已成趋势,因此海藻的微生物降解有着深远的理论意义和应用价值。
自1968年Kaiser[3]等首次报道分离自梭菌Clostridium alginolyticum的胞外褐藻胶裂解酶以来,对褐藻胶裂解酶的研究取得了长足的发展。目前,关于生物法海藻降解的研究一般是集中于海藻胶分解菌的筛选、鉴定和海藻胶裂解酶的克隆与表达。能够降解海藻胶的菌株有很多,主要有黄杆菌(Flavobacterium multivolum)[4]、弧菌(Vibrio sp.)[5]、白蚁菌属(Isoptericola)[6]、假单胞菌(Pseudomonalginovora)[7]和芽孢杆菌(Bacillus circulans)[8]等。泡叶藻内除含有海藻胶外,还有糖、蛋白质、脂肪、无机盐等组分,然而对泡叶藻的生物降解的研究却很少。
本研究筛选出一株降解泡叶藻的细菌,根据其形态学特征、生理生化特性和16S rDNA序列分析对其进行鉴定,并对发酵条件进行优化,同时研究发酵液中纤维素酶、蛋白酶和海藻胶裂解酶的酶活。
1 材料与方法
1.1材料
1.1.1 样品来源土样:采自青岛胶南蔬菜大棚。
1.1.2 培养基富集培养基与初筛培养基:泡叶藻10 g,琼脂15 g,水1 L,pH 7.0;复筛培养基:泡叶藻10 g,水1 L,pH 7.0;种子培养基:泡叶藻5 g,酵母粉5 g,葡萄糖5 g,水1 L,pH 7.0;发酵培养基:泡叶藻10 g,水1 L,pH 7.0。
1.2泡叶藻降解菌株的筛选
将连续富集3代的培养液用无菌水按照10-3到10-5进行梯度稀释,吸取0.1 mL的稀释液涂布到初筛培养基平板上。32℃恒温培养72 h后,观察菌落形态,选取生长良好的菌株进行划线纯化。
1.3菌株2-2的鉴定
1.3.1 形态学特征与生理生化特征鉴定将菌株2-2涂布于初筛培养基平板上,32℃培养48 h,观察细胞形态和菌落特征,部分生理生化鉴定参照《伯杰细菌鉴定手册》[9]。
1.3.2 16S rDNA鉴定基因组总DNA提取后,利用正向引物AGAGTTTGATCCTGGCTCAG和反向引物ACGGCTACCTTGTTACGACT进行16S rDNA全序列扩增,PCR产物进行1%琼脂糖凝胶电泳,检测扩增效果。将克隆后的样品送至华大基因进行测序。
将所得序列与GenBank数据库中序列进行Blast分析比对,并选取相似性较高的菌株,利用Mega 4.0软件采取Neighbor Joining法构建系统进化树。
1.4酶活力的测定
1.4.1 纤维素酶活的测定采用DNS法测定纤维素酶活,发酵液3000 r/min离心10 min,离心后的上清液即为粗酶液。取3支大试管,1支作为空白对照,其余2支作为平行样品管。样品管中加1.0 mL原样酶液,然后3支试管中分别加入4.0 mL已预热至60℃的CMC缓冲液,在60℃水浴锅中反应20 min取出,每管立即加入3.0 mL DNS显色液,摇匀后在对照管中再加入1.0 mL原样酶液。将3支试管放入沸水浴中,显色5 min后立即取出,流水冷却,用分光光度计于490 nm处测其OD值。根据葡萄糖标准曲线计算出产生的葡萄糖量。
酶活力单位:1 mL原样酶液,1 min产生1 μg葡萄糖定义为1个酶活力单位(U)。
U=k×(m1-m0)/20,其中k表示样品稀释倍数;m1表示样品葡萄糖量,单位μg;m0表示对照葡萄糖量,单位μg;20表示酶与底物反应时间,单位min。
1.4.2 蛋白酶活的测定酶活力单位:1 g固体酶粉(或1 mL液体酶),在一定温度和pH条件下,1 min水解酪素产生1 μg酪氨酸为1个酶活力单位。
L-酪氨酸标准曲线及酶活测定方法参照QB/T 1803-1993[10]。
1.4.3 海藻胶裂解酶活的测定酶活测定方法参照Preiss方法[11]。取0.9 mL 3g/L海藻酸钠(3 g海藻酸钠溶于1L 100 mmol/L pH6.0磷酸盐缓冲液),加入0.1 mL酶液,40℃保温15 min,以灭活酶液(100℃5 min)作空白,测定反应体系在235 nm的光吸收值。酶活力单位(U)定义为:在以上条件下,使每分钟光吸收值增加0.1的酶量为1个酶活力单位。
1.5发酵条件优化
1.5.1 碳源对菌株发酵的影响发酵培养基中添加10 g/L泡叶藻,另外分别添加5 g/L葡萄糖、麦芽糖、蔗糖、果糖、可溶性淀粉和玉米淀粉,初始初始pH 7.0,32℃摇瓶发酵培养,48 h后测定发酵液中的活菌数量以确定最佳碳源。
1.5.2 氮源对菌株发酵的影响发酵培养基中添加10 g/L泡叶藻,5 g/L葡萄糖,另外分别添加5 g/L酵母粉、牛肉膏、硫酸铵、蛋白胨和尿素,初始初始pH 7.0,32℃摇瓶发酵培养,48 h后测定发酵液中的活菌数量以确定最佳氮源。
1.5.3 泡叶藻添加量对菌株发酵的影响泡叶藻含量分别为0 g/L、10 g/L、20 g/L、30 g/L、40 g/L和50 g/L,另外加入5 g/L葡萄糖和5 g/L酵母粉,初始初始pH 7.0,温度32℃,装液量为250 mL三角瓶装50 mL培养基,发酵时间48 h。
1.5.4 初始pH对菌株2-2的影响分别选择初始pH 5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5和9.0,其他发酵条件为:温度32℃,装液量为250 mL三角瓶装50 mL培养基,发酵时间48 h。
1.5.5 发酵温度对菌株2-2的影响发酵温度选择27℃、29℃、31℃、32℃、33℃、35℃和37℃,初始pH 7.0.装液量为250 mL三角瓶装50 mL培养基,发酵时间48 h。
1.5.6 装液量对菌株2-2的影响在250 mL三角瓶中装液量分别为25、50、75、100和125 mL,发酵温度为32℃,初始pH 7.0,发酵时间48 h。
2 结果与分析
2.1菌株分离筛选
通过富集培养,从土壤中筛选出5株能在以1%泡叶藻为唯一营养物质的平板上快速生长的菌株,挑取单菌落进行摇瓶复筛,对生长速度及菌数进行比较。结果表明,菌株2-2在1%泡叶藻培养基中生长稳定且菌数较高。如图1所示,1%泡叶藻液体培养基中,培养40 h后泡叶藻细胞细胞壁被降解,故选择2-2作为下一步研究的菌株。

图1 泡叶藻降解前后变化Fig.1 Change of Ascophyllum nodosum degradated by strain 2-2
2.2菌株2-2鉴定
2.2.1 形态学特征菌株2-2在初筛平板上培养48 h后,菌落呈圆形,乳白色,不透明,边缘整齐,表面光滑湿润,隆起。菌株2-2为杆状,链状生长,有芽孢,芽孢端生,无鞭毛,革兰氏染色阳性。
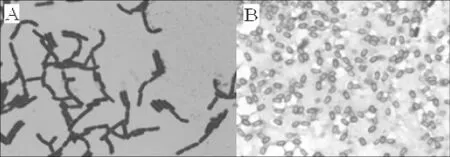
图2 菌株2-2的光学显微镜图Fig.2 The morphology of strain 2-2 under light microscope
2.2.2生理生化特性菌株2-2的生理生化结果如表1所示。

表1 菌株2-2的主要生理生化特征Table 1 The main physiological and chemical characteristics of strain 2-2
2.2.3 16S rDNA基因序列及系统发育树分析测序得到菌株2-2的16S rDNA基因序列含有1396 bp。系统发育树表明(图3),菌株2-2与巨大芽孢杆菌(Bacillus megaterium)亲缘关系最近。同时结合菌株的形态学特征和生理生化特性,将其归类为芽孢杆菌属,巨大芽孢杆菌。
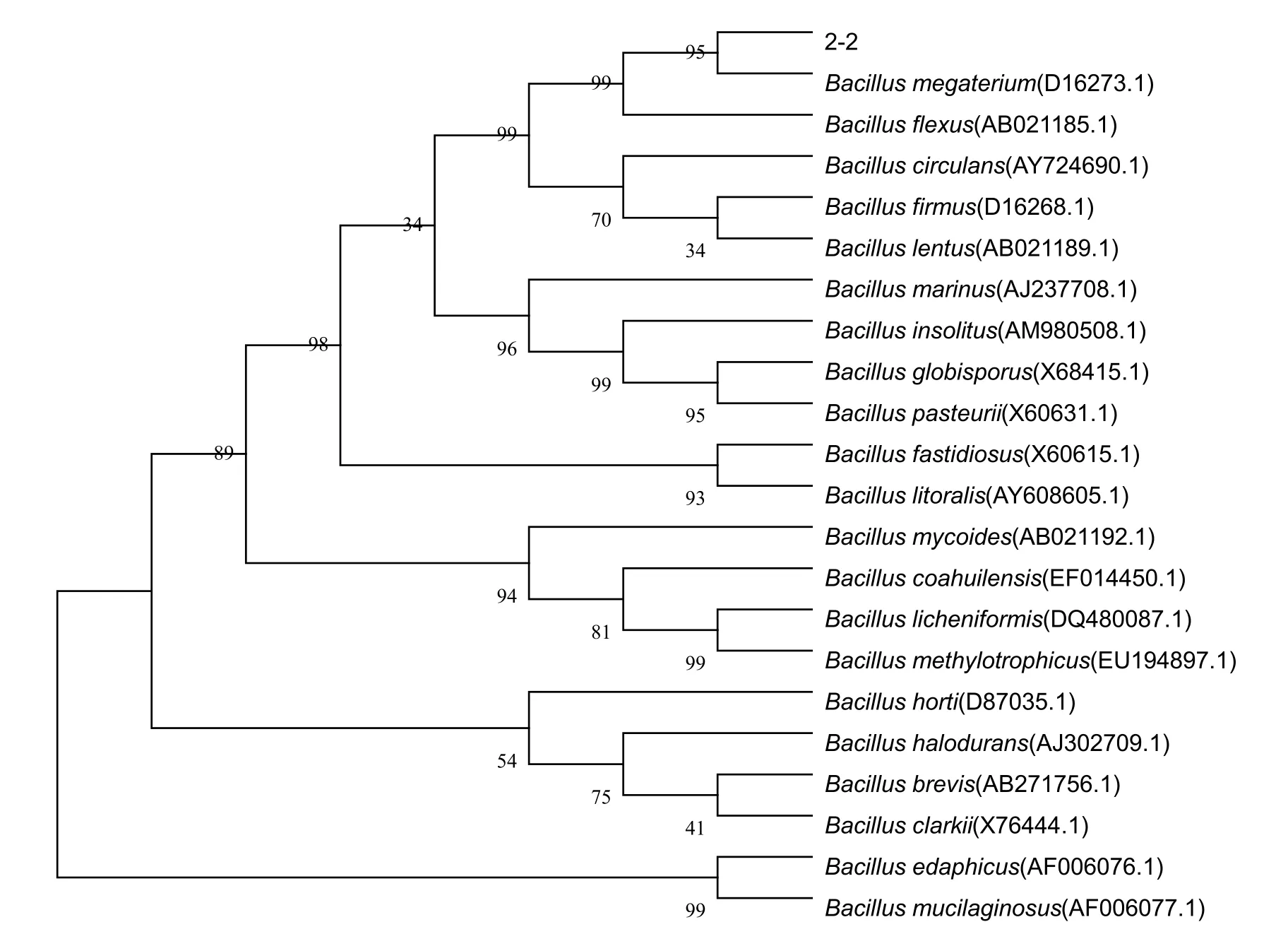
图3 菌株2-2与相关菌株的系统发育树Fig.3 The phylogenetic tree of strain 2-2
2.3发酵条件优化
2.3.1 碳源对菌株发酵的影响主要研究了不同碳源对菌株发酵的影响,研究表明,碳源选用葡萄糖时,菌数最高,在此基础上,进一步研究了不同浓度的葡萄糖对菌株产酶的影响,当葡萄糖浓度为4 g/L时,纤维素酶和海藻胶裂解酶的酶活最高,过多的葡萄糖会使菌数增加,但不利于诱导酶的分泌。

图4 不同碳源对菌株发酵的影响Fig.4 Effect of different carbon sources on the number of fermentation broth
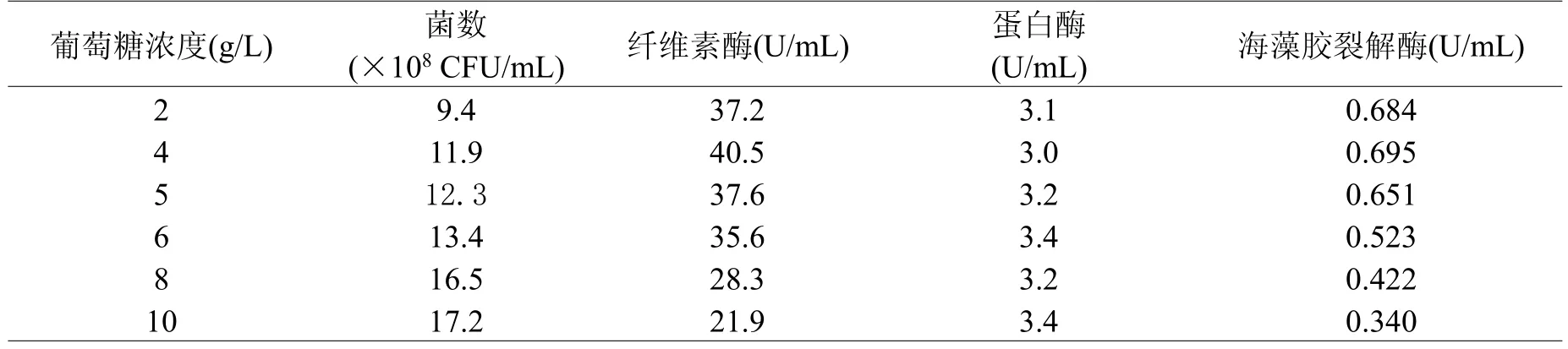
表2 葡糖糖浓度对菌数和酶活的影响Table 2 Effect of different concentration of glucose on the number of fermentation broth and enzyme activity
2.3.2 氮源对菌株发酵的影响氮源是微生物生长和代谢所需营养物质的重要来源,也是构成酶的重要成分。本文除添加泡叶藻和碳源外,选取无机氮源和有机氮源进行比较。结果显示,选用酵母粉为氮源时,菌株菌数最高。进一步研究了不同浓度的酵母粉对菌株产酶的影响,当酵母粉浓度为6 g/L时,蛋白酶和海藻胶裂解酶的酶活最高,过多的酵母粉会使菌数增加,但不利于蛋白酶和海藻胶裂解酶的分泌。

图5 不同氮源对菌株发酵的影响Fig.5 Effect of different nitrogen sources on the number of fermentation broth

表3 酵母粉浓度对菌数和酶活的影响Table 3 Effect of different concentration of yeast extract on fermentation and enzyme activity
2.3.3 泡叶藻添加量对菌株发酵的影响泡叶藻含量分别为0 g/L、10 g/L、20 g/L、30 g/L、40 g/L和50 g/L,另外加入5 g/L葡萄糖和5 g/L酵母粉,发酵48 h后,已完全产生芽孢。菌数如图所示。在泡叶藻添加量为30 g/L时,菌数最高,生长状况最好。
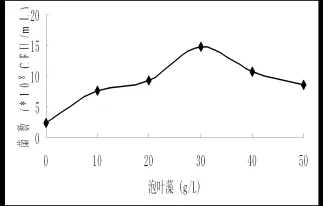
图6 泡叶藻添加量对菌株发酵的影响Fig.6 Effect of different concentration of ascophyllum nodosum on the number of fermentation broth

图7 pH对菌株发酵的影响Fig.7 Effect of different pH on the number of fermentation broth
2.3.4 初始pH对菌株2-2的影响培养基初始pH直接影响着菌体细胞的通透性、稳定性以及代谢产物酶系的活性,而且通过影响培养基中营养物质的离子化程度,间接影响着微生物对营养物质的吸收。研究显示,菌株2-2生长、产酶最适pH为7.5,这与海藻胶裂解酶的适宜pH均为6-8相一致[12]。
2.3.5 发酵温度对菌株2-2的影响菌体细胞的生长及酶的合成是由一系列严格有序的生化反应组成,而生化反应受温度影响较大,所以温度对菌体细胞的生长和产酶具有显著的影响。将菌株在不同温度下进行发酵培养,结果显示,菌株2-2的最佳培养温度是32℃。

图8 温度对菌株发酵的影响Fig.8 Effect of different fermentation temperature on the number of fermentation broth
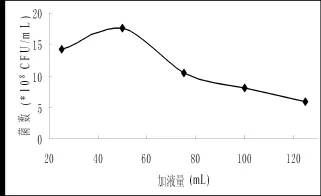
图9 加液量对菌株发酵的影响Fig.9 Effect of different liquid volume on the number of fermentation broth
2.3.6 装液量对菌株2-2的影响装液量是制约菌种生长及产酶的一个重要因素。装液量过少,水分易挥发,过大则溶氧降低,影响菌体生长,导致产酶下降。于在250 mL三角瓶中分别加入25、50、75、100、125 mL发酵培养基,研究装液量对菌株2-2的影响,实验结果表明,装液量为50 mL时,菌体生长状况最好。
2.4酶活力测定
泡叶藻内含有39.8~45%的海藻胶和其他碳水化合物、6~7%的纤维素和5~6%的蛋白质,故本研究通过测定发酵液的海藻胶裂解酶、纤维素酶和蛋白酶的酶活作为衡量菌株活性的标准。
初始发酵培养基泡叶藻10 g/L,pH 7.0,32℃培养时,48 h后,菌数为8.2×107CFU/mL纤维素酶活为12 U/mL,蛋白酶活为0.4 U/mL,海藻胶裂解酶活为0.0047 U/mL。调节发酵配方后,泡叶藻30 g/L,葡萄糖4 g/L,酵母粉6 g/L,pH 7.5,48 h后,菌数为2.4×109CFU/mL,纤维素酶活为47.7 U/mL,蛋白酶活为3.4 U/mL,海藻胶裂解酶活为0.721 U/mL,酶活均有明显提高。
3 讨论
本研究以泡叶藻为唯一营养物质,从土样中筛选出一株能降解泡叶藻的菌株2-2,泡叶藻组织经菌株2-2发酵降解后有明显的变化,细胞壁破裂。通过形态特征,生理生化特征及16s rDNA序列分析对菌株2-2进行种属鉴定,将其鉴定为巨大芽孢杆菌。
目前关于海藻降解的研究一般是集中于海藻胶的降解,如詹冬梅等[13]、刘玉佩等[14]和汤海青等[15]通过以海藻酸钠为唯一碳源筛选出具有海藻胶裂解酶活性的菌株,本研究以泡叶藻匀浆为唯一营养物质,泡叶藻内含有菌株生长所需要的碳源、氮源及无机盐,筛选出的菌具有海藻胶裂解酶活性,同用Preiss方法检测海藻胶裂解酶活性,菌株2-2的酶活性与以上筛选出的酶活性相当。此外菌株2-2还具有纤维素酶活性和蛋白质酶活,纤维素酶活性比沈雪亮[16]、李振红等[17]筛选的纤维素降解菌的酶活稍高。蛋白酶活与已报道的高产酶菌株酶活力还有一定的差距[18-19],可以通过诱变育种等手段进行改造,提高蛋白酶活。菌株2-2有海藻胶裂解酶活、纤维素酶活和蛋白酶活,这为降解泡叶藻奠定了基础。
菌株2-2为巨大芽孢杆菌,但未见该种具有海藻胶裂解酶活性的报道。说明本研究分离到了比较新颖的资源菌株。另外,有关巨大芽孢杆菌研究内容包括污水处理、农药降解、生物堆肥、微生物肥料等,近年来关于巨大芽孢杆菌用于土壤解磷的研究日益增多[20-21]。本研究中筛选到的巨大芽孢杆菌是否土壤解磷的功效,有待进一步的研究。
研究表明,菌株2-2可以通过发酵降解泡叶藻,以海藻为养分的代谢过程中产生多种酶,最大限度的保证了海藻内的生物活性物质和营养物质。在作为海藻肥料时,将具有良好的应用前景。目前对生物法降解海藻的研究还处于试验阶段,发酵工艺及生物法降解的海藻肥料的应用效果需进行深入研究,为大工业生产及产业化应用奠定基础。
[1]汪家铭.绿色有机肥海藻肥生产应用及发展建议[J].化工管理,2010(10):46-52
[2]周二峰,宋秀红,胡国强,等.天然有机海藻肥的功效及应用前景[J].安徽农业科学,2007,35(9):2671-2671
[3]Kaiser P,Leborgne L,Hardisso C,et al.An exocellular alginate-lyase isolated from Clostridium alginolyticum cultures[J].Comptes Rendus Hebdomadaires Des Seances De LAcademie Des Sciences Serie D,1968,267(3):376-379
[4]Takeuchi T,Murata K,Kusakabe I.A method for depolymerization of alginate using the enzyme system of Flavobacterium multivolum[J].Journal of the Japanese Society for Food Science and Technology,1994,41(7):505-511
[5]Tseng C H,Yamaguchi K,Kitamikado M.Two types of alginate lyase from a marine bacteriumVibrio sp.AL-9[J]. Bulletin of the Japanese Society of Scientific Fisheries,1992,58(4):743-749
[6]魏丹,窦文芳,李恒,等.高效降解褐藻胶新菌种的筛选,鉴定及产酶条件优化[J].食品与发酵工业,2012,38(7):26-31
[7]张瑾,赵玉然,梁君妮,等.海洋假单胞杆菌褐藻胶裂解酶基因在大肠杆菌中的高效表达和活性检测[J].食品与发酵工业,2007,33(2):5-9
[8]Hansen J B,Doubet R S,Ram J.Alginase enzyme production byBacillus circulans[J].Applied and environmental microbiology,1984,47(4):704-709
[9]布坎南,吉本斯.伯杰细菌鉴定手册[M].北京:科学出版社,1984:729-759
[10]中华人民共和国轻工业部.工业酶制剂通用试验方法(QB/T 1803-1993)[S].北京:中国轻工业出版社,1994:1-19
[11]Preiss J.Bacterial alginate lyase[J].Methods in Enzymology,1966(8):641-644
[12]李丽妍,管华诗,江晓路,等.海藻工具酶——褐藻胶裂解酶研究进展[J].生物工程学报,2011,27(6):838-845
[13]詹冬梅,邱兆星,李翘楚.大型海藻的细菌降解试验[J].齐鲁渔业,2007,24(8):50-52
[14]刘玉佩,汪立平,赵勇,等.解淀粉芽孢杆菌产褐藻胶裂解酶的发酵条件优化[J].湖南农业科学,2010(3):17-20
[15]汤海青,欧昌荣,郑晓冬.1株产褐藻胶裂解酶海洋细菌的分离鉴定及其酶学性质[J].浙江大学学报(农业与生命科学版),2013,39(4):387-395
[16]沈雪亮,夏黎明.产纤维素酶细菌的筛选及酶学特性研究[J].林产化学与工业,2002,22(1):47-51
[17]李振红,陆贻通.高效纤维素降解菌的筛选[J].环境污染与防治,2003,25(3):133-135
[18]张士伟,黄建飞,罗立新.枯草芽孢杆菌产蛋白酶发酵培养基的优化[J].中国酿造,2013,32(2):20-24
[19]孙佑赫,周开艳,熊智.松毛虫肠道产蛋白酶菌株的筛选鉴定及培养条件研究[J].中国农学通报,2012,28(14):18-21
[20]Vary P S,Biedendieck R,Fuerch T,et al.Bacillus megaterium-from simple soil bacterium to industrial protein production host[J].Applied microbiology and biotechnology,2007,76(5):957-967
[21]郭德军,李岩松,王欣,等.巨大芽孢杆菌表达系统的特点及其研究进展[J].生物技术,2010,20(6):92-95
Isolation and Fermentation Optimization of anAscophyllum Nodosum Degrading Strain
LIU Lu,GONG Chun-yan,ZHAO Hong-tao,WANG Peng,LI Yuan-yuan*
Qingdao Mingyue BlueOcean Bio-technology Co.Ltd.,Qingdao 266400,China
To study ascophyllum nodosum degradated by microorganism,a high efficient microorganism was isolated from soil using ascophyllum nodosum as the sole nutrient.Based on the morphological,physiological characteristics and 16S rDNA sequence,the strain was identified asBacillus megaterium.The optimized fermentation medium was composed of ascophyllum nodosum 30 g/L,yeast extract 6 g/L and glucose 4 g/L.The optimal culture condition was that the strain was cultured in 250 mL shake flakes containing 25 mL medium with initial pH 7.5 at 32℃.After 48 h fermentation,the effective number of viable cells was 2.4×109CFU/mL,the activity of cellulose was 47.7 U/mL,the activity of protease was 3.4 U/mL, and the activity of alginate lyase was 0.721 U/mL.Possessing the activity of alginate lyase,cellulose and protease,Bacillus megaterium2-2 was conferred extensive potential applications.
Ascophyllum nodosum degrading bacteria;Bacillus megaterium;alginate lyase;fermentation optimization
Q936
A
1000-2324(2014)04-0515-07
2013-02-22
2013-04-14
刘露(1987-),女,山东济南人,工学硕士.研究方向:从事海洋功能性农用生物制品开发.E-mail:myhzfliulu@126.com
*通讯作者:Author for correspondence.E-mail:myhzflyy@126.com

