慢病毒介导的解整合素-金属蛋白酶17 RNA干扰对气道上皮细胞MMP-9表达及NF-κB活性的影响
严建平,李亚清,钟 晖,陈 淳,顾 超
肺组织弹性物质的降解是慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)特征性的病理表现[1],也是导致COPD患者进行性气流受限的重要原因。蛋白酶-抗蛋白酶失衡在这一过程中发挥着重要作用。基质金属蛋白酶-9(matrix metalloproteinase,MMP-9)是基质金属蛋白酶(MMPs)超家族成员之一。活化的MMP-9可作用于弹性蛋白及IV型胶原等,引起细胞外基质损伤。MMP-9在COPD患者血清中的表达明显升高,且与气流受限和疾病进展相关[2]。Foronjy等[3]通过转基因小鼠实验研究表明MMP-9的过表达和酶活性增加可导致肺泡弹性物质的丢失、胶原含量减少,使肺组织发生肺气肿样改变。但其表达调控机制仍有待于研究。解整合素-金属蛋白酶(a disintegrin and metalloproteinase,ADAM)17属于ADAM蛋白酶家族成员之一,在与一系列生理、病理活动有关的关键因子的细胞外域分离(shedding)过程中起着重要作用,被称为“信号系统剪刀”。肿瘤坏死因子(tumor necrosis factor,TNF)-α是一种具有广泛生物学活性的细胞因子,在机体细胞免疫应答、炎症反应及细胞死亡或生存等过程中起着重要作用。Wright等[4]研究表明香烟烟雾可通过 TNF-α信号通路上调肺血管MMP-9、MMP-2、MMP-12的表达。pro-TNF-α是可溶型TNF-α的前体,通过其胞外域水解脱落形成可溶型TNF-α,ADAM17在这一过程中起着重要作用。因此,我们推测ADAM17可能通过调控TNF-α信号转导在调节MMP-9表达中发挥作用。
RNAi(RNA interference)技术是一种新兴的由外源性或细胞内源性的双链RNA介导的转录后基因沉默技术,已在基因功能、发育生物学和基因治疗等研究有了广泛的应用[5]。慢病毒载体介导的RNAi不但可以感染非分裂期细胞,还具有容纳外源性目的基因片段大、目的基因能长期稳定表达、免疫反应小等优点。因此,本课题通过构建ADAM17 siRNA慢病毒表达载体,探讨ADAM17 RNAi对脂多糖(LPS)诱导的 HBE4-E6/E7细胞 MMP-9表达的影响,并进一步研究 TNF-α/核因子-κB(nuclear factor kappa B,NF-κB)信号通路在其中的作用,为治疗COPD提供新的研究靶点。
1 材料
1.1 细胞株 正常人气道上皮细胞系HBE4-E6/E7购自美国ATCC公司,293T细胞系购自上海中科院细胞库。
1.2 试剂和仪器 慢病毒包装系统 pLVTHM、pRsv-REV、pMDlg-pRRE和pMD2G-VSVG购自Trono(University of Geneva,Switzerland).ClaI,MluI,XbaI和 EcoRI购自 TaKaRa(Otsu,Shiga,Japan)。AxyPrep质粒小剂量制备试剂盒购自Axygen公司。脂质体Lipofectamine 2000和大肠杆菌菌株DH5α购自Invitrogen(Carlsbad,CA,USA)。胎牛血清购自美国Gibco公司。RNAex购自上海华舜公司。MMLV逆转录酶、RNasin购自 Promega(Madison,WI,USA)。SYBR Master Mixture购自 Toyobo公司。Taq DNA聚合酶购自北京天为时代公司。LPS(来源于E.coli 0111∶B4)、DMEM培养液、吡咯烷二硫代氨基甲酸盐(pyrrolidine dithiocarbamate,PDTC)、明胶购自美国Sigma公司。Etanercept购自美国Immunex公司。兔抗人MMP-9单克隆抗体购自Cell Signaling Technology公司。NE-PER细胞核和细胞质蛋白质提取试剂盒以及LightShiftTMChemiluminescent EMSA试剂盒购自美国Pierce公司。二氧化碳培养箱为美国Thermo公司,倒置相差显微镜为日本OLYMPUS公司。
2 方法
2.1 ADAM17 siRNA设计、质粒载体构建及慢病毒包装 根据人ADAM17 mRNA序列(Genebank number:NM_003183)选择位于2021-2041之间的特殊序列 5′-CCTATGTCGATGCTGAACAAA-3′为干扰靶序列。含干扰靶序列的DNA寡核苷酸由上海生物工程有限公司化学合成。并经过退火,以ClaI和MluI双酶切,在 T4 DNA连接酶的作用下插入pLVTHM表达载体。制备DH5α大肠杆菌感受态细胞,转化,挑选阳性克隆,通过限制酶切和DNA直接测序鉴定。取对数生长期的293T细胞,调整细胞密度为0.5×109cells·L-1。取20μg重组 pLVTHM载体,10μg pMD2G-VSVG,10μg pMDlg-pRRE和10μg pRsv-REV加入无菌水定容至1 800μl,再加入 CaCl2(2.5 mol·L-1)溶液 200μl,混匀,加入 2×BBS缓冲盐溶液2 000μl,室温放置30 min形成转染复合物。当293T细胞密度达60%~70%时,将转染复合物和磷酸钙混合液转移至含单层细胞的培养液中,混匀,培养12 h后弃去培养液,PBS反复冲洗3次。加入细胞培养液培养72 h;收集上清液,4℃、4 000 r· min-1离心 10 min,0.45μm滤器过滤上清液,离心后于-80℃冰箱保存。以慢病毒浓缩液感染293T细胞,采用倍比稀释法和流式细胞术(FACS)检测病毒滴度。
2.2 细胞培养与分组 HBE4-E6/E7细胞复苏后用含10% 胎牛血清、105U·L-1青霉素、100 mg·L-1链霉素DMEM培养液混悬细胞,充分混匀,在37℃、5%CO2条件下培养2.5 h后,消化、收集细胞,用含10%胎牛血清的DMEM培养液混悬细胞,调整细胞浓度约为1×109cells·L-1,进一步培养。在细胞信号转导实验中,将HBE4-E6/E7细胞分成4组:第 3、4组分别以 1 mg·L-1etanercept(A recombinant human TNFR p75-Fc fusion protein)(Enbrel,Immunex,Seattle)、50 mg·L-1PDTC预处理30 min;接着第2、3、4组分别加入终浓度为100μg·L-1LPS刺激24 h,第1组未用 LPS刺激。在RNAi干扰实验中,一方面将HBE4-E6/E7细胞分成4组:第1组为空白对照组;第2组为LPS刺激组;第3组以LV-NC-siRNA慢病毒以MOI 15感染HBE4-E6/E7细胞72 h,第4组以 LV-ADAM17-siRNA慢病毒以MOI 15感染HBE4-E6/E7细胞72 h,接着第3、4组以100μg·L-1LPS刺激24 h。另一方面将A549细胞分成4组:第1组为空白对照组;第2组为TNF-α刺激组;第3组以LV-ADAM17-siRNA慢病毒以MOI 15感染HBE4-E6/E7细胞72 h,接着以1 mg·L-1TNF-α刺激24 h;第4组以50 mg·L-1PDTC预处理 HBE4-E6/E7细胞30 min,接着以1 mg·L-1TNF-α刺激24 h。分别收集各组细胞及细胞上清液,-80℃冰箱保存、备测。
2.3 逆转录-聚合酶链反应 以TRIzol提出总RNA。按MMLV逆转录酶试剂盒说明合成cDNA:将2μg RNA与2μl Oligo(dT)15(0.5 g·L-1)混合,补充DEPC处理的无菌水至总体积为12μl,离心,70℃温育5 min,迅速置冰上,分别加入5×buffer 5μl,RNase(40 U·μl-1)0.6μl,dNTP(10 mmol·L-1)1.25μl,MMLV(200 U·μl-1)1μl,补充DEPC处理的超纯水至总体积为25μl,离心,37℃温育1h,95℃5 min以灭活逆转录酶。根据目的基因分别加入:10×buffer 2.5μl,MgCl2(25 mmol·L-1)2.0μl,dNTP(10 mmol·L-1)1.0μl,上游引物(10μmol·L-1)1.0μl,下游引物(10μmol·L-1)1.0μl,逆转录产物 2.5μl,Taq酶 0.5μl,补充无菌去离子水至总体积为25μl,离心混匀,95℃预变性5 min,然后完成35个循环,PCR产物于1.5%琼脂糖凝胶电泳,用UVP-GDS8000凝胶成像分析系统进行拍照、图像灰度分析,将目的基因扩增片段灰度值与内参照β-actin扩增片段灰度值的比值作为目的基因mRNA表达的定量指标。引物见Tab 1,由北京奥科生物科技公司设计和合成:MMP-9(Genebank:NM_004994)引物,上游 5′-TTGACAGCGACAAGAAGTGG-3′; 下 游 5′-GGCACAGTAGTGGCCGTAG-3′,产物 388bp。β-actin上游 5′-GGCACCACACCTTCTACAATGA-3′;下 游 5′-TCAGGAGGAGCAGCAATGATCTTG-3′,产物 745 bp。
Tab 1 Primer sequences and reaction conditions used for reverse transcriptase polymerase chain reaction
2.4 酶联免疫吸附试验 收集各组细胞上清液,2 000 r·min-1离心5 min,弃去沉淀,以 ELISA法检测细胞上清液中的TNF-α浓度。根据TNF-αELISA试剂盒说明书进行操作,主要步骤如下:每孔加入100μl稀释液 RD1-85。分别加入50μl标准品、对照品或待测样品。室温温育2 h后吸干,反复洗涤4次。每孔加入100μl TNF-α结合物,室温温育1 h。吸干,洗涤4次。每孔加入200μl底物溶液,避光室温温育30 min。每孔加入50μl终止液终止反应,30 min内在450 nm测定其吸光值。
2.5 Western blot 将各组含20μg蛋白的上清液在100℃沸水中变性5 min,分别上样于8%SDSPAGE加样孔中,电泳。当溴酚蓝染液移至胶底边时,取下凝胶,4℃、350 mA电转移1 h,将蛋白转至硝酸纤维膜上。接着将硝酸纤维素膜置于TBS-T(TBS、5%脱脂奶粉、0.1%Tween)中室温孵育1 h。然后将硝酸纤维素膜在以1∶2 500稀释的兔抗人MMP-9单克隆抗体中室温孵育1 h。TBS-T洗膜5次后,将硝酸纤维素膜在以1∶40 000稀释的辣根酶标记山羊抗兔IgG(H+L)中室温孵育1 h。TBST洗膜5次后以增强化学发光法(enhanced chemiluminescence solution,ECL)显影。用 UVP-GDS8000凝胶成像分析系统进行扫描摄像、图像灰度分析。
2.6 凝胶阻滞分析实验 用NE-PER细胞核和细胞质蛋白质提出试剂盒提出细胞核蛋白,按试剂盒说明操作。由北京奥科生物科技公司设计、合成NF-κB双链寡核甘酸探针。生物素标记NF-κB探针序列,x代表生物素:5′-xGCCTGGGAAAGTCCCCTCAACT-3′(a),5′-xAGTTGAGGGGACTTTCCCAGGC-3′(b)。未用生物素标记 NF-κB探针序列:5′-GCCTGGGAAAGTCCCCTCAACT-3′(a),5′-AGTTGAGGGGACTTTCCCAGGC-3′(b)。以 Light-ShiftTMChemiluminescent EMSA试剂盒检测 NF-κB活性,步骤如下:制备5% 非变性聚丙烯酰胺凝胶,100 V预电泳30 min,室温孵育含50μg·L-1Poly(dI·dC)、0.05%NP-40、50 mmol·L-1KCl、5 mmol·L-1MgCl2、10 mmol·L-1EDTA的结合反应体系20 min后,加入5μl的5×loading buffer,混匀后取20μl结合反应体系上样,100 V电泳,接着以380 mA(~100V)电转移1 h,使结合反应体系至尼龙膜上。将膜置于干燥的纸上(有溴酚兰面朝上)1 min,迅速用254 nm紫外灯距离膜0.5 cm处紫外交联10 min。以ECL方法显影,用UVP-GDS8000凝胶成像分析系统扫描、分析条带,根据其灰度值分析NF-κB活性。
2.7 统计学方法 采用SPSS 11.5统计软件包进行统计学分析,实验数据以¯x±s表示,统计学分析采用配对t检验和单因素方差分析(组间差异用F检验,组间两两比较用q检验)。
3 结果
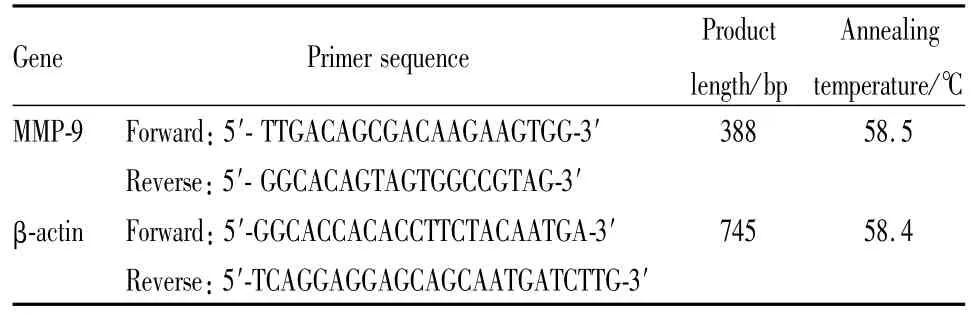
3.1 Etanercept和 PDTC对 LPS诱导的 HBE4-E6/E7细胞MMP-9的表达及NF-κB活性的影响在LPS刺激下,HBE4-E6/E7细胞中MMP-9 mRNA和蛋白表达明显增加(P<0.05),见Fig 1;NF-κB的活性在LPS刺激下亦明显增加(P<0.05),见Fig 2。Etanercept和 PDTC明显抑制 LPS诱导的MMP-9 mRNA和蛋白的表达(P<0.05),见 Fig 1;Etanercept和PDTC亦明显抑制LPS诱导的NF-κB的活性(P<0.05),见 Fig 2。
3.2 慢病毒介导的ADAM17 RNAi对LPS诱导的MMP-9表达及NF-κB活性的影响 慢病毒介导的ADAM17 RNAi可明显降低HBE4-E6/E7细胞上清液中 TNF-α蛋白水平(P<0.05),见 Fig 3,并明显抑制LPS诱导的MMP-9 mRNA和蛋白表达(P<0.05),见Fig 4;当以 LV-ADAM17-siRNA重组慢病毒感染HBE4-E6/E7细胞72 h,再以LPS刺激24 h,LPS诱导的 NF-κB的活性明显下降(P<0.05),见Fig 5。而当以 LV-NC-siRNA重组慢病毒感染HBE4-E6/E7细胞72 h后再以 LPS刺激24 h,和仅以LPS刺激组比较,LPS诱导的MMP-9 mRNA和蛋白表达及NF-κB的活性均无明显变化(P>0.05),见 Fig 4,5。
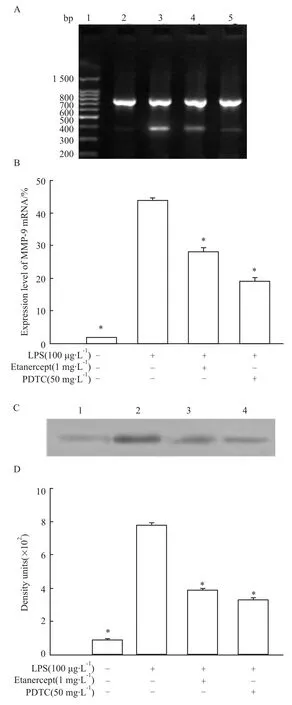
Fig 1 Effects of Etanercept and PDTC on MMP-9 mRNA(A and B)and protein(C and D)expressions induced by lipopolysaccharide(n=6)
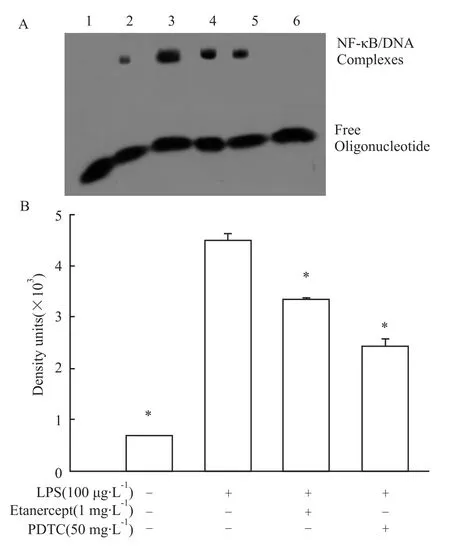
Fig 2 Effects of etanercept and PDTC on NF-κB activity induced by lipopolysaccharide(n=4)
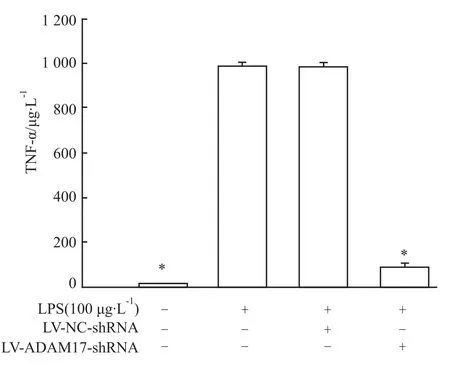
Fig 3 Effects of ADAM17 RNAi on TNF-αexpression of airway epithelial cells induced by lipopolysaccharide(n=6)
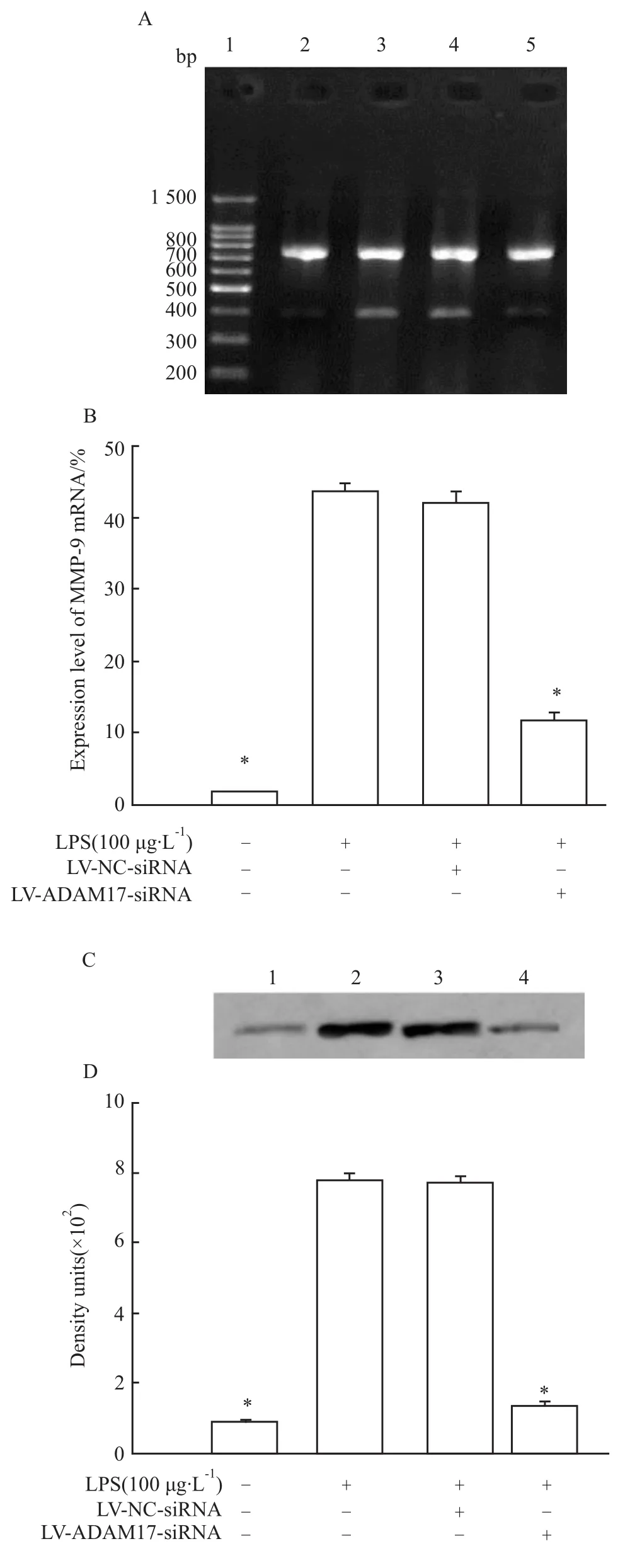
Fig 4 Effects of ADAM17 RNAi on MMP-9 mRNA(A and B)and protein(C and D)expressions induced by lipopolysaccharide(n=6)

Fig 5 Effects of ADAM17 RNAi on NF-κB activity induced by lipopolysaccharide(n=4)
3.3 慢病毒介导的 ADAM17 RNAi不能阻断TNF-α诱导的 MMP-9表达及 NF-κB活性 在TNF-α刺激下,HBE4-E6/E7细胞中 MMP-9 mRNA和蛋白的表达明显增加(P<0.05),见 Fig 6,TNF-α可诱导NF-κB活性明显升高(P<0.05),见Fig 7。以LV-ADAM17-siRNA重组慢病毒感染HBE4-E6/E7细胞72 h后再以TNF-α刺激24 h,和仅以TNF-α刺激组比较,TNF-α诱导的MMP-9 mRNA和蛋白表达及NF-κB的活性均无变化(P>0.05),见 Fig 6,7。PDTC则明显抑制TNF-α诱导的MMP-9 mRNA和蛋白表达及 NF-κB的活性(P<0.05),见 Fig 6,7。
4 讨论
NF-κB是一种多向性核转录因子,因其与免疫球蛋白κ轻链基因的增强子结合而得名。NF-κB广泛存在于各种细胞中,可被TNF-α、LPS等多种因素激活,参与调控IL-8、TNF-α等多种基因的表达,在调节炎症反应、机体免疫功能等过程中发挥重要作用[6-7]。PDTC是 NF-κB活化的特殊抑制剂,可抑制IκBα的降解、阻止IκB和 NF-κB复合体的解离,从而抑制NF-κB的活化过程[8]。本研究中 LPS刺激使HBE4-E6/E7细胞MMP-9表达明显增加,NF-κB活性亦明显升高,etanercept和PDTC则均可阻断这一过程。这说明 TNF-α/NF-κB信号通路在LPS诱导的HBE4-E6/E7细胞MMP-9表达中起重要的调控作用。Hozumi等[9]通过离体实验研究也表明TNF-α刺激可通过NF-κB信号转导途径调节正常人支气管上皮细胞MMP-9表达。
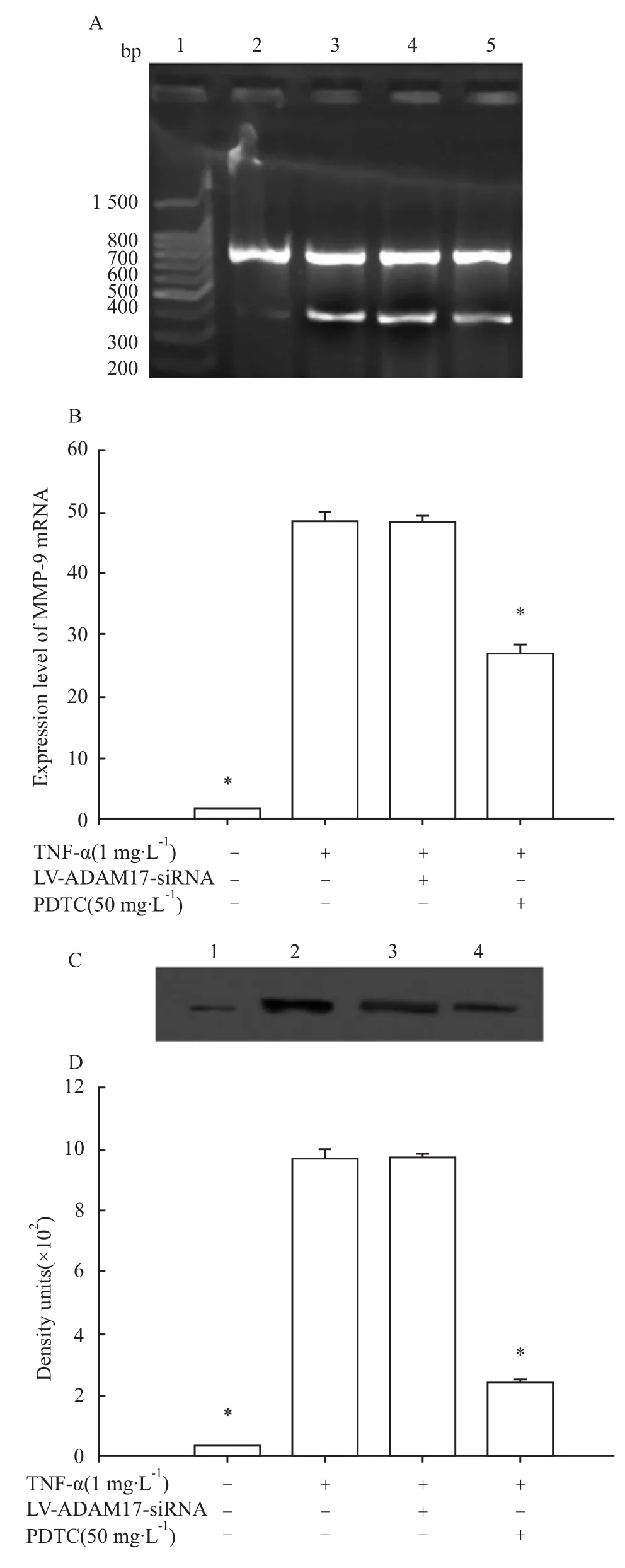
Fig 6 Effects of ADAM17 RNAi on MMP-9 mRNA(A and B)and protein(C and D)expressions induced by TNF-α(n=6)
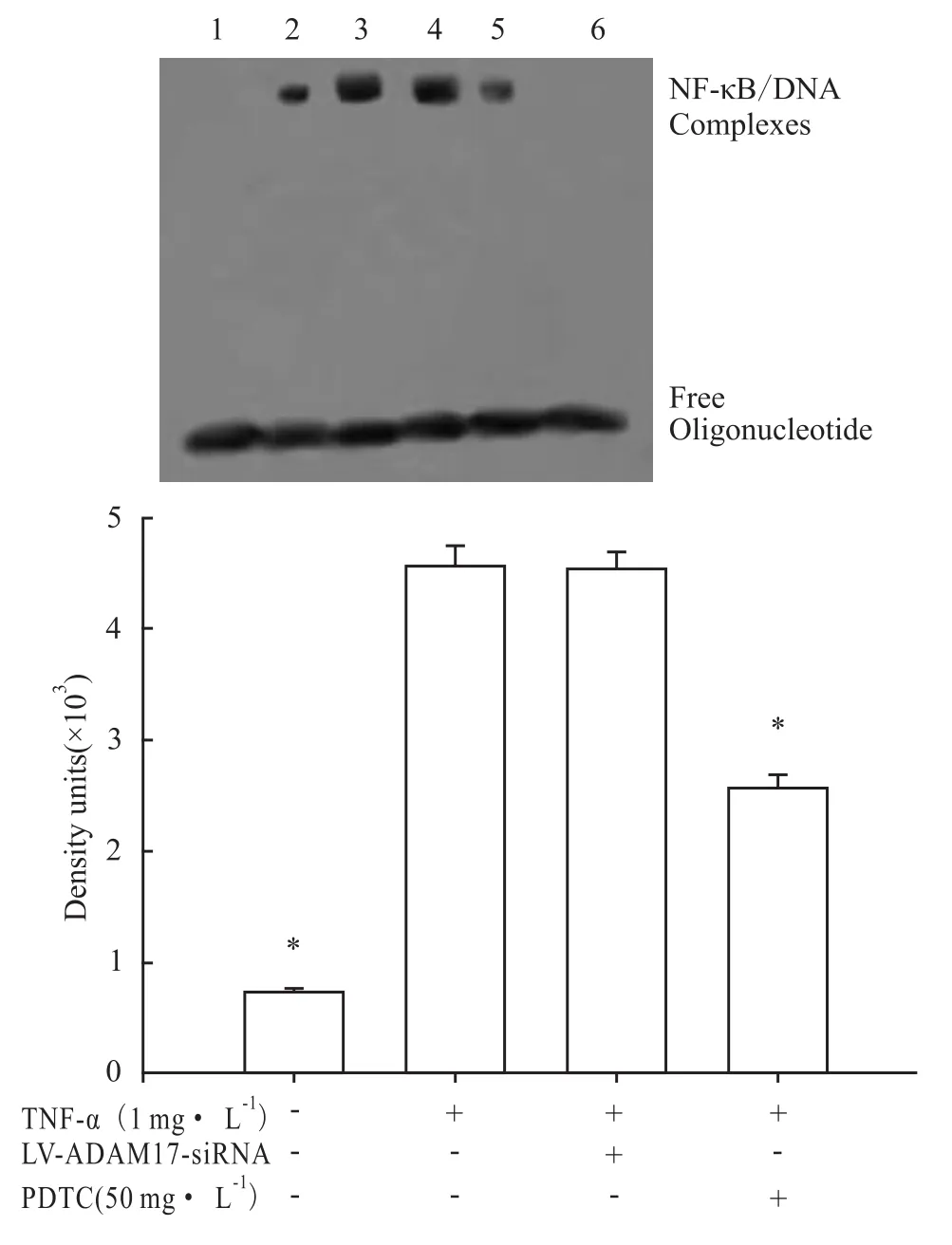
Fig 7 Effects of ADAM17 RNAi on NF-κB activity of airway epithelial cells induced by TNF-α(n=4)
ADAM-17在proTNF-α转化成可溶的TNF-α中起重要作用,虽然 MMP-7、MMP-14、MMP-17、ADAM-10也与 proTNF-α的脱落有关,但是 ADAM-17对proTNF-α的脱落作用是最强的,且其对 proTNF-α脱落特异性是其他MMP对proTNF-α脱落特异性的100~1 000倍,故 ADAM-17又称 TNF-α转化酶(tumour necrosis factor-α converting enzyme,TACE)[10]。ADAM-17最显著的功能是分离 TNF-α、表皮生长因子、肝素结合样表皮生长因子、转化生长因子-α等多种跨膜蛋白的胞外域[11]。本研究中LPS刺激使HBE4-E6/E7细胞上清液TNF-α水平明显升高,而慢病毒介导的ADAM17 RNAi可降低LPS诱导的 HBE4-E6/E7细胞 TNF-α表达,明显抑制LPS诱导的NF-κB活性,使LPS诱导的MMP-9的表达相应地明显降低。但慢病毒介导的ADAM17 RNAi不能阻断以TNF-α直接刺激所引起的MMP-9表达增加和NF-κB活性升高;而PDTC则仍可抑制TNF-α直接刺激引起NF-κB活化,并使TNF-α直接诱导的MMP-9表达明显下降。说明ADAM17是通过调节TNF-α细胞外域脱落参加调节LPS诱导的MMP-9表达过程,但不能直接阻断TNF-α下游的信号转导。
因此,本研究发现TNF-α/NF-κB信号通路在LPS诱导的MMP-9表达中起重要调控作用,慢病毒介导的 ADAM17 RNAi可通过阻断 TNF-α/NF-κB信号通路的上游来调节LPS诱导的气道上皮细胞MMP-9的表达,为COPD的治疗提供了新的研究靶点。
参考文献:
[1] Burgel P R.Pathogenesis of chronic obstructive pulmonary disease[J].Presse Med,2009,38(3):406-12.
[2] Omachi T A,Eisner M D,Rames A,et al.Matrix metalloproteinase-9 predicts pulmonary status declines inα1-antitrypsin deficiency[J].Respir Res,2011,12:35.
[3] Foronjy R,Nkyimbeng T,Wallace A,et al.Transgenic expression of matrix metalloproteinase-9 causes adult-onset emphysema in mice associated with the loss of alveolar elastin[J].Am J Physiol Lung Cell Mol Physiol,2008,294(6):L1149-57.
[4] Wright J L,Tai H,Wang R,et al.Cigarette smoke upregulates pulmonary vascular matrix metalloproteinases via TNF-alpha signaling[J].Am J Physiol Lung Cell Mol Physiol,2007,292(1):L125-33.
[5] Guzman-Aranguez A,Loma P,Pintor J.Small-interfering RNAs(siRNAs)as a promising tool for ocular therapy[J].Br J Pharmacol,2013,170(4):730-47.
[6] O′Dea E,Hoffmann A.NF-κB signaling[J].Wiley Interdiscip Rev Syst Biol Med,2009,1(1):107-15.
[7] 李亚清,严建平,许武林,等.核因子-κB和 p38丝裂原活化蛋白激酶调节脂多糖诱导的气道上皮细胞白细胞介素8的表达[J].中国药理学通报,2011,27(2):182-6.
[7] Li Y Q,Yan JP,Xu WL,et al.Induction of interleukin-8 by lipopolysaccharide in human airway epithelial cells via NF-κB and p38 mitogen-activated protein kinase[J].Chin Pharmacol Bull,2011,27(2):182-6.
[8] Li Y Q,Zhang Z X,Xu Y J,et al.N-Acetyl-L-cysteine and pyrrolidine dithiocarbamate inhibited nuclear factor-kappaB activation in alveolar macrophages by different mechanisms[J].Acta Pharmacol Sin,2006,27(3):339-46.
[9] Hozumi A,Nishimura Y,Nishiuma T,et al.Induction of MMP-9 in normal human bronchial epithelial cells by TNF-αvia NF-κB-mediated pathway[J].Am J Physiol Lung Cell Mol Physiol,2001,281(6):L1444-L52.
[10]Mohan M J,Seaton T,Mitchell J,et al.The tumor necrosis factor-alpha converting enzyme(TACE):a unique metalloproteinase with highly defined substrate selectivity[J].Biochemistry,2002,41(30):9462-9.
[11]Gooz M.ADAM-17:the enzyme that does it all[J].Crit Rev Biochem Mol Biol,2010,45(2):146-69.

