依达拉奉保护H9c2心肌细胞对抗阿霉素的心肌毒性作用
刘广交,郭润民,徐文明,沈 宁,冯鉴强,廖新学
阿霉素(doxrubicin,DOX)常被用来治疗急性白血病、淋巴瘤、骨肿瘤、乳腺癌和卵巢癌等恶性肿瘤[1]。但是,由于它能引起剂量依赖性的心肌毒性,故限制了其在临床上的应用[2-3]。现有的基础研究与临床研究证实,引起DOX心肌毒性的病理生理机制是多方面的,其中氧化应激和心肌凋亡可能是重要的机制,有报道指出,DOX能引起活性氧(ROS)生成增多及心肌细胞凋亡[4]。最近,我们也证实,DOX能引起内质网应激和氧化应激(ROS生成增多),此作用与心肌毒性有关;ROS的清除剂——N乙酰半胱胺酸(N-acetyl-L-cyteine,NAC)可保护H9c2心肌细胞对抗DOX心肌毒性[5]。但是,在临床上,应用抗氧化剂,例如,维生素E(vitamin E)等未能取得满意的心肌保护效果[6],这一方面提示除了ROS过度生成以外,其他的机制,如心肌炎症、信号通路的功能变化可能也在DOX心肌毒性的产生中起着重要的作用;另方面,提示需寻找新型的抗氧化剂以观察其抗DOX心肌毒性的效果。
依达拉奉(edaravone,EDA),又名 MCI-186,是一种新型的自由基清除剂。自2001年起,已在日本用于治疗大脑缺血性疾病,被证实具有神经保护作用[7]。值得注意的是,EDA可有效地清除心脏的ROS[8]。近年,有报道指出,EDA能保护心肌细胞对抗DOX引起的心肌毒性[9-10],但是,其作用机制尚未完全明确,为此,本文应用DOX损伤H9c2心肌细胞,重点探讨EDA能否通过抗氧化作用及线粒体保护作用保护心肌细胞对抗DOX心肌毒性,为深入阐明EDA的心肌保护作用提供新的实验依据。
1 材料与方法
1.1 材料 EDA由南京先声东元制药有限公司供给。阿霉素、Hoechst 33258、罗丹明123(Rh123)、双氯荧光素(DCFHDA)购自 Sigma Aldrich公司(USA)。细胞计数试剂盒 8(cell counter kit-8,CCK-8)由Dojindo Lab(日本)提供。DMEM-F12培养基以及特级胎牛血清(FBS)购自 Gibco BRL(USA)。抗 cleaved caspase-3抗体购自 Cell Signaling Technology Inc(CST)。
1.2 细胞培养与处理方法 H9c2细胞来源于大鼠胚胎期心脏组织,由中山大学实验动物中心提供。在37℃、5%CO2的条件下,培养于含有15%胎牛血清的DMEM-F12培养基中。EDA预处理按如下目的与步骤实施:(1)观察不同浓度EDA对DOX损伤心肌作用的影响:应用20、40、80μmol·L-1EDA分别预处理H9c2心肌细胞60 min,接着给予55μmol·L-1DOX处理心肌细胞24 h;(2)观察应用40 μmol·L-1EDA预处理不同时间对DOX损伤心肌作用的影响;接着给予5μmol·L-1DOX作用24 h。
1.3 CCK-8测定细胞存活率 H9c2心肌细胞接种于96孔培养板中,当细胞生长到培养孔约80%面积时,根据实验需要进行不同的处理:(1)5 μmol·L-1DOX培养 24 h;(2)40μmol·L-1EDA提前60 min加入培养基中作为预处理,然后更换成5μmol·L-1DOX培养24 h;每个处理因素设4个复孔。终止培养后,每孔加入10μl CCK-8,轻摇,37℃孵育2 h,用酶标仪(λ=450 nm)记录各孔的吸光度(OD)。取4孔OD值的平均数,按下列公式计算细胞存活率:细胞存活率/%=处理组OD/对照组OD×100%,重复3次。
1.4 Hoechst 33258核染色法检测细胞凋亡H9c2心肌细胞经不同因素处理后,小心弃去培养基,PBS洗1遍,4%多聚甲醛固定10 min,PBS漂洗后,加入5 mg·L-1Hoechst 33258试剂,室温轻摇30 min。在荧光显微镜(BX50-FLA,Olympus,Japan)下摄片,染色质均匀分布,核被染成均匀蓝色的细胞认为是正常细胞,核呈浓缩、碎裂的明亮蓝色细胞认为是凋亡细胞,随机选取视野在荧光显微镜下摄片。
1.5 Western blot测定 caspase-3蛋白的表达H9c2心肌细胞接种于60 mm培养皿中,各实验组给予不同的处理因素后,用预冷的PBS洗2次,加入细胞裂解液,4℃静置 30 min,12 000 r·min-1离心10 min,取上清,采用BCA法进行蛋白定量。总蛋白经SDSPAGE分离后,转移到PVDF膜上。用5%脱脂奶粉封闭 1.5 h,随后加入抗 cleavedcaspase-3抗体 (1∶1 000,4℃过夜,用 TBST洗 3次,10 min/次。将PVDF膜用发光试剂ECL显色,暗室曝光到X线片上,凝胶成像系统扫描分析结果。
1.6 细胞内ROS水平的测定 DCFH-DA本身没有荧光,可以自由穿过细胞膜。进入细胞后,可被细胞内的酯酶水解成DCFH,而DCFH不能自由通透细胞膜,从而将探针装载到细胞内。细胞内的ROS可将无荧光的DCFH氧化成发出绿色荧光的DCF。绿色荧光的强弱可以间接反映细胞内 ROS的水平。将赖氨酸包被的盖玻片置于6孔培养板内,H9c2心肌细胞被均匀地接种于盖玻片上。当细胞生长到培养孔约80%面积时,根据实验需要给予相应的处理:(1)5μmol·L-1DOX处理 24 h;(2)40μmol·L-1EDA预处理60 min后,再用5μmol·L-1DOX处理 24 h;(3)单纯用 40μmol·L-1EDA处理60 min。每组均包括3个复孔。处理完成后,用 PBS漂洗盖玻片2次,用10μmol·L-1DCFH-DA染液于37℃孵育30 min。在荧光显微镜下随机选取5个不重复区摄片,用ImageJ 1.410软件分析5个视野绿色荧光强度的平均值,再对每组的各样本进行统计分析。
1.7 线粒体膜电位(mitochondrial membrance potential,MMP)的检测 当细胞生长到约80%融合时,根据实验需要给予不同的条件培养基。处理结束后,用PBS洗2次,在含100μg·L-1Rh 123的无血清培养基中37℃孵育30 min。在荧光显微镜下随机选取3个不重复区摄片,细胞核周围绿色的亮点即为摄取了Rh123的线粒体。用ImageJ1.410软件对绿色荧光强度进行半定量分析。
1.8 统计学方法 所有结果以¯x±s表示,组间比较采用单因素方差分析(one-way ANOVA),用LSD-t进行均数之间的比较,实验数据用SPSS 13.0软件进行统计分析。
2 结果
2.1 EDA抑制DOX诱导的心肌细胞毒性 根据我们的前期研究结果[5],本实验选用5μmol·L-1作为DOX的有效损伤浓度,24 h作为有效的损伤时间。Fig 1A显示,5μmol·L-1DOX处理H9c2心肌细胞24 h能引起明显的细胞毒性,表现为心肌细胞的存活率明显降低(P<0.01)。在应用5μmol·L-1DOX处理 H9c2心肌细胞前,应用不同浓度(20、40、80μmol·L-1)的 EDA分别预处理60 min,均能抑制DOX的心肌细胞毒性,使细胞存活率升高,其中40μmol·L-1EDA的保护作用最明显。在此研究基础上,本文观察到应用40μmol·L-1EDA预处理心肌细胞不同时间(30、60、90、120 min)均能明显地保护心肌细胞对抗DOX的细胞毒性,其中预处理60 min的心肌保护作用最大(Fig 1B)。因此,本文选用了浓度为40μmol·L-1,时间为60 min作为EDA预处理的参数。

Fig 1 Inhibitory effect of EDA on DOX-induced cytotoxicity in H9c2 cardiac cells
2.2 EDA抑制DOX诱导的心肌细胞凋亡 Fig 2A的Hoechst 33258核染色检测结果显示,5μmol·L-1DOX处理 H9c2心肌细胞24 h能使凋亡H9c2细胞数量明显增多。在DOX处理细胞前应用40μmol·L-1EDA预处理60 min可明显地减少凋亡细胞的数量,与DOX损伤组比较,差异具有统计学意义(P<0.05)。40μmol·L-1EDA处理 H9c2细胞60 min不引起细胞凋亡(Fig 2B)。
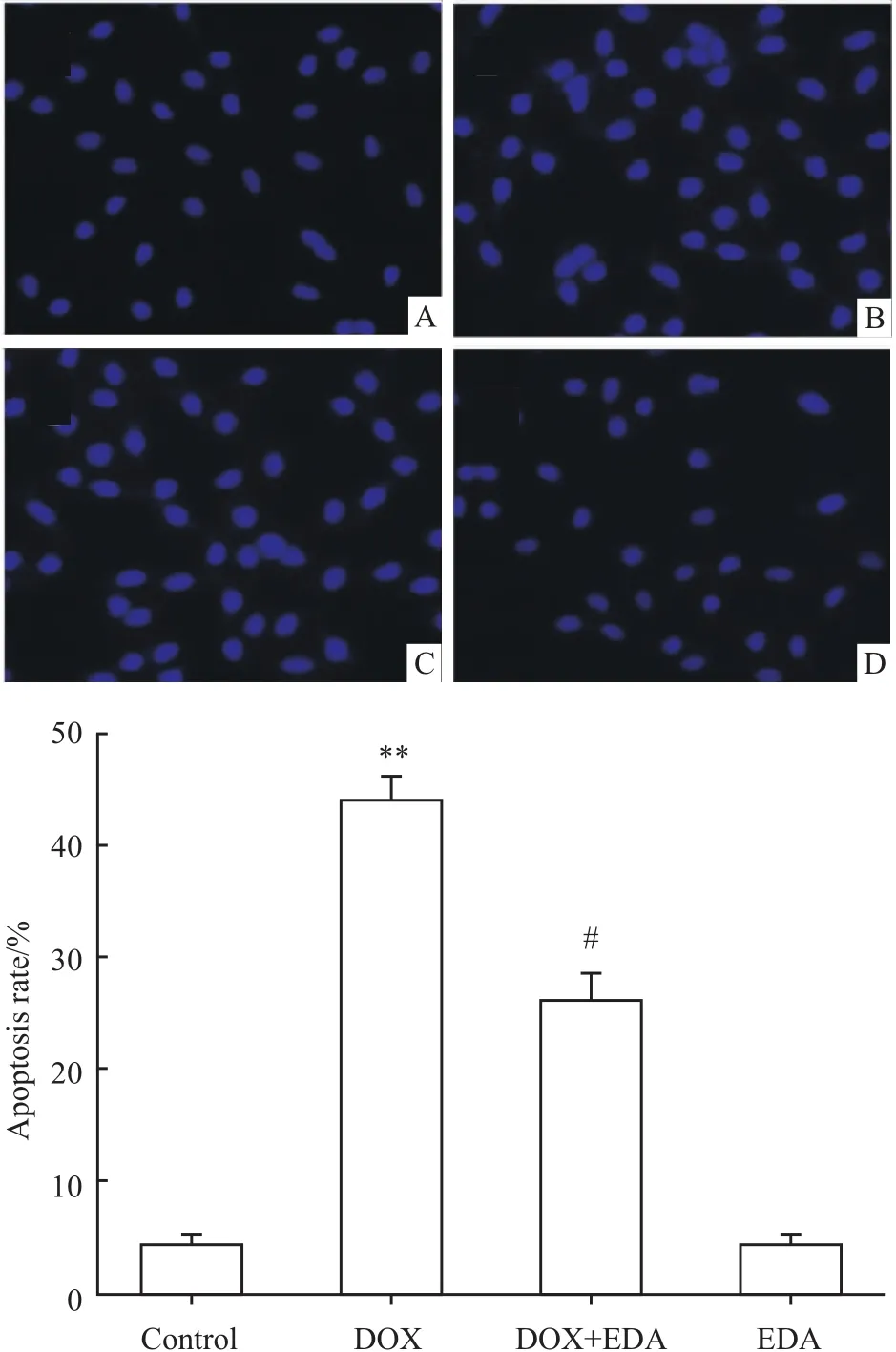
Fig 2 Inhibitory effect of EDA on DOX-induced apoptosis in H9c2 cardiac cells
Fig 3A和3B的Western blot检测结果显示,应用5μmol·L-1DOX处理 H9c2心肌细胞6、12和24 h均能上调cleaved(代表激活)caspase-3表达,其中12 h时,cleaved caspase-3表达达到高峰。但是,40μmol·L-1EDA预处理H9c2细胞60 min能明显地抑制DOX对cleaved caspase-3表达的上调作用(Fig 3C和3D)。EDA本身不影响cleaved caspase-3的基础表达。
2.3 EDA抑制DOX诱导的氧化应激 Fig 4显示,正常心肌细胞内存在少量的的 ROS,但是,5 μmol·L-1DOX处理H9c2心肌细胞24 h使胞内ROS水平明显增多,与对照组比较,差异具有统计学意义(P<0.01)。40μmol·L-1EDA预处理60 min能明显地抑制DOX诱导的氧化应激,使胞内ROS明显减少(P<0.05)。EDA本身不影响ROS生成。
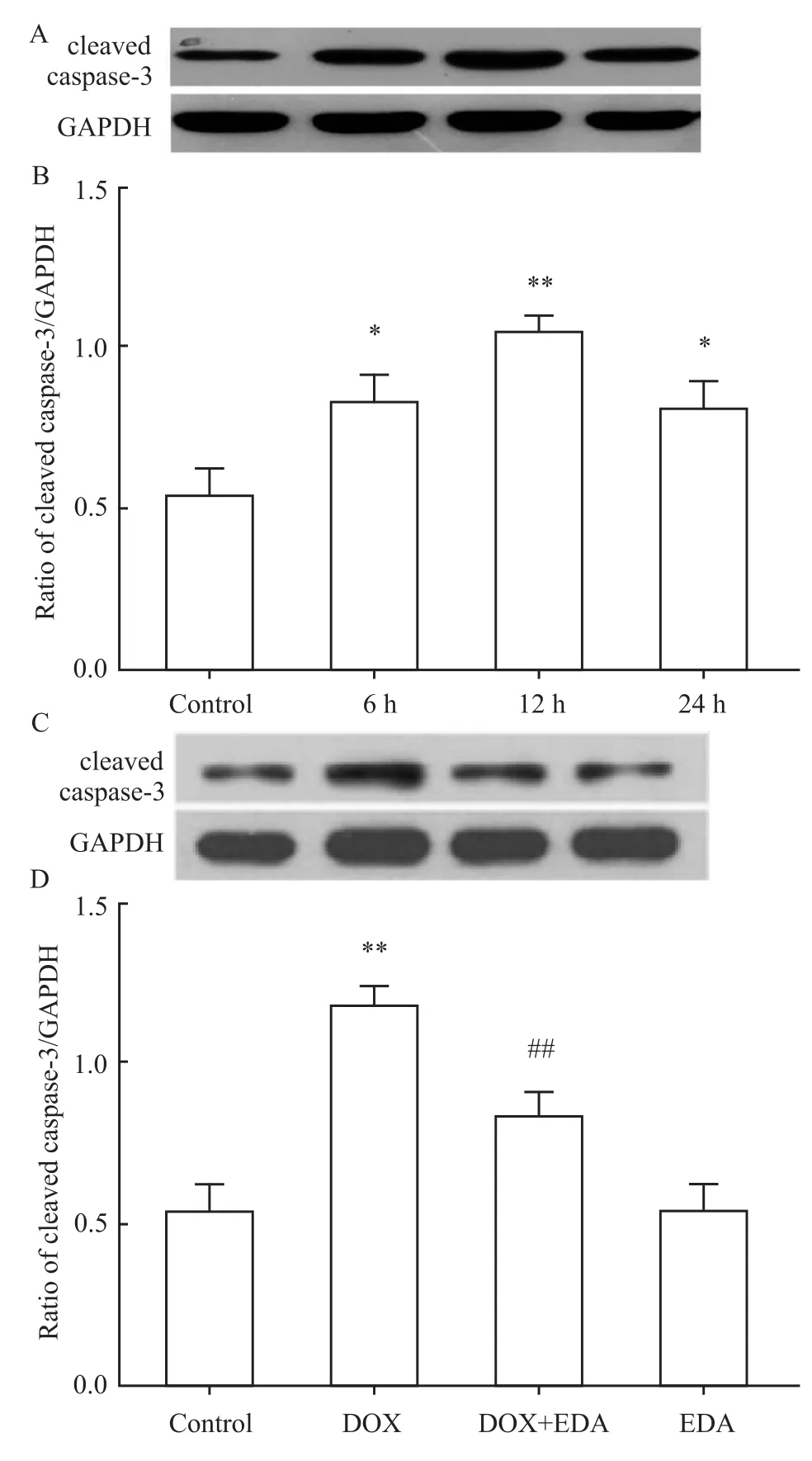
Fig 3 Inhibitory effect of EDA on the increased expression of cleaved caspase-3 by DOX-treatment in H9c2 cells(n=5)
2.4 EDA抑制DOX诱导的MMP丢失 Fig 5显示,5μmol·L-1DOX处理H9c2细胞6 h可使MMP明显降低,但是40μmol·L-1EDA预处理60 min能明显地降低DOX对线粒体的损伤作用,使MMP升高(P<0.05)。EDA预处理本身不影响MMP。
3 讨论
临床上,由于许多与缺血性相关的心脏疾病的心肌损伤与氧化应激有关,因此,通过抑制氧化应激从而保护心肌已成为一种治疗策略。近年,新型的自由基清除剂EDA的心肌保护作用日益受到重视。有临床研究报道,EDA对急性心肌梗死的患者具有较长期的改善作用。在离体的大鼠心脏实验,EDA能抑制缺血/再灌注引起的心肌损伤[11]。本研究小组也证实,EDA可保护H9c2心肌细胞对抗异丙肾上腺素引起的心肌损伤和氧化应激反应[12]。值得注意的是,有报道证实,EDA可保护大鼠[9]和狗[10]的心肌对抗DOX引起的心肌毒性,但是,EDA抑制DOX引起的心肌毒性的作用机制仍未完全清楚。
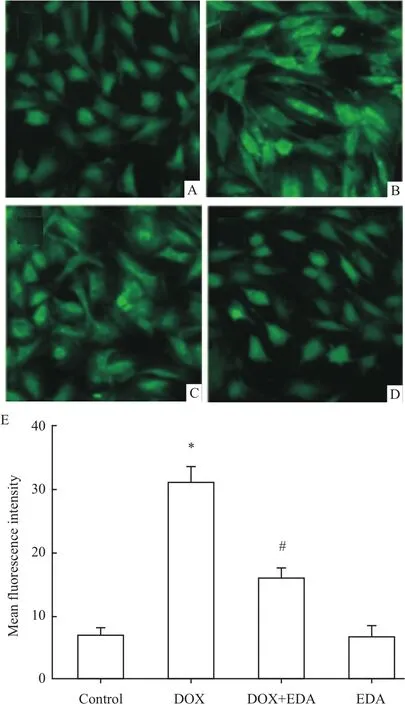
Fig 4 EDA inhibits the ROS generation induced by DOX in H9c2 cells(n=5)
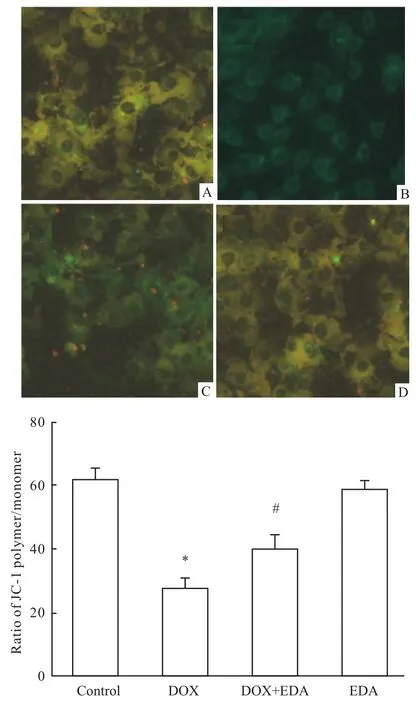
Fig 5 EDA attenuates DOX-induced loss of MMP in H9c2 cells
本研究观察到,应用DOX处理H9c2心肌细胞能引起明显的损伤,表现为心肌细胞的存活率降低,凋亡细胞数量增多,活化的caspase-3表达增多、ROS生成增多及 MMP丢失,这与先前的报道[4-5]相一致。重要的是,本研究证实EDA能抑制DOX引起的心肌细胞毒性及致凋亡作用,使细胞存活率增多,凋亡细胞数量及活化的caspase-3表达均减少,这与最近的研究[9-10]相一致。值得注意的是,本研究进一步证实EDA能抑制DOX引起的心肌细胞内ROS堆积。由于我们已证实ROS清除剂NAC能抑制DOX引起的心肌细胞毒性及胞内ROS堆积[5],这与本研究的结果相似,提示EDA的抗DOX心肌毒性作用可能与其抑制ROS过度生成有关。黄涌等[12]也报道,EDA与NAC能抑制异丙肾上腺素诱导的心肌细胞毒性和胞内ROS堆积,支持本文的实验结果。
另方面,Shi等[13]指出,DOX可通过损伤心肌线粒体继而引起心肌细胞凋亡。因此,本文观察了EDA的线粒体保护作用。研究结果表明,EDA也能保护H9C2心肌细胞对抗DOX引起的MMP丢失,表明保护线粒体功能可能是EDA心肌保护作用的另一作用机制。在化学性低氧模拟剂氯化钴(CoCl2)引起的心肌细胞损伤模型[14-15],EDA能抑制CoCl2对MMP的损伤作用[15],这为本文提供了有力的依据。
综上所述,本文证实新型的自由基清除剂EDA能保护H9c2心肌细胞对抗DOX心肌毒性,此保护作用可能与其抗氧化作用、线粒体保护及抗凋亡作用等有关。由于本文未观察EDA与其他抗氧化剂(如vitamin E等)的作用比较,因此,今后尚需开展有关这方面的比较研究。
参考文献:
[1] Danesi R,Fogli S,Gennari A,et al.Pharmacokinetic-pharmacodynamic relationships of the anthracycline anticancer drugs[J].Clin Pharmacokinet,2002,41:431-44.
[2] Hrdina R,Gersl V,Klimtova I,et al.Anthracycline-induced cardiotoxicity[J].Acta Med(Hradec Kralove),2000,43(3):75-82.
[3] Scully R E,Lipshultz S E.Anthracycline cardiotoxicity in longterm survivors of childhood cancer[J].Cardiovasc Toxicol,2007,7(2):122-8.
[4] Mukhopadhyay P,Rajesh M,Batkai S,et al.CB1 cannabinoid receptors promote oxidative stress and cell death in murine models of doxorubicin-induced cardiomyopathy and in human cardiomyocytes[J].Cardiovasc Res,2010,85:773-84.
[5] Wang X Y,Yang C T,Zheng D D,et al.Hydrogen sulfide protects H9c2 cells against doxorubicin-induced cardiotoxicity through inhibition of endoplasmic reticulum stress[J].Mol Cell Biochem,2012,363(1-2):419-26.
[6] Berthiaume J M,Oliveira PJ,Fariss M W,Wallace K B.Dietary vitamin E decreases doxorubicin-induced oxidative stress without preventing mitochondrial dysfunction[J].Cardiovasc Toxicol,2005,5:257-67.
[7] Chen H,Wang S,Ding J H,Hu G.Edaravone protects against MPP+-induced cytotoxicity in rat primary cultured astrocytes via inhibition of mitochondrial apoptotic pathway[J].J Neurochem,2008,106:2345-52.
[8] Tsujimoto I,Hikoso S,Yamaguchi O,et al.The antioxidant edaravone attenuates pressure overload-induced left ventricular hypertrophy[J].Hypertension,2005,45:921-6.
[9] Ikegami E,Fukazawa R,Kanbe M,et al.Edaravone a potent free radical scavenger,prevents anthracycline-induced myocardial cell death[J].Circ J,2007,71:1815-20.
[10]Xin Y F,Zhang S,Gu L Q,et al.Electrocardiographic and biochemical evidence for the cardioprotective effect of antioxidants in acute doxorubicin-induced cardiotoxicity in the beagle dogs[J].Biol Pharm Bull,2011,34(10):1523-6.
[11]Minhaz U,Tanaka M,Tsukamoto H,et al.Effect of MCI-186 on postischemic reperfusion injury in isolated rat heart[J].Free Radic Res,1996,24(5):361-7.
[12]黄 涌,阮经文,杨春涛,等.依达拉奉保护H9c2心肌细胞对抗异丙肾上腺素诱导的氧化应激及内质网应激反应[J].中国药理学通报,2011,27(3):410-5.
[12]Huang Y,Ruan J W,Yang C T,et al.Myocardial protection of edaravone against isoprenaline-induced oxidative stress and endoplasmic reticulum stress in H9c2 cells[J].Chin Pharmacol Bull,2011,27(3):410-5.
[13]Shi Y,Moon M,Dawood S,et al.Mechanisms and management of doxorubicin cardiotoxicity[J].Herz,2011,36:296-305.
[14]廖新学,杨春涛,杨战利,等.硫化氢对抗化学性缺氧引起的心肌细胞损伤及其机制[J].中国药理学通报,2009,25(8):1012-7.
[14]Liao X X,Yang C T,Yang Z L,et al.Hydrogen sulfide protects H9c2 cells against chemical hypoxia-induced injury and the underlying mechanisms[J].Chin Pharmacol Bull,2009,25(8):1012-7.
[15]张蔼玲,兰爱平,郑东诞,等.依达拉奉保护H9c2心肌细胞对抗化学性低氧引起的损伤[J].中国动脉硬化杂志,2012,20(4):304-8.
[15]Zhang A L,Lan A P,Zhen D D,et al.Edaravone protects H9c2 cells against chemical hypoxia-induced injury[J].Chin J Arterioscler,2012,20(4):304-8.

