肌肽对皮层下缺血性血管性痴呆动物认知功能的保护作用
马 婧,张 健,陈 忠
血管性痴呆是继老年性痴呆之后,临床发病率排第2位的认知障碍性疾病[1]。其中皮层下缺血性血管性痴呆(subcortical ischemic vascular dementia,SIVD)是第2大亚型,由慢性缺血/再灌注导致小血管疾病引起,多见于高血压、动脉硬化患者。SIVD的主要病理表现为胶质细胞的激活和认知功能障碍[2]。目前对于SIVD的治疗已经引起了广泛的关注[3]。胆碱酯酶抑制剂、血管扩张药等通过不同的机制,对SIVD发挥温和的保护作用[4],但是到目前为止还没有针对SIVD的特效药物[5]。
组胺是脑内一种重要的神经递质,能够参与摄食、运动功能和学习记忆等生理过程,发挥多种神经调节作用[6]。由于组胺能够保护急性脑缺血损伤[7],因此假定组胺对 SIVD可能也有保护作用。但是由于组胺不能通过血脑屏障,并且可能引起炎症反应,限制了组胺的利用。
肌肽(β-丙氨酰-L-组氨酸,carnosine,Car)是由β-丙氨酸和L-组氨酸组成,在肌肉和脑组织中高表达。肌肽是体内组胺的一个天然储库,能够通过转变为组氨酸然后成为组胺[8]。由于肌肽能够由外周进入神经中枢系统,因而对神经系统疾病有保护作用。肌肽被认为具有抗炎性,抗氧自由基,pH缓冲剂等作用。肌肽通过肌肽-组氨酸-组胺的代谢途径,改善缺血/再灌引起的急性肾功能衰竭[9],还能够通过抗氧化和抗凋亡作用对动物脑损伤发挥保护作用[10]。因此假设肌肽对SIVD有临床治疗作用,我们利用了永久性结扎小鼠右侧颈总动脉(right unilateral common carotid arteries occlusion,rUCCAO)制作的模型来研究肌肽对SIVD诱导的动物认知功能的作用
1 材料
1.1 实验动物 ♂ C57BL/6品系野生型小鼠(北京维通利华公司提供),体质量22~30 g,8~10周龄。动物饲养在温度控制的环境(22±1)℃下,12 h明暗循环,分笼饲养并自由摄水饮食。所有行为学的实验均在10∶00~17∶00间进行。实验完全遵从NIH关于实验动物照护和使用的规定。
1.2 化学试剂 肌肽购自美国Sigma公司。戊巴比妥钠、无水乙醇、醋酸购自国药集团化学试剂有限公司。
1.3 主要仪器 小动物恒温孵育箱(英国 Peco Services Ltd公司);小动物恒温毯(美国 FHC公司);条件恐惧性记忆的刺激器(Hamilton-Kinder company,CA,US);水迷宫(Zhenghua Biologic Apparatus Facilities Co Ltd,Huaibei,China);热板测痛仪(山东省医学科学院设备站);运动量监测系统(Any maze,stoelting Co.,USA)
2 方法
2.1 动物模型制备 使用戊巴比妥钠(60 mg·kg-1)腹腔注射麻醉动物,用体积分数为0.75的乙醇颈部消毒后,切开颈部正中的皮肤,将小鼠右侧的颈总动脉和迷走神经钝性分离,用6-0线永久性结扎小鼠右侧颈总动脉(rUCCAO),分别缝合肌肉和颈部的皮肤,碘伏消毒。术后将小鼠放入35℃保温孵育箱内,苏醒后放入笼中饲养。假手术组除结扎外,其余的步骤和手术组一致[11]。
2.2 动物实验分组 用生理盐水溶解肌肽(carnosine,Sigma,美国)后进行腹腔注射。成年野生型小鼠手术后,给予生理盐水(saline),肌肽(car,200,500或者750 mg·kg-1),手术前30 min给药 1次,之后每隔1 d给药1次直至动物被处死。麻醉苏醒后动物分笼照顾,手术后27 d对小鼠进行运动量测定和敞箱实验,手术后d 28时对小鼠进行热板实验,手术后d 29对小鼠进行2 d的恐惧记忆实验,到手术后d 31进行3 d的水迷宫实验。行为学检测期间,每隔1 d的测试后给予肌肽。
2.3 运动量测定 为测定小鼠持续的运动量,把小鼠放入单独的有机玻璃盒子中(30×30×30)cm3,在实验手术后d 27时,采用运动量监测系统,将不同组的小鼠依次放入盒子,测定小鼠3 min和6 min内所走过的距离[12]。
2.4 敞箱实验 用自制的敞箱(30×30×30)cm3进行敞箱实验,在实验手术d 27运动量监测后进行,将不同组的小鼠依次放入敞箱中,底面由面积相等的边长10 cm划分的9块正方形组成。记录小鼠在3 min和6 min内在中间正方形内探索时间[12]。
2.5 热板实验 等热板的温度达到(47.5±0.1)℃后,将小鼠置于热板上同时开始计时。当实验小鼠表现出抬爪、舔爪或甩爪的反应时停止计时。为防止热板的刺激对小鼠的伤害,实验测试时间不超过70 s。实验平行测试3组(间隔2 h),取平均值为小鼠热痛的阈值。
2.6 恐惧记忆实验 在手术后d 29时进行恐惧学习记忆能力检测。实验开始将小鼠放入训练盒内训练,适应120 s后,给予2 800 Hz,84 dB的声音刺激30 s(条件刺激),在声音刺激最后2 s同时给予电流刺激0.3 mA(非条件刺激),刺激结束后,待小鼠在训练盒内停留30 s后取出。训练实验结束后24 h,进行背景和线索记忆的测试。测试实验按照训练时的顺序,将小鼠放入训练盒内,不给任何刺激,观察5 min内出现恐惧反应的百分比。然后将小鼠放入新的环境(新的盒子),适应120 s后,仅给予训练时的声音刺激360 s,不给予电流刺激,观察恐惧反应出现的百分比。恐惧反应出现的百分比是通过计数每5 s内恐惧反应的出现与否而得到的[12]。
2.7 水迷宫实验 水迷宫实验应用于检测转基因或者基因敲除小鼠的学习记忆能力。水迷宫的组成成分:一个直径150 cm,高50 cm,水温20℃的池子,摄像头及分析系统。水迷宫的水池水深30 cm,在距水面1.5 cm处放置直径10 cm的一个逃离平台。为避免小鼠直接观察到平台,可在水中加入白色食用色素混匀使其成为乳白色。水迷宫实验训练d 1 4次,d 2和d 3各6次,每次试验间隔10 min。每次随机将小鼠从池子的4个不同象限放入水中,由于小鼠天性逃避水环境,当发现平台后则栖身其上,然后用自动跟踪系统记录小鼠发现平台的潜伏时间,实验不超过60 s,计算每天的平均潜伏期[13]。
2.8 统计学方法 数据用¯x±s表示,数据来自3~6次实验。数据分析使用SPSS 11.5软件。水迷宫实验数据使用two-way ANOVA结合LSD检测。其余数据使用one-way ANOVA结合LSD或者Dunnett′s T3 post-hoc test,进行各组数据间差异分析。
3 结果
3.1 肌肽对r UCCAO诱导的小鼠运动量的作用由Fig 1可知,手术后27 d对小鼠进行运动量检测发现,在试验3 min和试验6 min内,手术组(rUCCAO)小鼠的运动量和假手术组(sham)相比,均没有差异。肌肽(200,500,750 mg·kg-1)对小鼠的运动量也没有影响。由于手术及给药均不影响动物的运动量,因此可以进行后续其他被运动量影响的认知功能实验。
3.2 肌肽对r UCCAO诱导的小鼠敞箱实验中探索能力的作用 敞箱实验用来检测动物的探索能力,动物在中间区域停留时间越长,说明其探索能力越强。Fig 2结果显示,在敞箱实验中,与假手术组相比,手术动物在中间区域停留时间明显降低(3 min,P<0.01;6 min,P<0.01)。肌肽(200,500 mg·kg-1)在3 min和6 min内均能明显逆转由手术引起的小鼠在中间区域停留时间的降低(P<0.05)。
3.3 肌肽对r UCCAO诱导的小鼠疼痛感受的作用由Fig 3结果显示,与假手术组(sham)相比,手术组(rUCCAO)和给药组的小鼠在疼痛感受测试中对小鼠的痛阈没有明显影响,因此可以进行小鼠恐惧记忆的实验。
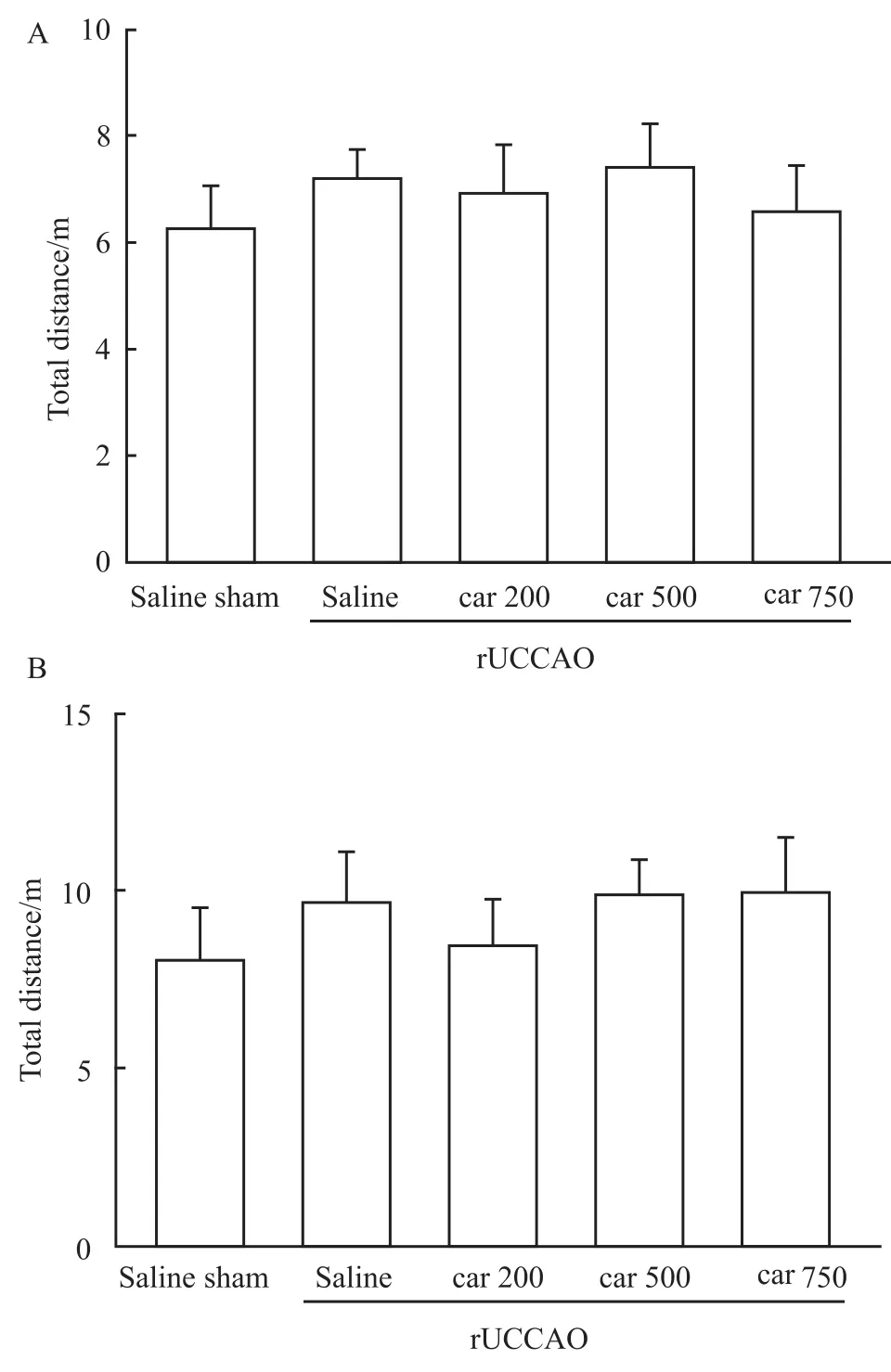
Fig 1 Effect of carnosine(Car)on total distance in locomotor test 3 min(A)and 6 min(B)after r UCCAO(n=12~14)
3.4 肌肽对r UCCAO诱导的小鼠恐惧记忆的作用为了研究肌肽对于小鼠SIVD后的恐惧条件学习记忆的影响,在脑缺血后的d 29时,对小鼠进行恐惧学习记忆的训练和测试。实验结果如Fig 4,在背景记忆实验中,与假手术组相比,rUCCAO诱导的手术组小鼠恐惧反应明显降低,而肌肽(200,500 mg·kg-1)明显提高了小鼠的背景记忆的恐惧反应。但是在线索记忆中,与假手术组相比,手术组和给药组均不能影响小鼠的线索记忆能力。
3.5 肌肽对r UCCAO诱导的小鼠水迷宫实验的作用 在水迷宫实验(Fig 5)中,结果显示随着训练天数的增加,小鼠到达平台的平均逃避潜伏期逐渐降低。小鼠在rUCCAO诱导后学习记忆的获得训练中寻找平台的潜伏期延长,Two-way ANOVA统计结果显示,在训练阶段肌肽组明显优于rUCCAO组(逃避潜伏期:F(1.230)=27.36,P<0.01)。其中肌肽(200 mg·kg-1)能明显缩短学习记忆的获得训练中寻找平台的潜伏期(P<0.01),而高剂量组肌肽(500 mg·kg-1)仅能缩短水迷宫实验d 3学习记忆的获得训练中寻找平台的潜伏期(P<0.05)。
4 讨论
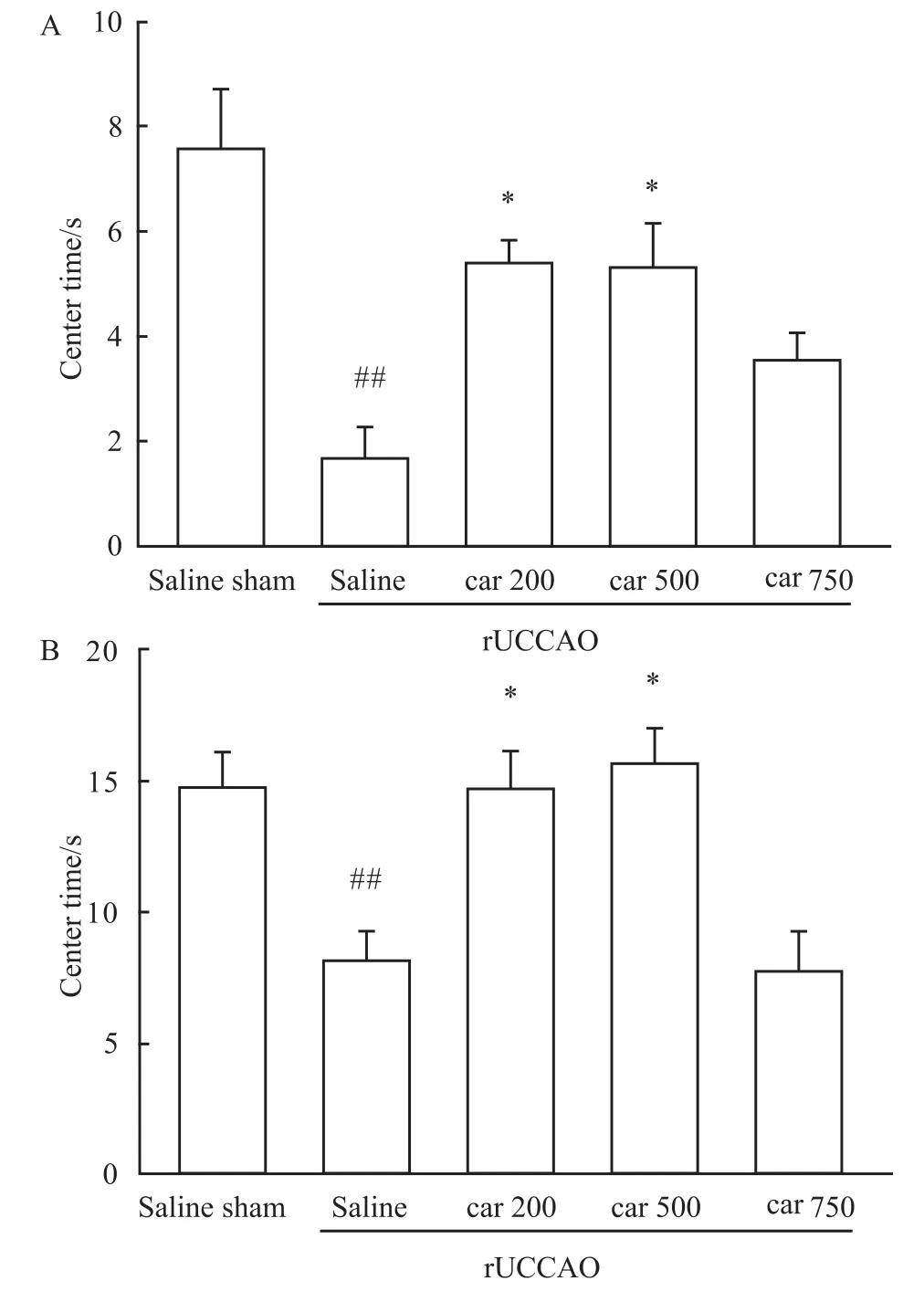
Fig 2 Effect of carnosine(Car)on learning and memory in open field test 3 min(A)and 6 min(B)after r UCCAO(n=12~14)##P<0.01 vs sham group;*P<0.05 vs rUCCAO group.
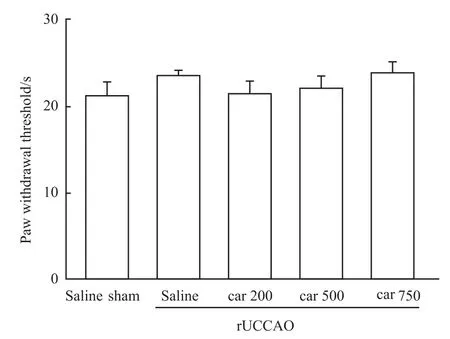
Fig 3 Effect of carnosine(Car)on paw withdrawal threshold in hot plate test after r UCCAO(n=12~14)
本实验采用了永久性结扎右侧颈总动脉(rUCCAO)的方法来研究肌肽对SIVD的作用[11]。研究发现肌肽能明显逆转手术引起的动物认知功能的下降,对SIVD动物的认知功能有明显的保护作用。
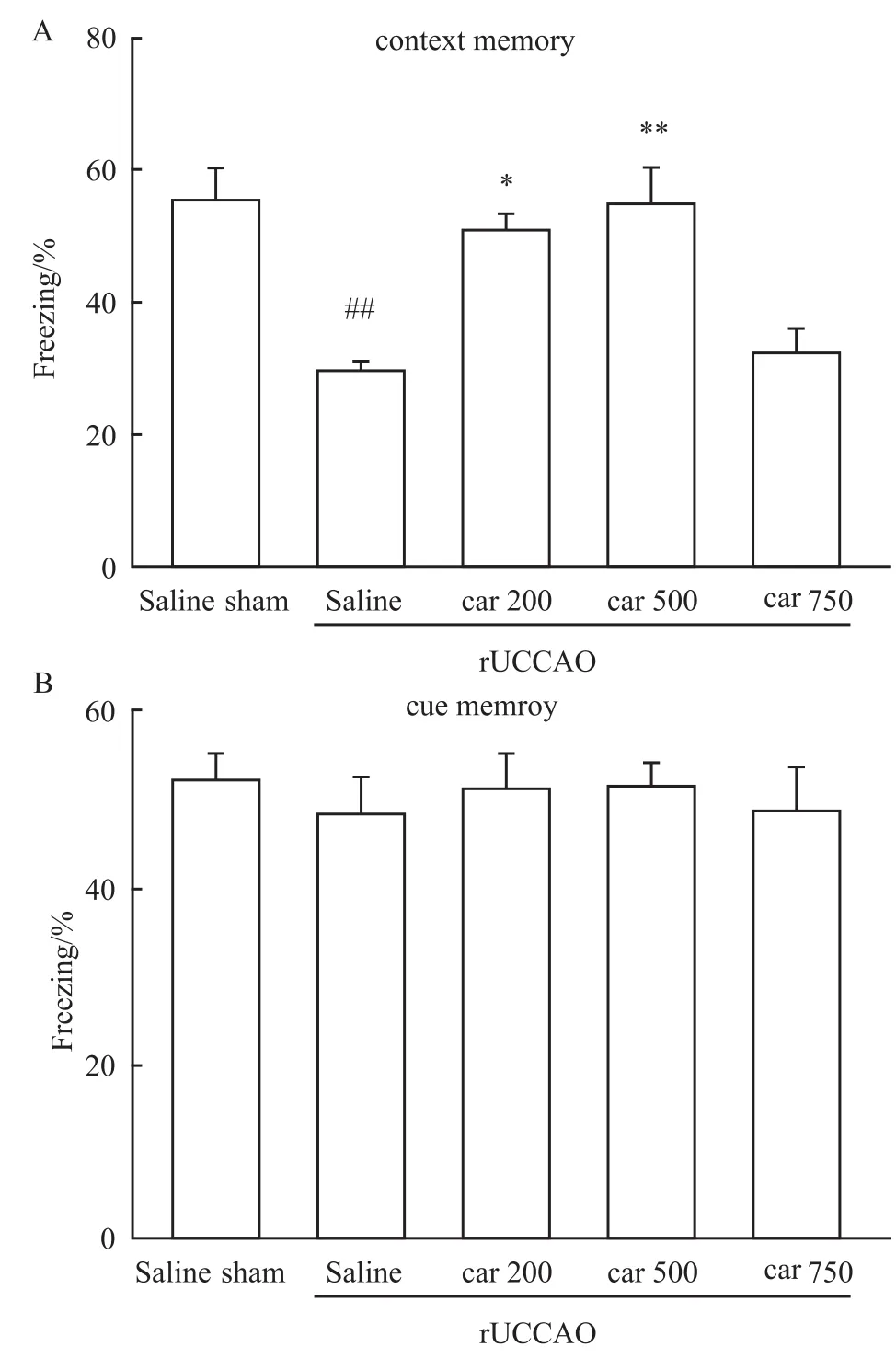
Fig 4 Effect of carnosine(Car)on learning and memory in freezing test after r UCCAO in mice(n=12~14)

Fig 5 Effect of carnosine(Car)on learning and memory in Morris water maze test after r UCCAO in mice(n=12~14)
目前实验室研究SIVD使用的动物模型,常用的有经典大鼠双侧永久性颈总动脉阻塞(2-VO)模型和相应的2-VO改良模型等。但这些模型均存在以下缺点:(1)实验动物的死亡率高,(2)实验动物存在明显的运动系统损伤,学习记忆功能改变不大,(3)由于实验动物的运动功能障碍明显,导致其行为学相关指标无法检测。同时C57BL/6品系小鼠脑内Willis环发育不全,双侧颈总动脉结扎的方法不能在C57BL/6小鼠及相关基因敲除小鼠上制作 SIVD模型[14]。Shibata等[12]利用钢琴丝制成的微粒,阻塞双侧颈总动脉,能够诱导学习记忆和白质的损伤,但是此模型导致损伤的严重程度与微粒的直径有关,并且手术操作复杂。近期有报道[11]发现右侧颈总动脉永久性结扎(rUCCAO)方法,具有操作简单、死亡率低、可重复性好、创伤小等优点。在本实验中我们发现,rUCCAO诱导后对动物的运动量没有明显影响,提示手术对实验动物的运动系统没有明显损伤,手术组的实验动物也不存在明显的运动功能障碍,可以进行后续的行为学和学习记忆的检测。
Yoshizaki报道发现,rUCCAO能诱导 C57BL/6小鼠新事物识别实验中非空间学习记忆的损伤。本实验结果发现rUCCAO还能够诱导C57BL/6小鼠恐惧记忆的背景记忆以及和水迷宫实验中学习记忆能力的下降以及敞箱实验中动物的探索能力。恐惧记忆实验能反映动物的恐惧记忆和情绪,水迷宫实验能反映动物的空间学习记忆,敞箱实验能反映动物的探索能力。而大脑的胼胝体部位被认为与动物的情绪、空间学习记忆及探索能力有关[15]。因此我们的实验结果显示,rUCCAO诱导的慢性缺血会损伤小鼠的空间和非空间学习记忆以及恐惧记忆,能够更好的模拟临床SIVD病人的认知功能障碍和白质损伤。实验还首次发现rUCCAO诱导对动物的疼痛阈值和恐惧记忆实验中的线索记忆中没有明显影响,进一步提示rUCCAO诱导的SIVD能够特异性损伤白质及其相关脑区。
肌肽被认为是组氨酸的“储库”,可以通过肌肽—组氨酸—组胺代谢合成组胺,作用于中枢神经系统的组胺H3受体,减轻大鼠肾缺血/再灌注损伤[6,8]。本研究发现肌肽能够明显提高rUCCAO诱导后敞箱实验中小鼠在中间区域的探索时间。肌肽(200、500 mg·kg-1)对恐惧记忆实验中小鼠背景记忆能力和水迷宫实验中小鼠的学习记忆能力有明显的保护作用,肌肽高剂量750 mg·kg-1对上述学习记忆没有作用,但是有研究发现肌肽750 mg·kg-1对急性脑缺血引起的动物行为学和神经元损伤有明显保护作用[10],本实验结果提示慢性缺血引起的白质损伤导致的SIVD疾病在发病机制方面和急性的缺血有着明显的不同,因此在使用药物治疗时应区别急性脑缺血治疗药物的使用方法和剂量。我们的结果显示低剂量肌肽对SIVD诱导的动物认知功能障碍有明显的保护,提示肌肽对于治疗SIVD存在潜在的临床价值。
综上,本实验首次发现,肌肽对rUCCAO诱导的SIVD动物的认知功能具有明显的保护作用,结果提示肌肽对于SIVD有着潜在的治疗作用。
参考文献:
[1] Burns A.Alzheimer′s disease:on the verges of treatment and prevention[J].Lancet Neurol,2009,8(1):4-5.
[2] Kalaria R N,Maestre G E,Arizaga R,et al.Alzheimer′s disease and vascular dementia in developing countries:prevalence,management,and risk factors[J].Lancet Neurol,2008,7(9):812-26.
[3] Olivares D,Deshpande V K,Shi Y,et al.N-Methyl D-Aspartate(NMDA)receptor antagonists and memantine treatment for alzheimer′s disease,vascular dementia and parkinson′s disease[J].Curr Alzheimer Res,2012,9(6):746-58.
[4] Alvarez-Sabin J,Roman G C.Citicoline in vascular cognitive impairment and vascular dementia after stroke[J].Stroke,2011,(1 Suppl),42:S40-3.
[5] Pantoni L.Treatment of vascular dementia:evidence from trials with non-cholinergic drugs[J].JNeurol Sci,2004,226(1-2):67-70.
[6] 宋文婷,徐 立,刘建勋.脑缺血后谷氨酸及其受体介导的神经细胞损伤及相关药物研究进展[J].中国药理学通报,2012,28(6):747-50.
[6] Song W L,Xu L,Liu J X.Review on pathological mechanism of glutamate and its receptors after cerebral ischemia[J].Chin Pharmacol Bull,2012,28(6):747-50.
[7] Adachi N,Liu K,Arai T.Prevention of brain infarction by postischemic administration of histidine in rats[J].Brain Res,2005,1039(1-2):220-3.
[8] Babizhayev M A,Yegorov Y E.Advanced drug delivery of N-acetylcarnosine(N-acetyl-beta-alanyl-L-histidine),carcinine(betaalanylhistamine)and L-carnosine(beta-alanyl-L-histidine)in targeting peptide compounds as pharmacological chaperones for use in tissue engineering,human disease management and therapy:from in vitro to the clinic[J].Recent Pat Drug Deliv Formul,2011,4(3):198-230.
[9] Kurata H,Fujii T,Tsutsui H,et al.Renoprotective effects of lcarnosine on ischemia/reperfusion-induced renal injury in rats[J].J Pharmacol Exp Ther,2006,319(2):640-7.
[10]Shen Y,He P,Fan Y Y,et al.Carnosine protects against permanent cerebral ischemia in histidine decarboxylase knockout mice by reducing glutamate excitotoxicity[J].Free Radic Biol Med,2010,48(5):727-35.
[11]Yoshizaki K,Adachi K,Kataoka S,et al.Chronic cerebral hypoperfusion induced by right unilateral common carotid artery occlusion causes delayed white matter lesions and cognitive impairment in adult mice[J].Exper Neurol,2008,210(2):585-91.
[12]Shibata M,Yamasaki N,Miyakawa T,et al.Selective impairment of working memory in a mouse model of chronic cerebral hypoperfusion[J].Stroke,2007,38(10):2826-32.
[13]Morris R.Development of a water maze procedure for studying spatial learning in the rat[J].J Neurosci Methods,1984,11(1):47-60.
[14]Yang G,Kitagawa K,Matsushita K,et al.C57BL/6 strain is most susceptible to cerebral ischemia following bilateral common carotid occlusion among seven mouse strains:selective neuronal death in the murine transient forebrain ischemia[J].Brain Res,1997,752(1-2):209-18.
[15]Miu A C,Heilman R M,Pasca SP,et al.Behavioral effects of corpus callosum transection and environmental enrichment in adult rats[J].Behav Brain Res,2006,172(1):135-44.

