参麦注射液对大鼠心脏细胞色素P450酶的调节作用
张红曦,王宇光,马增春,梁乾德,肖成荣,谭洪玲,汤响林,董 志,高 月
参麦注射液源自《症因脉治》中的参麦饮,是由等量的人参和麦冬提纯后混合制成的中药注射液,临床用于治疗心力衰竭、冠状动脉粥样硬化、病毒性心肌炎、肺心病、粒细胞减少等症。其中,参麦注射液在心脏方面的临床应用较为广泛,尤其在西药常规治疗的基础上显示了一定的疗效。近年来花生四烯酸细胞色素P450代谢酶与心血管疾病的相关性已有大量报道,提示花生四烯酸的CYP450环氧化物酶代谢物EETs具有心血管保护作用[1-4];而花生四烯酸经细胞色素 P450(CYP450)羟化酶 ω-羟化后,生成的20-羟二十烷四烯酸(20-HETE)在心肌细胞肥大时浓度明显的升高,即CYP羟化酶抑制剂对心脏起到保护作用[4-5]。本文从花生四烯酸细胞色素P450代谢酶方向,应用qPCR的方法探讨了参麦注射液对其的调节作用,从心脏CYP系统探讨参麦注射液对心脏的保护作用。
1 材料
1.1 实验动物 实验用SD大鼠(SPF级),♂,32只,体质量(200±10)g,由解放军军事医学科学院实验动物中心提供,实验动物(饲料)许可证号:SCXK-(军)2007-004;分笼饲养,每笼 4只,保持温度22℃~24℃,湿度60%~65%,自由进食饮水,实验动物实验设施许可证号:SYXK-(军)2007-004。
1.2 主要药品与试剂 参麦注射液(生药含量:红参0.1 g·ml-1,麦冬0.1 g·ml-1)、红参注射液(生药含量:红参0.1 g·ml-1)和麦冬注射液(生药含量:麦冬0.1 g·ml-1)均由正大青春宝药业提供,其中参麦注射液批号:1107201。RNA提取试剂盒为Biomed公司产品;反转录聚合酶链式反应试剂盒为TransGen公司产品,SYBR Green SuperMix为Applied Biosystems公司产品;其他试剂均为国产分析纯。
1.3 主要仪器设备 电子天平(德国Sartorious BS223S),超低温冰箱(Sanyo MDF-U53V),高速低温离心机(Heraeus Labofuge 400R),水浴锅(北京市长风仪器仪表公司 HW·SYII-K),PCR仪[Gene-Amp PCR System 2400(PE Applied Biosystem)];ABI StepOne/StepOnePlus实时荧光定量PCR扩增仪(美国Applied Biosystems公司)。
1.4 动物分组及给药方法 SD大鼠32只随机分为4组,每组8只,分别为空白对照组(Control)、参麦注射液组(SMI)、红参注射液组(HSI)和麦冬注射液组(MDI),以上各组动物均采取腹腔注射的方式分别给予参麦注射液(10 ml·kg-1·d-1)、红参注射液(10 ml·kg-1·d-1)、麦冬注射液(10 ml·kg-1·d-1)、空白对照组给予等量生理盐水,连续14 d,于d 15制取肝微粒体。
2 方法
2.1 大鼠心脏组织总RNA的提取 大鼠处死后迅速取出心脏,置于液氮中保存。按Biomed公司RNA提取试剂盒说明书提取心脏总RNA,取心脏组织50~100 mg,加1 ml裂解液匀浆混匀,在15~30℃条件下孵育5 min,加氯仿200μl,剧烈震荡15 s后室温孵育 3 min,4℃,12 000 r·min-1离心 10 min,将上层水相移入新管中,加入1倍体积的70%乙醇,颠倒混匀。全部转入吸附柱RA中,12 000 r·min-1离心45 s后弃掉废液,加入500μl去蛋白液,12 000 r·min-1离心 45 s后弃掉废液,加入 500 μl漂洗液,12 000 r·min-1离心 45 s后弃掉废液,再次漂洗后13 000 r·min-1离心2 min,取出吸附柱RA,放入一个rNase free离心管中,在吸附膜中间部位加入50~80μl Rnase free water,室温放置2 min,12 000 r·min-1离心1 min。用紫外分光光度计测定 A260/A280比值,用以检测 RNA的纯度,A260/A280比值大于1.7~1.9,可用于下一步的实验。
2.2 实时荧光定量PCR 按TransGen公司一步法逆转录试剂盒说明书进行逆转录实验。取总RNA 1 μg,加入 2×TS Reaction Mix 10μl,TS RT/RI Enzyme Mix 1μl,Anchored Oligo(dT)1μl,加 RNasefree H2O至终体积为20μl并混匀。逆转录的条件为:42℃30 min,85℃5 min。产物在 -20℃ 保存备用。按ABI公司SYBR Green SuperMix试剂盒说明书进行qPCR实验。取转录产物2μl,2×Fast SYBR Green Master Mix 10μl,特异性引物正义链和反义链各0.5μl,加RNase-free H2O至终体积为20μl并混匀,反应条件:起始变性95℃20 s,循环时95℃3 s,60℃30 s进行40个循环,最后熔解曲线95℃15 s,60℃1 min。特异性引物序列见Tab 1
3 结果
利用qPCR检测3个不同的处理组,扩增多种CYP同工酶统计结果见Tab 2。
3.1 参麦注射液及其单药对CYP1家族mRNA表达的影响 从结果看(Fig 1),与空白组相比较参麦注射液组对CYP1A1、CYP1B1 mRNA表达上调,差异具有统计学意义(P<0.01)。

Tab 1 Primer sequence of rat P450 isoenzymes in qPCR reaction analysis

Tab 2 Effects of SMI,HSI and MDI on mRNA expression of CYP isozymes by qPCR
3.2 参麦注射液及其单药对CYP2家族mRNA表达的影响 从结果看(Fig 2),与空白组相比较参麦注射液组对CYP2C11、CYP2E1和CYP2J3 mRNA表达均有明显的上调,差异具有统计学意义(P<0.01),红参注射液组对CYP2B1、CYP2E1 mRNA表达有明显的上调作用,麦冬注射液组对CYP2B1和CYP2C11 mRNA表达有明显的下调(P<0.01)。
3.3 参麦注射液及其单药对CYP4家族mRNA表达的影响 从结果看(Fig 3),除 CYP4A3、CYP4F6外,与空白组相比较参麦注射液组对CYP4家族mRNA表达均有明显的上调,差异具有统计学意义(P<0.01),红参注射液组对 CYP4A3和 CYP4F1 mRNA表达有明显的上调作用(P<0.01),麦冬注射液组对CYP4 F1和CYP4F6 mRNA表达有明显的上调(P<0.01)。
3.4 参麦注射液及其单药对ANP、BNP mRNA表达的影响 从结果看(Fig 4),与空白组相比较参麦注射液组对ANP、BNPmRNA表达有明显的上调,差异具有统计学意义(P<0.01),麦冬注射液组对ANP和BNP mRNA表达有明显的上调(P<0.01),红参注射液组对ANP和BNP mRNA表达与空白组比较未发生改变。

Fig 1 Effects of SMI,HSI and MDI on mRNA expression of CYP 1 subfamily in rat hearts(¯x±s,n=8)
3.5 参麦注射液及其单药对 EPHX2mRNA表达的影响 从结果看(Fig 5),与空白组相比较参麦注射液组、红参注射液和麦冬注射液对EPHX2mRNA表达均有上调,差异具有统计学意义(P<0.01)。
4 讨论
参麦注射液已成为中医临床常用注射剂,在心血管疾病、糖尿病、血液疾病等多种临床疾病中广泛应用。赵敏等[6]证实,参麦注射液对大鼠局灶性脑缺血损伤有一定的保护作用;同时[7]研究显示,参麦注射液有对抗大鼠心肌缺血/再灌注性心律失常作用;参麦注射液在改善急性心肌梗死大鼠心功能、左室重构作用方面也具有明显作用[8]。本文以心脏P450酶为考察指标,探索参麦注射液对心脏细胞色素P450酶mRNA表达的影响,为深入研究参麦注射液心脏保护作用新的可能途径提供线索。
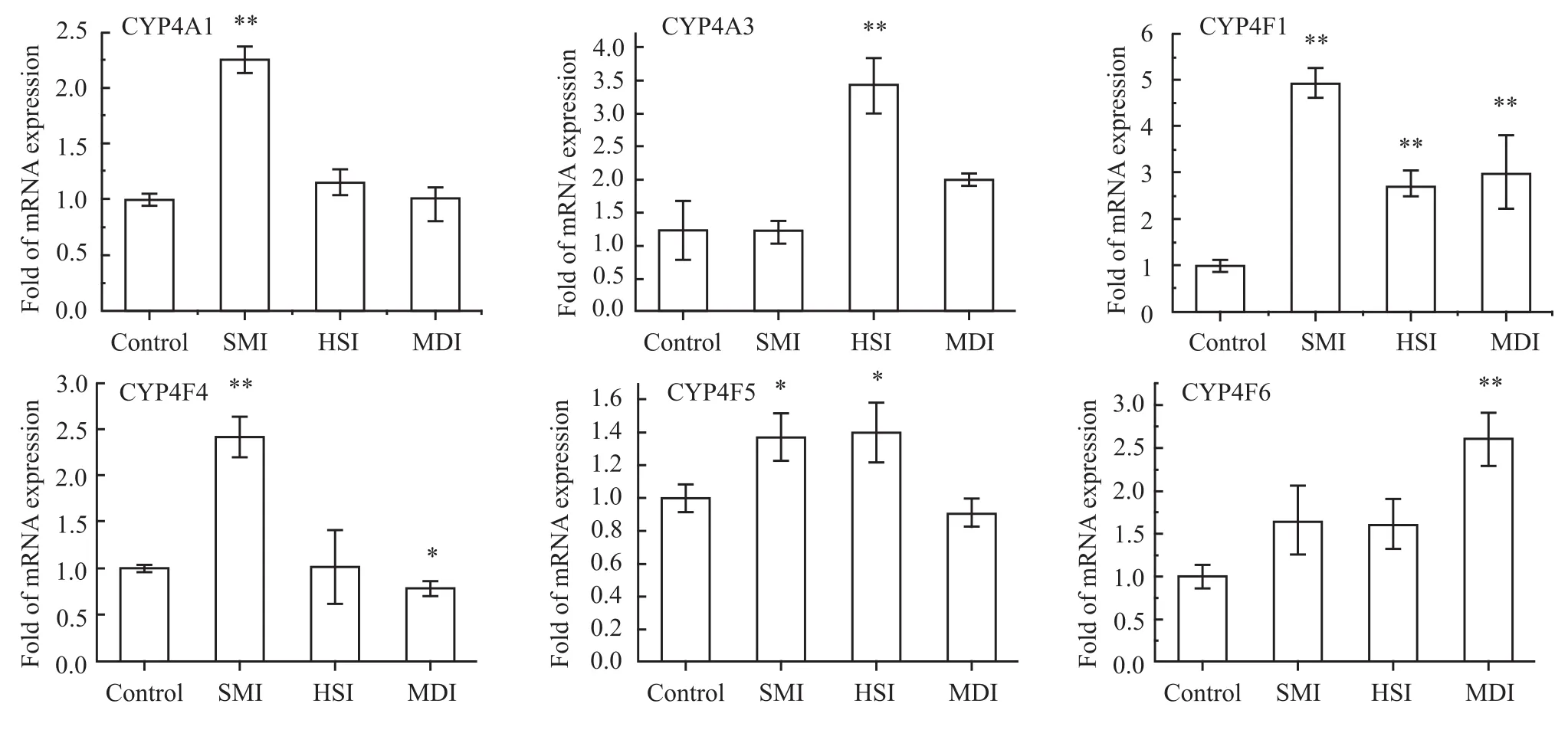
Fig 3 Effects of SMI,HSI and MDI on mRNA expression of CYP 4 subfamily in rat hearts(¯x±s,n=8)

Fig 4 Effects of SMI,HSI and MDI on mRNA expression of ANP and BNP in rat hearts(¯x±s,n=8)
细胞色素P450酶(cytochrome P450,CYP450)是人体最重要的代谢酶,参与生物体内源性物质(如类固醇激素、花生四烯酸等)和外源性物质(如药物、环境致癌物等)的生物转化[9]。花生四烯酸(AA)通过CYP途径可产生两类二十烷酸:经CYP表氧化酶代谢产生表氧-二十碳三烯(epoxyeicosatrienoicacid,EETs),包括 5,6-、8,9-、11,12-、14,15-EET 4种异构体;经CYPω-羟化酶代谢为羟-二十烷 四 烯 酸 ( hydroxyeicosatetraenoicacid,HETEs)。EETs作为内皮衍生的超级化因子主要成分,其具有的扩张血管、抗血栓纤溶和促缺血组织血管形成等作用,已证实在治疗心脑缺血性疾病中有明显疗效。而HETE具有的缩血管则有加重疾病的可能。因此本文选择与心血管疾病密切相关的CYP亚型,探讨参麦注射液对上述亚型的影响,有助于发现参麦注射液新的作用靶点和探析参麦方的配伍规律。
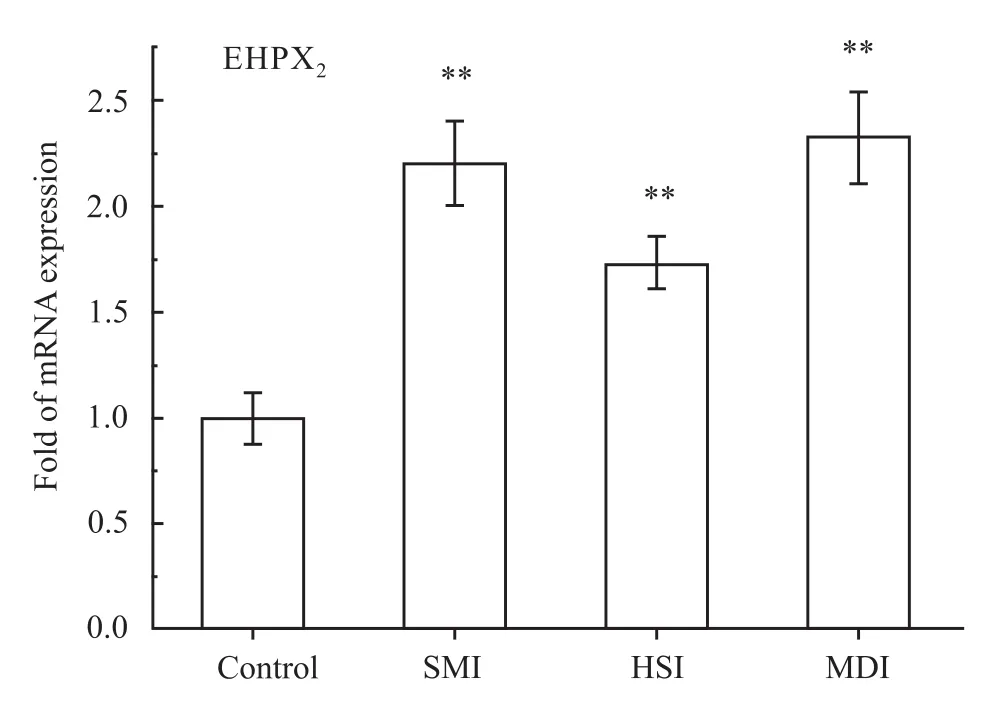
Fig 5 Effects of SMI,HSI and MDI on mRNA expression of EPHX2 in rat hearts(¯x±s,n=8)
本实验主要考察参麦注射液对细胞色素P450酶各亚家族中重要亚型mRNA表达的影响。其中CYP1、4家族是代谢花生四烯酸生成HETEs的主要合成羟化酶,而HETEs具有缩血管作用,与心血管疾病发病密切相关。目前尚未见参麦注射液对CYP1、4家族影响的报道,但是有报道指明AA经CYP4ω-羟化酶代谢所产生的20-HETE会扩大缺血/再灌注损伤[11]。本实验结果显示参麦注射液对CYP1、4家族中除CYP4A3和CYP4F6,其他各亚型具有不同程度的诱导作用,导致花生四烯酸代谢产生的HETE有增加的趋势,进而可能加重心脏损伤。而对于CYP450中最为重要的CYP2家族,有报道显示:CYP2J产生的EETs的心脏保护功能的机制与线粒体KATP通道有关,CYP2C9抑制剂具有心脏保护作用[12]。芦玲巧等[13]研究发现心肌转染重组质粒CYP2J3组能够减少缺血期及再灌注期心肌梗死面积。CYP2J3作为最重要的环氧化物酶,参与代谢花生四烯酸生成EETs,EETs对心肌细胞功能有重要的影响。有研究表明,5,6-EET和11,12-EET能明显增加大鼠心肌收缩力。在离体缺血/再灌注大鼠心脏模型,11,12-EET能明显恢复缺血/再灌注后的心肌收缩力[14-15]。EETs可以上调 eNOS,产生血管舒张效应,在心脏保护方面有明显作用[16]。本实验结果显示参麦注射液对CYP2J3有明显的诱导趋势,进而能增加花生四烯酸代谢成EETs,产生心脏的保护作用。
近年研究发现心房利钠肽(ANP)和脑利钠肽(BNP)在心脏负荷过重或心脏扩大时分泌增加[17],可反映心脏的功能状态。ANP和BNP同属利钠肽家族,都具有利钠、利尿、舒张血管作用,在心功能不全时可拮抗交感神经、抗利尿激素和肾素-血管紧张素-醛固酮系统等神经内分泌因素的过度激活,从而起到维护心功能的作用[18]。本实验显示,参麦注射液对ANP、BNP均呈明显诱导作用,其水平的上调有助于增强心脏的功能。
可溶性环氧化酶水解酶(soluble epoxide hydrolase,sEH)是EETs代谢的主要酶类之一,可将EETs代谢为生物活性明显减弱的二羟基-20碳三烯酸(dihydroxyicosatrienoic acids,DHET)。本实验结果显示参麦注射液对sEH基因(EPHX2)有明显上调的作用,可能造成EETs转化,心脏保护活性减弱。
综合实验结果发现,红参注射液对CYP2B1具有诱导的作用,但麦冬注射液对其表现出的明显的抑制作用,参麦注射液对CYP2B1的作用虽然没有统计学意义,但具有诱导的趋势,提示红参注射液对CYP2B1的诱导作用可能强于麦冬注射液的抑制作用。参麦注射液对CYP2E1、CYP4F1和EHPX2的诱导,同时显示红参注射液与麦冬注射液均对CYP2E1、CYP4F1和EHPX2具有诱导作用,提示参麦注射液对其的诱导作用可能由复方中的红参和麦冬共同贡献。参麦注射液对ANP和BNP均具有诱导的作用,同时麦冬注射液也显示出明显的诱导,提示在对ANP和BNP的作用中麦冬比红参的作用更强。
综上,参麦注射液对CYP450酶的影响与心血管的保护作用是对各亚酶调节的综合反映,参麦注射液对CYP2J3作用明显,在细胞水平上也具有明显的量效关系[19],而对其他亚型作用,特别是CYP4家族的诱导作用弱于CYP2J3,因此CYP2J3产生的心脏保护作用明显强于CYP4家族可能带来的心脏损伤。由于CYP2J3、ANP和BNP等相关分子是心血管的重要靶点,而参麦注射液对心血管疾病疗效明确,因此心脏P450酶系统可能是参麦注射液治疗心血管疾病新的可能途径或靶点,其对 CYP2J3、ANP和BNP诱导作用的分子机制及其与心血管疾病的发生关系有待进一步研究。
参考文献:
[1] 詹同运,石 磊,赵树进.CYP2J2*7 SNP与心血管疾病相关性的研究现状[J].生物学杂志,2011,8(4):81-3.
[1] Zhan T Y,Shi L,Zhao S J.Overview on the relationship between CYP2J2*7 SNPand cardiovascular disease.[J].J Biol,2011,8(4):81-3.
[2] Yu G G,Zeng X J,Wang H X,et al.Cytochrome P450 2J3/epoxyeicosatrienoic acids mediate the cardioprotection induced by ischaemic post-conditioning,but not preconditioning,in the rat[J].Clin Exp Pharmacol Physiol,2011,38(1):63-70.
[3] 魏秋华.细胞色素P-450:心脏和冠脉循环中的新靶标[J].国外医学·药学分册,2006,33(2):104-6.
[3] Wei Q H.CytochromeP450:the new target of heart and coronary circulation[J].Fore Med Sci·Sect Pharm,2006,33(2):104-6.
[4] lbekai R H,El-Kadi A O.Cytochrome P450 enzymes:Central players in cardiovascular health and disease[J].Pharmacol Therapeutics,2006,112:564-87.
[5] Zordoky B N,El-Kadi A O.Modulation of cardiac and hepatic cytochrome P450 enzymes during heart failure[J].Current Drug Metabolism,2008,9:122-8.
[6] 赵 敏,付轮姣,陈少彬.参麦注射液对大鼠局灶性脑缺血的保护作用[J].华南国防医学杂志,2012,26(3):212-5.
[6] Zhao M,Fu L J,Chen S B.Protection effects of shenmai injection on focal cerebral ischemia in rats[J].Military Med J South China,2012,26(3):212-5.
[7] 李 萍,熊 凡,富 青,等.参麦注射液对抗大鼠心肌缺血/再灌注性心律失常作用[J].中国医院药学杂志,2005,25(9):815-7.
[7] Li P,Xiong F,Fu Q,et al.Effect of Shenmai injection on arrhythmia rats with myocardial ischemia-reperfusion injury and the expression of heat shock protein[J].Chin J Hosp Pharmacy,2005,25(9):815-7.
[8] 陈彦静.参麦注射液改善急性心肌梗死大鼠心功能、左室重构作用及其机制的研究[D].北京中医药大学,2005.
[8] Chen Y J.The effects and mechanism of Shenmai injection on left ventricular function and remodeling in acute myocardial infarction rats[D].Beijing University of Chinese Medicine,2005.
[9] Omura T.Recollection of the early years of the research on cytochrome P450[J].Proc Jpn Acad Ser B Phs Biol Sci,2011,87(10):617-40.
[10]Granville D J,Tashakkor B,Takeuchi C,et al.Reduction of ischemia and reperfusion-induced myocardial damage by cytochrome P450 inhibitors[J].Proc Natl Acad Sci USA,2004,101(5):1321-6.
[11]Chaudhary K R,Batchu SN,Seubert JM.Cytochrome P450 Enzymes and the heart[J].IUBMBLife,2009,61(10):954-960.
[12]李 彬,朱照静.心脏不同细胞色素P450亚型的作用机制[J].中国药师,2007,10(2):169-70.
[12]Li B,Zhu Z J.Mechanism of different heart cytochrome P450 isoforms[J].China Pharmacist,2007,10(2):169-70.
[13]芦玲巧,于刚刚,张冬梅,等.cyp2j3基因转染对在体大鼠心肌缺血/再灌注损伤的影响[J].首都医科大学学报,2011,32(2):234-8.
[13]Lu L Q,Yu G G,Zhang D M,et al.The effects of cyp2j3 gene transfection on myocardial ischemia-reperfusion injury in rats in vivo[J].J Capital Med Univ,2011,32(2):234-8.
[14]张立克,唐朝枢.细胞色素P450/环氧-二十碳三烯酸系统与心肌缺血/再灌注损伤[J].中国医学科学院学报,2005,27(4):539-42.
[14]Zhang L K,Tang CS.Cytochrome P450/Epoxyeicosatrienoic acids system and myocardial ischemic-repefusion injury[J].Acta Acad Med Sin,2005,27(4):539-42.
[15]郝 刚,王红霞,芦玲巧,等.11,12-EET对在体大鼠正常及再灌注心肌 JNK1/JNK2表达的影响[J].中国药理学通报,2005,21(4):424-6.
[15]Hao G,Wang H X,Lu L Q,et al.Effects of 11,12-EET on the expression of phophorylated JNK1/JNK 2 in ischem ic and reperfusion rat heart[J].Chin Pharmacol Bull,2005,21(4):424-6.
[16]蒋建刚,陈积雄,王 红,等.内外源性EETs对血管内皮一氧化氮合酶的表达及其在Thr-495位磷酸化的作用[J].中国药理学通报,2004,20(4):462-7.
[16]Jiang J G,Chen J X,Wang H,et al.The effects of exogenous and endogenous epoxyeicosatrienoic acids on the expression of endothelial nitric oxide synthase and its phosphorylation at Thr-495[J].Chin Pharmacol Bull,2004,20(4):462-7.
[17]赵雪燕,杨跃进,张 健,等.心力衰竭患者N末端A、B及C型利钠肽原与超声心动图和心功能对比分析[J].中华心血管病杂志,2009,37(6):486-90.
[17]Zhao X Y,Yang Y J,Zhang J,et al.Association of plasma aminoterminal pro-A-,B-and C-type natriuretic peptide levels with NYHA grade and echocardiographic derived parameters of cardiac function in heart failure patients[J].Chin J Cardiol,2009,37(6):486-90.
[18]Kerr A J,Raffel OC,Whalley GA,et al.Elevated B-type natriu reticpeptide despite normal left ventricular function on rest and exercisestress echocardiography in mitral regurgitation[J].Eur Heart J,2008,29(3):363-70.
[19]苏 萍,吕书峰,范雪梅,等.参麦注射液及其有效组分对H2O2诱导心肌细胞损伤的保护作用[J].中成药,2011,33(12):2150-3.
[19]Su P,LüSF,Fan X M,et al.The protection of Shenmai injection and active componet on the injury of cardiomyocyte by H2O2[J].Chin Tradit Patent Med,2011,33(12):2150-3.

