栀子苷与栀子柏皮汤中栀子苷在MDCK细胞跨膜转运模型上的转运研究
韩静文,李 俊,黄 成,陈昭琳,胡婷婷
栀子柏皮汤始载于汉代名医张仲景的《伤寒论》,由栀子、黄柏和炙甘草3味药材组成,用于治疗湿热发黄、热重于湿之阳黄症[1]。栀子苷是栀子的主要有效成分,药典(2010版)规定栀子苷为栀子的质量控制指标,具有保肝利胆、镇痛、抗炎、抗肿瘤、抗焦虑等作用[2]。然而,有研究表明,栀子苷口服生物利用度较差[2-3],限制了其在临床的应用。为了提高栀子苷的口服生物利用度,我们有必要对其吸收和转运特性进行研究,在此基础上进一步探讨栀子柏皮汤对其吸收的影响。
药物的跨膜转运是药物体内过程的前提,也是其发挥活性所必需,贯穿药物在体内的整个过程,研究药物的跨膜转运对提高药物的生物利用度和药效具有重要意义。目前应用最广泛的体外药物吸收模型是人结肠癌细胞(Caco-2)和马丁达比犬肾上皮细胞(Madin-Darby canine kidney,MDCK)模型,两者在研究药物的吸收渗透方面具有良好的相关性,但相比于Caco-2细胞,MDCK具有生长快的优势,形成完整单层仅5 d左右,细胞亚型少,膜表面受体的种类和数量均大大少于Caco-2细胞,这种简单性使MDCK细胞模型的实验结果重现性高[4-5]。目前利用MDCK细胞模型对栀子苷及栀子柏皮汤中栀子苷的转运研究还未见报道。
本实验建立了MDCK细胞跨膜转运模型,以HPLC为检测方法来考察栀子苷的转运方式,同时比较栀子苷与栀子柏皮汤中栀子苷吸收转运的差异。
1 材料
1.1 药品与试剂 栀子苷(批号:110749-200714)、芍药苷(内标,批号:110736-200320)、盐酸维拉帕米(批号:100223-200102)对照品均购自中国药品生物制品检定所;栀子、黄柏和炙甘草均购自安徽医科大学第一附属医院药剂科,质量符合中国药典(2010版)标准;甲醇(色谱纯,美国Tedia公司);冰乙酸(分析纯,国药集团化学试剂有限公司);水为双蒸水;Hank’s溶液(HBSS,碧云天公司);MEM培养液(Hyclone公司);EDTA(国药集团化学试剂有限公司);胎牛血清(FBS,杭州四季青公司)。
1.2 仪器 Agilent 1200高效液相色谱仪(美国安捷伦公司);Neofuge 23R台式高速冷冻离心机(力康发展有限公司);FA2004N分析天平(上海精密科学有限公司);ROIS5 30L超纯水机(美国Millipore公司);悬挂式培养皿(Millicell-CPI);细胞电压电阻仪(Millicell-ERS)(美国Millipore公司);Napco-6100型细胞培养箱(美国杜邦公司);MK3型酶标仪(荷兰雷勃公司)。
1.3 细胞株 MDCK细胞株(American Type Culture Collection,ATCC)由浙江工业大学宋必卫教授惠赠。
2 方法
2.1 细胞单层模型的建立 MDCK细胞按密度5×104·cm-2接种到 24孔 Millicell CPI中,在 A侧加入含10%FBS的MEM培养液0.2 ml,B侧加入0.8 ml,置于37℃,5%CO2培养箱中培养。用Millicell-ERS测跨细胞单层膜电阻(TEER),选取TEER>140Ω·cm2的细胞单层用于转运实验[5]。
2.2 汤剂的制备 按栀子柏皮汤方中栀子、黄柏、炙甘草重量比10∶6∶3称取药材,混合碾碎后,蒸馏水煮沸,20 min,提取3次,合并滤液,20层纱布滤过,得上清液,浓缩至合适体积,即得栀子柏皮汤。取适量用HBSS稀释,离心,过滤,经HPLC分析,汤剂中栀子苷的含量为3.38 g·L-1。
2.3 色谱条件 色谱柱为Shimadzu Shim-pack VPODScolumn(250 mm×4.6 mm,5μm);流动相:甲醇-0.1%冰乙酸水溶液(32∶68);流速:1.0 ml·min-1;检测波长:238 nm;进样量:20μl;柱温:30℃。
2.4 样品处理 取样品溶液100μl,加入内标芍药苷溶液20μl,涡旋,12 000 r·min-1离心 3 min,吸取上清液,进样。
2.5 溶液的配制 精密称取栀子苷和芍药苷对照品1 mg,用甲醇定容在10 ml容量瓶中,得到栀子苷和芍药苷储备液0.1 g·L-1。
2.6 细胞毒性试验
2.6.1 溶液的配制 精密称取栀子苷对照品适量,用含10%FBS的MEM培养液溶解并稀释成系列溶液,使浓度分别为 1、10、20、40、80、100、200 mg·L-1,量取栀子柏皮汤适量,稀释成含栀子苷浓度同上的系列溶液。
2.6.2 MTT法 将细胞以每孔5×103个的密度接种至96孔板中,每孔加入0.2 ml细胞悬液,于37℃,5%CO2培养箱中培养16 h后,吸除每孔培养液,给药孔分别加入“2.6.1”项下系列溶液各200 μl,空白对照孔不加药,调零孔不加细胞,只加含10%FBS的MEM培养液,每个实验组设5个复孔,培养 24 h后,每孔加入5 g·L-1的 MTT 20μl,继续培养4 h,培养结束后,吸去上清液,加入DMSO 150 μl,振荡10 min,用酶标仪在492 nm处测其吸光度(A),结果用存活率(IC)表示:IC/% =(实验组 A均值-调零孔A均值)/(对照孔A均值-调零孔A均值)×100%。选取细胞存活率≥90%的药物浓度用于转运实验。
2.7 药物的跨膜转运实验
2.7.1 转运实验方法 取符合转运条件的细胞单层,HBSS清洗2遍,37℃培养30 min,测 TEER后加药。CPI的 A侧(肠腔侧,Apical)到 B侧(基底侧,Basolateral)的转运(吸收实验):A侧分别加入0.2 ml不同浓度的药物溶液,B侧加入0.8 ml HBSS,培养箱中培养,分别于 30、60、90、120 min时间点从B侧取样0.1 ml,并补充同体积空白HBSS。CPI的B侧到A侧的转运(分泌实验):B侧分别加入0.8 ml不同浓度的药物溶液,A侧加入0.2 ml HBSS,其他如上所述,每组试验平行3份,试验结束时再测TEER,以确定细胞单层没有被损伤而影响实验结果。样品按“2.4”项处理后进行含量测定,求累积透过量,并计算表观渗透系数(Papp)。Papp=(dQ/dt)/(A×Co),式中 dQ/dt代表单位时间药物转运量(μg·s-1);A代表 Millicell膜面积,本实验中 A为0.33 cm2;C0代表药物初浓度(mg·L-1)。
2.7.2 栀子苷的双向跨膜转运 精密称取栀子苷1 mg,用HBSS溶解稀释至浓度分别为20、40、80 mg·L-1,作为药物溶液,按“2.7.1”项方法操作。
2.7.3 P-gp抑制剂维拉帕米对栀子苷跨膜转运的影响 配制50μmol·L-1的维拉帕米溶液和40 mg·L-1的栀子苷溶液,先吸取适量维拉帕米溶液加至CPI膜的A侧,置培养箱中孵育30 min,再吸除A侧的维拉帕米溶液,同时加HBSS荡洗细胞表面2次,最后加上述栀子苷溶液于A侧,按“2.7.1”项方法操作。
2.7.4 EDTA对栀子苷跨膜吸收的影响 配制2.5 mmol·L-1的 EDTA溶液和40 mg·L-1的栀子苷溶液,然后按“2.7.3”项操作,将维拉帕米换为EDTA。
2.7.5 栀子柏皮汤中栀子苷的吸收 量取栀子柏皮汤适量,用HBSS稀释至含栀子苷浓度分别为20、40、80 mg·L-1,作为药物溶液,按“2.7.1”项中 A侧到B侧转运实验方法操作。
2.8 统计学分析 测定值以¯x±s表示,数据采用SPSS 16.0软件进行统计学处理,组间比较采用One-Way ANOVA检验。
3 结果
3.1 方法学考察
3.1.1 专属性试验 空白HBSS、HBSS加栀子苷和内标对照品、栀子苷转运样品和栀子柏皮汤转运样品的色谱图见Fig 1,空白HBSS不干扰测定。
3.1.2 线性关系的考察 取栀子苷贮备液适量,用HBSS稀释并配制成浓度分别为 0.25、0.5、1、5、10、20、40 mg·L-1的对照品溶液,按“2.4”项下方法处理后进样,测定峰面积,以栀子苷浓度为横坐标,栀子苷的与内标的峰面积比为纵坐标,绘制标准曲线,得标准曲线 Y=0.5010X+0.0463,r=0.9999。结果显示,栀子苷在质量浓度0.25~40 mg·L-1内与峰面积之间呈良好线性关系。
3.1.3 精密度与准确度 取栀子苷贮备液适量,用HBSS配制成低、中、高 3个浓度(0.5、5、20 mg·L-1)的质控样品(n=5),按“2.4”项下方法处理后进样,1 d内连续测定5次,计算日内精密度,连续测定5 d,计算日间精密度,结果日内RSD值分别为1.90%、1.35%、1.69%、日间 RSD值分别为2.96%、1.86%、1.51%,符合小于10%的要求。准确度分别为94.83%、103.56%、99.60%,符合85%~115%的要求。
3.1.4 稳定性试验 同上配制低、中、高浓度(0.5、5、20 mg·L-1)的质控样品(n=5),对在室温放置24 h,在-20℃条件下存放15 d的稳定性进行考察,按“2.4”项下方法处理后进样,测定栀子苷的浓度,RSD值分别为 4.86%、2.56%、2.12%;2.78%、1.75%、2.01%,均小于5%,符合要求。

Fig 1 HPLC chromatograms of blank HBSS(A),HBSSwith geniposide and paeoniflorin(B),geniposide samples(C),Zhizi Bopi Decoction samples(D)
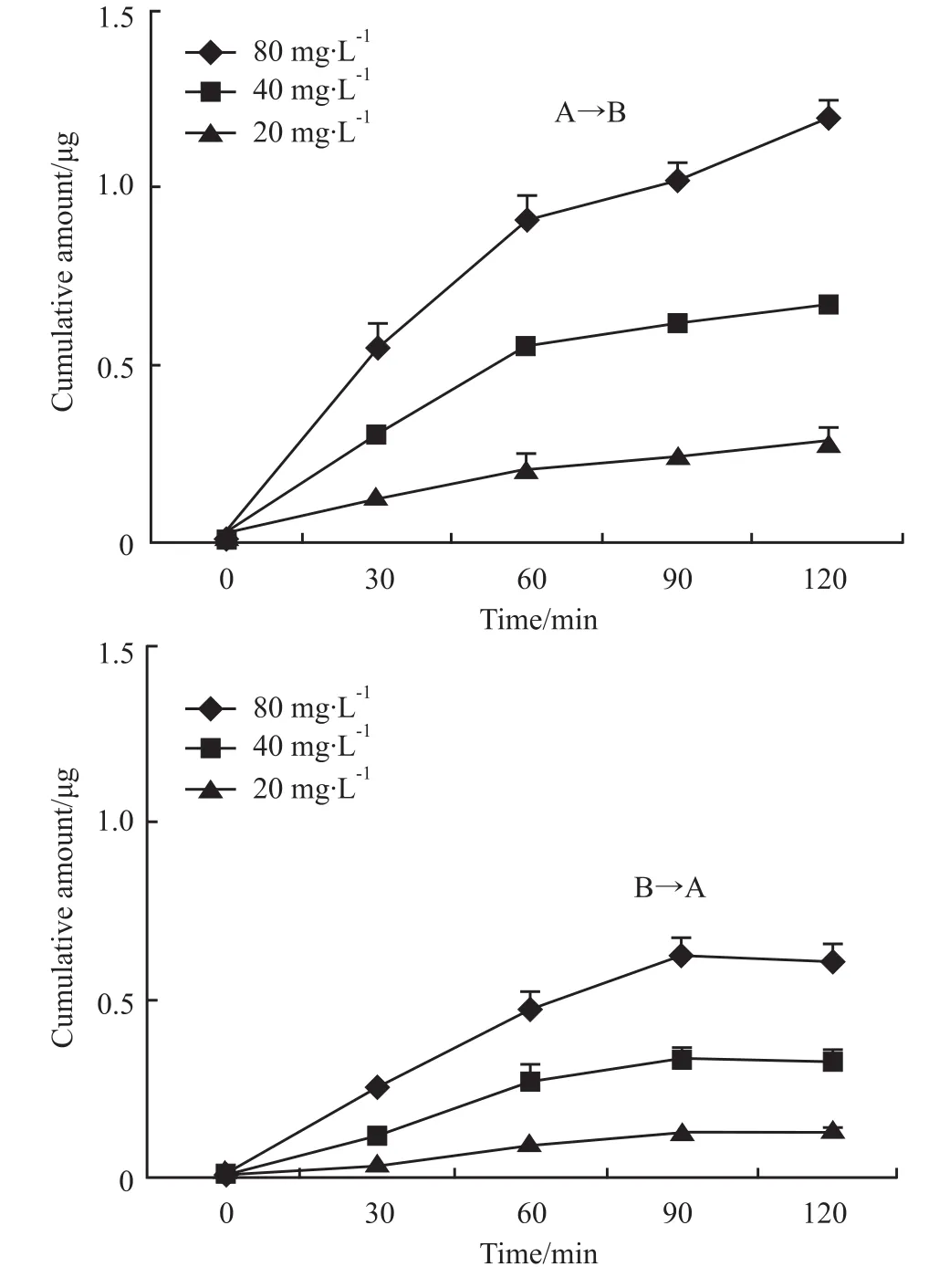
Fig2 Cumulativeamount-timecurveofgeniposide inMDCKcellmodel(A→BandB→A,¯x±s,n=3)
3.2 栀子苷的双向跨膜转运 Fig 2是不同浓度的栀子苷在MDCK模型上由A侧到B侧和由B侧到A侧的累积透过量随时间变化的曲线,由图可知栀子苷的累积透过量随时间延长逐渐增加,且与给药室的初始浓度呈正相关。双向转运的Papp值见Tab 1,由 Tab1可知,栀子苷的 Papp(B-A)与 Papp(A-B)不随浓度的增加而升高,且比值均小于1.5,表明被动扩散为主要机制。

Tab1 EffectsofconcentrationonthePappofgeniposide(¯x±s,n=3)
3.3 维拉帕米对栀子苷跨膜转运的影响 加入维拉帕米后栀子苷的 Papp(A-B)为(6.79 ±0.10)×10-7cm·s-1,Papp(B-A)为(3.27±0.21)×10-7cm·s-1,而不加时 Pappc(A-B)为(6.88±0.38)×10-7cm·s-1,Papp(B-A)为(3.42±0.10)×10-7cm·s-1,无明显改变(P>0.05),表明栀子苷的跨膜转运不会受到P-gp的影响。
3.4 EDTA对栀子苷跨膜吸收的影响 由Tab2可知,加入EDTA后栀子苷的Papp(A-B)值明显变大,表明EDTA能明显增加栀子苷的跨膜吸收。
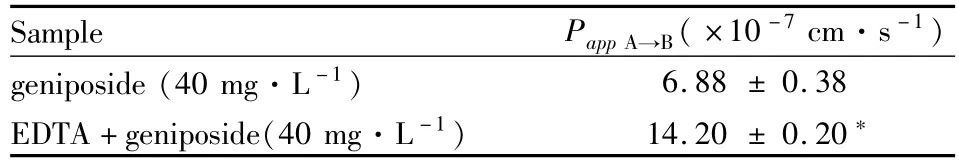
Tab2 EffectsofEDTAonthePappofgeniposide(¯x±s,n=3)
3.5 栀子柏皮汤中栀子苷的吸收 栀子柏皮汤中栀子苷的吸收Papp(A-B)值与相同浓度栀子苷的比较见Tab3,由Tab3可知,栀子柏皮汤中栀子苷的Papp(A-B)明显大于相同浓度的栀子苷,表明该复方能促进栀子苷的吸收。

Tab3 Papp(A→B)ofgeniposideandgeniposideinZhiziBopiDecoction(¯x±s,n=3)
4 讨论
本实验考察了栀子苷在MDCK细胞模型上的转运方式,结果表明,栀子苷为被动扩散,与栀子苷在体肠吸收报道一致[6],有研究发现MDCK细胞在研究以被动扩散方式经肠吸收的药物时,预测吸收能力上相对于Caco-2细胞略占优势[5]。药物的Papp与其口服吸收密切相关,吸收较差的药物,其Papp小于 1×10-6cm·s-1[7],本实验发现栀子苷的 Papp值均小于1×10-6cm·s-1,说明栀子苷口服吸收较差,与体内实验的报道一致[3]。
细胞外Ca2+浓度的大小很大程度上会改变该细胞的紧密结构,若Ca2+减少,细胞会开始松弛,若低Ca2+浓度吋间较长,该松弛现象变得不可逆转,EDTA可以结合 Ca2+,减少细胞外 Ca2+浓度,使细胞松弛,能增加通过细胞旁路转运的药物的渗透量,通常用其考察药物的转运方式是否包含细胞旁路转运[8],结果提示,栀子苷可能包括细胞旁路转运。
通过对相同浓度的栀子苷单体和栀子柏皮汤中栀子苷的吸收差异的比较,发现栀子柏皮汤中栀子苷的吸收渗透能力明显大于栀子苷单体,说明该复方中其他成分与栀子苷之间存在协同作用,促进了栀子苷的吸收,推测栀子柏皮汤中栀子苷的吸收比栀子苷单体口服给药吸收更好。
中药成分的复杂性是制约中药现代化发展的重要原因之一,目前应用细胞模型研究中药体外吸收特征主要以研究单体化合物多见,中草药或中药复方的体外研究只有少量报道[9-10],本实验在系统考察栀子苷在MDCK细胞模型的转运方式的同时比较了栀子苷单体与栀子柏皮汤中栀子苷的转运的差异,为中药体系的活性物质体外研究提供了一个途径。
参考文献:
[1] 吴 梅,张 浩,李 容.HPLC测定栀子柏皮汤中甘草次酸的含量[J].华西药学杂志,2006,21(4):399-400.
[1] Wu M,Zhang H,Li R.Determination of glycyrrhetinic acid in Zhizi Baipi soup by HPLC[J].West Chin J Pharm Sci,2006,21(4):399-400.
[2] 刘益华,李 晶,林曼婷,等.栀子有效成分栀子苷的现代研究进展[J].中国药学杂志,2012,47(6):406-9.
[2] Liu Y H,Li J,Lin M T,et al.Modern research progress of geniposide[J].Chin Pharm J,2012,47(6):406-9.
[3] Lu Y,Du SY,Bai J,et al.Bioavailability and brain-targeting of geniposide in gardenia-borneol co-compound by different administration routes in mice[J].Int J Mol Sci,2012,13(11):14127-35.
[4] Mitchell E,Lisbeth K,Sven F.Optimized conditions for MDCK permeability and turbidimetric solubility studies using compounds representative of BCSclassesⅠ-Ⅳ [J].Pharm Sci,2002,15(4):331-40.
[5] 葛建丹,陈 媚,宋必卫.绿原酸跨细胞转运机制研究[J].中国药理学通报,2009,25(8):1094-8.
[5] Ge J D,Chen M,Song B W.Transcytosis mechanism of chlorogenic acid across cell monolayer model[J].Chin Pharmacol Bull,2009,25(8):1094-8.
[6] 杜先华,牛 欣,冯前进,等.栀子苷大鼠在体肠吸收动力学的研究[J].华西药学杂志,2008,23(5):558-60.
[6] Du X H,Niu X,Feng Q J,et al.Study on absorption kinctics of geniposide in rat intestines[J].West Chin J Pharm Sci,2008,23(5):558-60.
[7] Trapani G,Franco M,Trapani A,et al.Frog intestinal sac:a new in vitro method for the assessment of intestinal permeability[J].J Pharm Sci,2004,93(12):2909-19.
[8] Zumdick S,Deters A,Hensel A.In vitro intestinal transport of oligomeric procyanidins(DP 2 to 4)across monolayers of Caco-2 cells[J].Fitoterapia,2012,83(7):1210-7.
[9] 吴安国,曾 宝,王春玲,等.HPLC考察小檗碱和黄连提取物中小檗碱在 Caco-2细胞模型的转运[J].中国药理学通报,2011,27(7):1007-11.
[9] Wu A G,Zeng B,Wang CL,et al.Transport of berberine as single compound and berberine in extract in Caco-2 cell model[J].Chin Pharmacol Bull,2011,27(7):1007-11.
[10]Zheng K Y,Choi R C,Guo A J.The membrane permeability of Astragali Radix-derived formononetin and calycosin is increased by Angelicae Sinensis Radix in Caco-2 cells:A synergistic action of an ancient herbal decoction Danggui Buxue Tang[J].J Pharm Biomed Anal,2012,70:671-9.

