维拉帕米通过阻断钙离子内流抑制血管平滑肌细胞钙化研究
李同妙,徐金升,冯 雨,张胜雷,张俊霞,崔立文,张慧然
·论著·
维拉帕米通过阻断钙离子内流抑制血管平滑肌细胞钙化研究
李同妙,徐金升,冯 雨,张胜雷,张俊霞,崔立文,张慧然
目的 探讨维拉帕米抑制高磷诱导大鼠血管平滑肌细胞(VSMCs)钙化的作用及可能机制。方法 2014年12月—2015年6月选取5~8周龄清洁级健康雄性SD大鼠6只,体外分离培养大鼠VSMCs,采用免疫组化法鉴定。将对数期VSMCs随机分为正常对照组〔含10%胎牛血清(FBS)培养基〕、高磷组(高磷培养基,含10 mml/L β-甘油磷酸)、维拉帕米干预组(在高磷培养基的基础上加入维拉帕米至浓度为20 mmol/L)。细胞接受2、4、6 d干预后,检测VSMCs内钙离子水平,采用反转录-聚合酶链反应(RT-PCR)检测VSMCs内目的基因(smad1、runx2 mRNA)表达水平。细胞接受14 d干预后进行钙化检测,包括钙水平测定和茜素红染色情况。结果 高磷组、维拉帕米干预组2、4、6 d后VSMCs内钙离子水平均高于正常对照组(P<0.05);维拉帕米干预组2、4、6 d后VSMCs内钙离子水平均低于高磷组(P<0.05)。高磷组、维拉帕米干预组4、6 d后VSMCs内钙离子水平分别高于2 d后(P<0.05);高磷组6 d后VSMCs内钙离子水平高于4 d后(P<0.05);维拉帕米干预组6 d后VSMCs内钙离子水平低于4 d后(P<0.05)。高磷组、维拉帕米干预组2、4、6 d后VSMCs内smad1、runx2 mRNA表达水平均高于正常对照组(P<0.05);维拉帕米干预组2、4、6 d后VSMCs内smad1、runx2 mRNA表达水平均低于高磷组(P<0.05)。高磷组4、6 d后VSMCs内smad1、runx2 mRNA表达水平分别高于2 d后,6 d后VSMCs内smad1、runx2 mRNA表达水平分别高于4 d后(P<0.05);维拉帕米干预组4 d后VSMCs内smad1 mRNA表达水平高于2 d后,runx2 mRNA表达水平低于2 d后,6 d后VSMCs内smad1、runx2 mRNA表达水平均高于2、4 d后(P<0.05)。高磷组、维拉帕米干预组VSMCs钙水平均高于正常对照组(P<0.05);维拉帕米干预组VSMCs钙水平低于高磷组(P<0.05)。高磷组、维拉帕米干预组橘红色钙化结节较正常对照组多,维拉帕米干预组橘红色钙化结节较高磷组少。结论 维拉帕米在高磷诱导的VSMCs钙化中起抑制作用,其可能是通过抑制钙离子内流进而抑制smad1表达,进一步抑制runx2表达,进而抑制VSMCs发生表型转化来实现的。
维拉帕米;肌细胞,平滑肌;血管钙化;钙通道
李同妙,徐金升,冯雨,等.维拉帕米通过阻断钙离子内流抑制血管平滑肌细胞钙化研究[J].中国全科医学,2015,18(27):3294-3299.[www.chinagp.net]
Li TM,Xu JS,Feng Y,et al.Inhibition of the calcification of vascular smooth muscle cells by verapamil though the blocking of the inward flow of calcium ion[J].Chinese General Practice,2015,18(27):3294-3299.
心血管疾病是慢性肾脏病(chronic kidney disease,CKD)患者死亡的首位原因,血管钙化与心血管疾病的高发病率密切相关[1]。不同于传统的血管钙化,CKD患者血管钙化主要发生在动脉中膜,血管平滑肌细胞(vascular smooth muscle cells,VSMCs)发生类成骨/成软骨表型转化是血管钙化的重要机制[2]。血管平滑肌的钙离子作为重要的第二信使可以推动血管钙化[3]。维拉帕米作为第一类钙通道阻滞剂,通过阻断钙通道发挥抗动脉粥样硬化、保护血管壁等作用,对心血管系统有显著保护功能[4]。早期动物实验研究表明,维拉帕米可以抑制维生素D诱导的大鼠主动脉钙化[5]。本课题组前期研究发现,维生素K[6]、γ干扰素[7]、镁离子[8]可抑制VSMCs表型转化的发生。本实验以高磷诱导的大鼠VSMCs钙化为模型,维拉帕米为干预因素,探讨维拉帕米抑制血管钙化发生过程中的可能作用和机制,为血管钙化的治疗提供新思路和治疗手段。
1 材料与方法
1.1 材料
1.1.1 实验动物 2014年12月—2015年6月选取5~8周龄清洁级健康雄性SD大鼠6只,体质量80~100 g,由河北医科大学实验动物中心提供,动物合格证标号:1305090。本研究经河北医科大学第四医院伦理委员会批准。
1.1.2 主要试剂和仪器 倒置相差显微镜(LH50A型,日本OLYMPUS公司),酶标仪(CYTATION3型,
本研究创新点:
(1)维拉帕米在临床上多用于治疗高血压、动脉粥样硬化等心血管疾病,在血管钙化方面鲜有报道,本研究发现维拉帕米可以抑制血管钙化发生,是本文一大创新点。
(2)本研究发现,维拉帕米是通过抑制血管平滑肌细胞表型转化来实现其抑制血管钙化作用的。
(3)维拉帕米在血管钙化方面的作用,可能给临床上治疗血管钙化提供新思路,对于有血管钙化和高血压的慢性肾脏病患者而言,或许合理应用维拉帕米可以同时起到治疗高血压和血管钙化的作用。
美国BioTek公司),胎牛血清(FBS,美国GIBCO公司),DMEM培养基(美国GIBCO公司),免疫组化试剂盒(河北博海生物工程开发有限公司),钙水平测定试剂盒(中生北控生物科技股份有限公司),二氨基联苯胺(DAB)显色试剂盒(河北博海生物工程开发有限公司),RNA提取试剂盒、RNA反转录试剂盒(美国Thermo公司),聚合酶链式反应(PCR)仪(ABI5700型,美国ABI公司),PCR引物〔英潍捷基(上海)贸易有限公司〕,钙离子荧光探针Fluo-3/AM(美国Sigma)。
1.2 研究方法
1.2.1 大鼠VSMCs传代培养 大鼠均给予2%戊巴比妥钠腹腔注射麻醉,75%乙醇浸泡后在无菌条件下分离出胸主动脉,剥去外膜,纵向剪开管壁,然后用纱布轻轻擦除内膜,将中膜剪成1 mm×1 mm×1 mm左右的小块,放置在含10% FBS、100 U/ml青霉素及100 μg/ml链霉素的DMEM培养基中,放入37 ℃、5% CO2培养箱中培养。24 h后更换新鲜培养液。此后每隔2~3 d换液1次,倒置相差显微镜下观察细胞生长状况,直至细胞接近80%~90%融合时,用0.25%胰蛋白酶进行消化,传代培养。此后每隔3~4 d传代1次。
1.2.2 细胞鉴定及实验分组 应用倒置相差显微镜观察细胞大小、形态、排列方式和生长特点等。免疫组化染色:在6孔板中采用消毒的盖玻片制作细胞玻片,细胞贴壁生长至60%~70%时,弃去培养基,磷酸盐缓冲液(PBS)洗涤1~2次,爬片用95%乙醇固定30 min,PBS洗涤2次(每次2 min),免疫组化法检测VSMCs特异性抗体α-SMA actin,DAB显色,苏木素复染,经分化、脱水、透明、封片后,倒置相差显微镜下观察,细胞质内见棕黄色免疫产物即可判定为阳性结果,表明细胞传代纯化,为VSMCs。将对数期VSMCs随机分为正常对照组、高磷组、维拉帕米干预组,正常对照组采用含10% FBS培养基培养,高磷组采用高磷培养基(含10 mmol/L β-甘油磷酸)培养,维拉帕米干预组在高磷培养基的基础上加入维拉帕米至浓度为20 mmol/L,此后每隔2 d换液1次。
1.2.3 VSMCs内钙离子水平测定 按照文献[9]方法,细胞接受2、4、6 d干预后,检测VSMCs内钙离子水平。PBS洗涤细胞后,以1 000 r/min离心5 min(离心半径8.6 cm),弃上清液,4-羟乙基哌嗪乙磺酸(HEPES)缓冲液洗涤细胞,悬浮,制备细胞悬液,调整细胞浓度为200×106/L~300×106/L,细胞悬液中加入Fluo-3/AM,终浓度为5 μmol/L,37 ℃下避光负载30 min;维拉帕米加入方式:负载Fluo-3/AM的细胞悬液加入20 μmol/L维拉帕米孵育15 min,以80 mmol/L 氯化钾溶液为激动剂,细胞悬液置于96孔板内,依据上述分组,每组设置对照孔,使用酶标仪检测,激发光波长为325 nm,于526 nm处检测荧光强度(fluorescence intensity,FI),因细胞内钙离子同Fluo-3/AM结合后发出荧光,且FI和游离钙离子水平呈正比[9],因此本研究采用Fluo-3/AM FI间接反映出细胞内钙离子水平。实验重复3次,结果为3次平均值。
1.2.4 反转录PCR(RT-PCR)方法检测VSMCs内目的基因表达水平 细胞接受2、4、6 d干预后,利用RNA提取试剂盒,采用Trizol法提取并纯化细胞总RNA。应用RNA反转录试剂盒将RNA反转录为cDNA。PCR反应程序为:95 ℃预变性5 min;95 ℃变性30 s,smad1 55 ℃退火30 s、GAPDH 58 ℃退火30 s、72 ℃延伸45 s,36个循环;runx2 55 ℃退火30 s、72 ℃延伸45 s,28个循环;最后于72 ℃延伸10 min。取PCR产物,行琼脂糖凝胶电泳。实验重复3次,结果为3次平均值。以GAPDH为内对照,计算目的基因表达水平。各基因扩增引物序列见表1。
1.2.5 钙化检测
1.2.5.1 VSMCs钙水平测定 采用钙水平测定试剂盒检测VSMCs钙水平:细胞接受14 d干预后弃去上清液,加入1 mol/L盐酸溶液脱钙,37 ℃过夜,取上清液测定钙水平,0.1 mol/L氢氧化钠(NaOH)和0.1%十二烷基磺酸钠(SDS)溶液溶解细胞30 min,BCA法测定细胞蛋白水平,结果用细胞钙水平比蛋白水平表示(mg/g蛋白)。每组3个复孔,实验重复3次,求平均值。
1.2.5.2 茜素红染色 细胞接受14 d干预后采用茜素红进行钙化染色,倒置相差显微镜下观察钙化结节染色情况,每组取3个样本,每个样本随机选取1个视野(×100)。结果判断标准:细胞内钙盐沉积为橘红色。

表1 各目的基因引物序列
2 结果
2.1 细胞鉴定 大鼠胸主动脉组织块贴壁3~4 d后见细胞从组织块边缘爬出,细胞为长梭形,呈束状排列,5~6 d成同心圆状细胞团,形成明显的细胞生长晕,环绕组织块边缘呈束状、向外呈放射状延伸,约6~7 d后融合成片,细胞体为不规则三角形或梭形,细胞质向外伸出2~3个长短不等的突起,中有卵圆形核,细胞贴壁呈极性生长,高低起伏,呈典型的“峰-谷”样表现。细胞质α-SMA actin表达强阳性。细胞传代纯化,细胞生长特性无明显改变。
2.2 3组VSMCs内钙离子水平比较 2、4、6 d后,3组大鼠VSMCs内钙离子水平比较,差异均有统计学意义(P<0.05)。高磷组、维拉帕米干预组2、4、6 d后VSMCs内钙离子水平均高于正常对照组,差异有统计学意义(P<0.05);维拉帕米干预组2、4、6 d后VSMCs内钙离子水平均低于高磷组,差异有统计学意义(P<0.05)。高磷组、维拉帕米干预组4、6 d后VSMCs内钙离子水平高于2 d后,差异有统计学意义(P<0.05);高磷组6 d后VSMCs内钙离子水平高于4 d后,差异有统计学意义(P<0.05);维拉帕米干预组6 d后VSMCs内钙离子水平低于4 d后,差异有统计学意义(P<0.05,见表2)。

Table 2 Comparison of the calcium ion level of rat VSMCs among the three groups
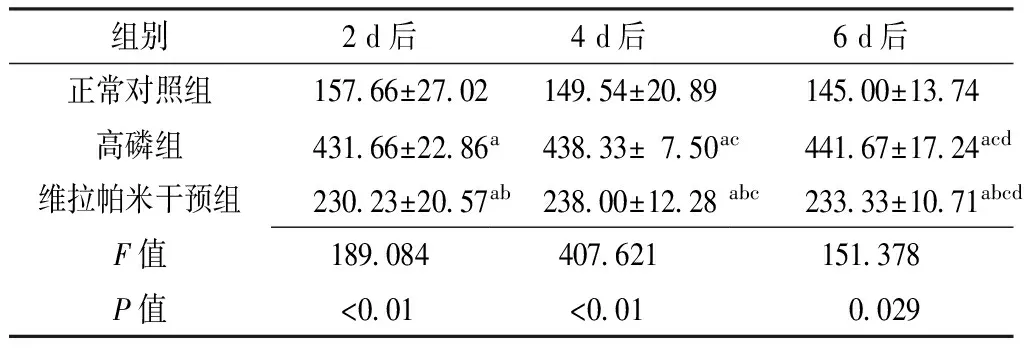
组别2d后4d后6d后正常对照组15766±270214954±208914500±1374高磷组43166±2286a43833±750ac44167±1724acd维拉帕米干预组23023±2057ab23800±1228abc23333±1071abcdF值189084407621151378P值<001<0010029
注:与正常对照组比较,aP<0.05;与高磷组比较,bP<0.05;与2 d后比较,cP<00.05;与4 d后比较,dP<00.05
2.3 3组VSMCs内目的基因表达水平比较 2、4、6 d后,3组VSMCs内smad1、runx2 mRNA表达水平比较,差异均有统计学意义(P<0.05)。高磷组、维拉帕米干预组2、4、6 d后VSMCs内smad1、runx2 mRNA表达水平均高于正常对照组,差异有统计学意义(P<0.05);维拉帕米干预组2、4、6 d后VSMCs内smad1、runx2 mRNA表达水平均低于高磷组,差异有统计学意义(P<0.05)。高磷组4、6 d后VSMCs内smad1、runx2 mRNA表达水平高于2 d后,6 d后VSMCs内smad1、runx2 mRNA表达水平高于4 d后,差异有统计学意义(P<0.05);维拉帕米干预组4 d后VSMCs内smad1 mRNA表达水平高于2 d后,runx2 mRNA表达水平低于2 d后,6 d后VSMCs内smad1、runx2 mRNA表达水平均高于2、4 d后,差异有统计学意义(P<0.05,见表3、图1)。
2.4 钙化检测结果
2.4.1 3组VSMCs钙水平比较 3组VSMCs钙水平比较,差异有统计学意义(P<0.05)。高磷组、维拉帕米干预组VSMCs钙水平均高于正常对照组,差异有统计学意义(P<0.05);维拉帕米干预组VSMCs钙水平低于高磷组,差异有统计学意义(P<0.05,见表4)。
2.4.2 茜素红染色结果 高磷组、维拉帕米干预组橘红色钙化结节较正常对照组多,维拉帕米干预组橘红色钙化结节较高磷组少(见图2)。
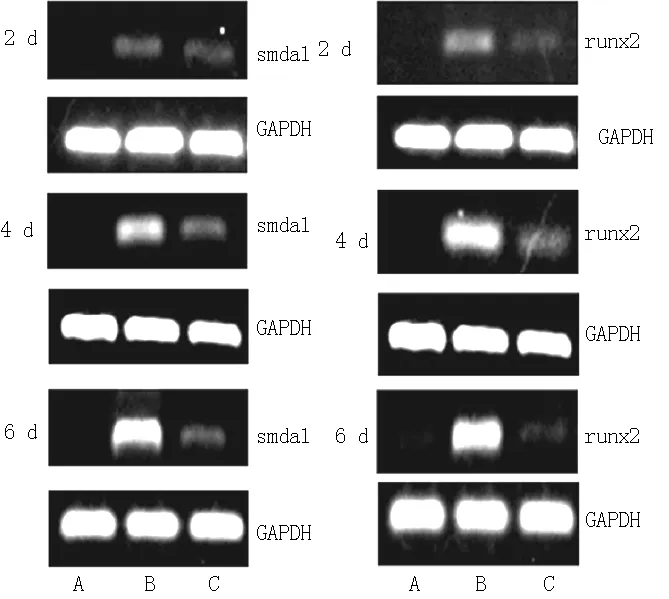
注:A为正常对照组,B为高磷组,C为维拉帕米干预组
图1 3组大鼠VSMCs内smad1和runx2 mRNA表达情况
Figure 1 Expression of smad1 and runx2 mRNA of rat VSMCs among the three groups

表3 3组大鼠VSMCs内目的基因表达水平比较(±s,n=3)
注:与正常对照组比较,aP<0.05;与高磷组比较,bP<0.05;与2 d后比较,cP<0.05;与4 d后比较,dP<0.05
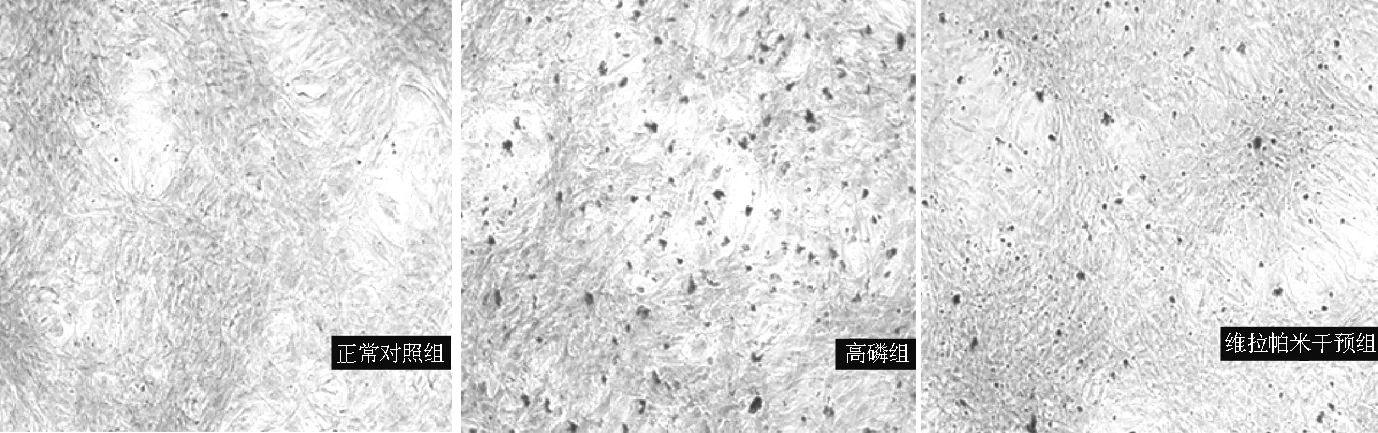
图2 3组大鼠VSMCs钙化结节的形成(茜素红染色,×100)

组别钙水平(mg/g蛋白)正常对照组4479±638高磷组17652±1286a维拉帕米干预组13023±1057abF值20964P值0020
注:与正常对照组比较,aP<0.05;与高磷组比较,bP<0.05
3 讨论
血管钙化普遍存在于CKD患者当中,研究显示,40%~60%的CKD 3~5期患者出现主动脉及冠状动脉钙化[10]。血管钙化是主动的、受多种基因调节的类成骨过程,常伴有runx2、碱性磷酸酶等骨相关蛋白表达[2]。钙离子作为VSMCs重要的第二信使,参与细胞基因转录、表型转化等生物学过程。细胞外钙离子内流入细胞,可以通过促进细胞凋亡、加速基质小泡释放、促进钙磷沉积、推动VSMCs表型转化等多种机制来参与血管钙化的发生、发展[3]。维拉帕米属于苯烷胺类的钙通道阻滞剂,通过特异性结合L型钙通道的α亚基,起到抑制L型钙通道介导的钙离子内流的作用[11]。基于维拉帕米的作用机制,近年来研究发现,维拉帕米在治疗动脉粥样硬化、高血压、心肌缺血/再灌注损伤等方面发挥重要作用,有显著保护心血管的效应[4],然而在血管钙化方面的研究却鲜有报道。本研究结果显示,维拉帕米干预组VSMCs钙水平、橘红色钙化结节均低于高磷组,提示维拉帕米抑制高磷诱导的VSMCs钙化。Chen等[9]研究发现,维拉帕米可以通过浓度依赖方式抑制高磷诱导的VSMCs钙化,同本研究结果相似。
VSMCs内的钙离子连同其下游的信号分子构成庞大的信号网络参与细胞的各种生命活动。有学者研究显示,在成骨细胞上,通过钙通道内流入细胞的钙离子可以启动下游骨相关蛋白表达,促进成骨细胞的骨形成[12]。VSMCs成骨转分化是血管钙化的重要机制[3],因此推测在VSMCs钙化过程中,钙离子发挥类似作用。维拉帕米作为钙通道阻滞剂可以通过阻断细胞膜上钙离子通道,减少钙离子内流,从而降低细胞内钙离子水平。本研究结果显示,高磷组、维拉帕米干预组2、4、6 d后VSMCs内钙离子水平均高于正常对照组,维拉帕米干预组2、4、6 d后VSMCs内钙离子水平均低于高磷组,提示维拉帕米可有效抑制钙离子内流。
血管平滑肌发生成骨/成软骨表型转化是血管钙化的重要机制之一[2]。runx2是成骨细胞分化的特异性转录因子,能够识别多种成骨特异的基因启动子中的特异性顺式作用元件,调控成骨细胞表型转化,是VSMCs表型转化的标志[3]。相关研究显示,钙离子可以通过smad1调节runx2表达,钙离子通过调控细胞内的信号分子smad1的丝氨酸磷酸化,活化的smad1蛋白易位至胞核内进而调控smad1蛋白的目的基因转录,从而上调runx2的表达[13]。本研究结果显示,高磷组、维拉帕米干预组2、4、6 d后VSMCs内smad1、runx2 mRNA表达水平均高于正常对照组,维拉帕米干预组2、4、6 d后VSMCs内smad1、runx2 mRNA表达水平均低于高磷组,高磷组4、6 d后VSMCs内smad1、runx2 mRNA表达水平分别高于2 d后,6 d后VSMCs内smad1、runx2 mRNA表达水平分别高于4 d后,维拉帕米干预组4 d后VSMCs内smad1 mRNA表达水平高于2 d后,runx2 mRNA表达水平低于2 d后,6 d后VSMCs内smad1、runx2 mRNA表达水平均高于2、4 d后,说明高磷是以时间依赖的方式上调runx2和smad1的表达,提示维拉帕米通过阻断钙离子内流从而抑制smad1表达,进而抑制runx2的表达,最终抑制VSMCs钙化。
综上所述,维拉帕米在高磷诱导的VSMCs钙化中起到抑制作用,为临床治疗血管钙化提供了新思路,维拉帕米这种作用可能是通过抑制钙离子内流进而抑制smad1表达,进一步抑制runx2表达,进而抑制VSMCs发生表型转化来实现的。但本研究仅局限在基因水平,而其蛋白水平如何变化,尚有待进一步探讨。
[1]McIntyre NJ,Fluck RJ,McIntyre CW,et al.Determinants of arterial stiffness in chronic kidney disease stage 3[J].PLoS One,2013,8(1):e55444.
[2]Demer LL,Tintut Y.Inflammatory,metabolic,and genetic mechanisms of vascular calcification[J].Arterioscler Thromb Vasc Biol,2014,34(4):715-723.
[3]Shanahan CM,Crouthamel MH,Kapustin A,et al.Arterial calcification in chronic kidney disease:Key roles for calcium and phosphate[J].Circ Res,2011,109(6):697-711.
[4]Godfraind T.Calcium channel blockers in cardiovascular pharmacotherapy[J].J Cardiovasc Pharmacol Ther,2014,19(6):501-515.
[5]Schraven E,Trottnow D,Nitz RE.Inhibition of vitamin D3-induced vascular calcification by carbocromen[J].Adv Myocardiol,1983,4:263-267.
[6]Bai YL,Xu JS,Zhang MQ,et al.Ettects ot cell apoptosis on high-phosphorus-induced rat vascular smooth muscle cells calcitication inhibited by vitamin K2[J].Chinese General Practice,2015,18(3):278-282.(in Chinese) 白亚玲,徐金升,张睦清,等.细胞凋亡在维生素K2抑制高磷诱导的大鼠血管平滑肌细胞钙化中的作用[J].中国全科医学,2015,18(3):278-282.
[7]Bai YL,Xu JS,Qian YT,et al.Effect of IFNy on high phosphorus-induced calcification in rat vascular smooth muscle cells[J].Chinese Journal of Cardiovascular Medicine,2015,20(1):62-66.(in Chinese) 白亚玲,徐金升,钱玥彤,等.γ干扰素对高磷诱导大鼠血管平滑肌细胞钙化的影响研究[J].中国心血管杂志,2015,20(1):62-66.
[8]Bai YL,Xu JS,Jin JJ,et al.Effect of magnesium on factors related to calcification in rat vascular smooth muscle cells[J].Chinese General Practice,2015,18(6):665-668.(in Chinese) 白亚玲,徐金升,靳晶晶,等.镁离子对大鼠血管平滑肌细胞钙化相关因子表达的影响[J].中国全科医学,2015,18(6):665-668.
[9]Chen NX,Kircelli F,O′Neill KD,et al.Verapamil inhibits calcification and matrix vesicle activity of bovine vascular smooth muscle cells[J].Kidney Int,2010,77(5):436-442.
[10]Karohl C,D′Marco Gascón L,Raggi P.Noninvasive imaging for assessment of calcification in chronic kidney disease[J].Nat Rev Nephrol,2011,7(10):567-577.
[11]Pikilidou MI,Yavropoulou MP,Scuteri A.Can antihypertensive medication interfere with the vicious cycle between hypertension and vascular calcification?[J].Cardiovasc Drugs Ther,2014,28(1):61-71.
[12] Duan XQ,Zhao ZT,Zhang XY,et al.Fluoride affects calcium homeostasis and osteogenic transcription factor expressions through L-type calcium channels in osteoblast cell line[J].Biol Trace Elem Res,2014,162(1):219-226
[13]Eapen A,Kulkarni R,Ravindran S,et al.Dentin phosphophoryn activates Smad protein signaling through Ca2+-calmodulin-dependent protein kinase Ⅱ in undifferentiated mesenchymal cells[J].J Biol Chem,2013,288(12):8585-8595.
(本文编辑:崔丽红)
Inhibition of the Calcification of Vascular Smooth Muscle Cells by Verapamil Though the Blocking of the Inward Flow of Calcium Ion
LITong-miao,XUJin-sheng,FENGYu,etal.
DepartmentofNephrology,theForthHospitalofHebeiMedicalUniversity,Shijiazhuang050011,China
Objective To explore the effect and mechanism of verapamil on the calcification of vascular smooth muscle cells(VSMCs) induced by hyperphosphate.Methods From December 2014 to June 2015,selecte 6 healthy male SD rats of 5 to 8 weeks and cleaning grade vascular smooth muscle cells were cultured in vitro and were determined by immunohistochemistry.The VSMCs in logarithmic phrase were randomly divided into normal control group(10% FBS culture medium),hyperphosphate group(hyperphosphate culture medium) and verapamil group(hyperphosphate culture medium+20 nmol/L verapamil).Deteation of intracelluar calcium ion level of VSMCs after culture for 2,4 and 6 days.RT-PCR was used to observe the expression of VSMCs smad1 and runx2 mRNA after culture for 2,4,6 days.After culture for 14 days,calcification test was conducted,including calcium level measurement and alizarin red staining.Results After culture for 2,4 and 6 days,the hyperphosphate group and verapamil group were higher(P<0.05) than normal control group in calcium ion level of VSMCs;after culture for 2,4 and 6 days,verapamil group was lower(P<0.05) than hyperphosphate group in calcium ion level of VSMCs.After culture for 4 and 6 days,hyperphosphate group and verapamil group had higher(P<0.05) calcium ion level of VSMCs than that after culture for 2 days;hyperphosphate group had higher(P<0.05) calcium ion level of VSMCs after culture for 6 days than that after culture for 4 days;verapamil group had lower(P<0.05) calcium ion level of VSMCs after culture for 6 days than that after culture for 4 days.After culture for 2,4 and 6 days hyperphosphate group and verapamil group were higher(P<0.05) than normal control group in the expression of VSMCs smad1 and runx2 mRNA;after culture for 2,4 and 6 days,verapamil group was lower(P<0.05) than hyperphosphate group in the expression of VSMCs smad1 and runx2 mRNA.Hyperphosphate group had higher(P<0.05) expression of VSMCs smad1 and runx2 mRNA after culture for 4 days and 6 days than that after culture for 2 days and had higher(P<0.05) expression of VSMCs smad1 and runx2 mRNA after culture for 6 days than that after culture for 4 days;verapamil group had higher (P<0.05) expression of VSMCs smad1 mRNA and lower (P<0.05) expression of VSMCs runx2 mRNA after culture for 4 days than that after culture for 2 days;verapamil group had higher (P<0.05) expression of VSMCs smad1 and runx2 mRNA after culture for 6 days than that after culture for 2 days and 4 days.Hyperphosphate group and verapamil group had higher(P<0.05) calcium level of VSMCs than normal control group,verapamil group was lower(P<0.05) than hyperphosphate group in calcium level.Hyperphosphate group and verapamil group had more orange calcification nodules than normal control group;verapamil group had less orange calcification nodules than hyperphosphate group.Conclusion Verapamil may protect against hyperphosphate-induced calcification of VSMCs and may inhibit VSMCs phenotypic transformation by downregulating smad1 expression and further inhibiting runx2 expression.
Verapamil;Myocytes,smooth muscle;Vascular calcification;Calcium channels
河北省自然科学基金资助项目(项目编号:H2012206157)
050011河北省石家庄市,河北医科大学第四医院肾内科
徐金升,050011河北省石家庄市,河北医科大学第四医院肾内科;E-mail:xjs5766@126.com
R 364
A
10.3969/j.issn.1007-9572.2015.27.008
2015-06-09;
2015-07-22)

