糖皮质激素对小胶质细胞内钙的影响
何舒翘,钱 旭,张贵平,张维文,张 梅
(广州医科大学药学院药理教研室,广州 广东 511436)
糖皮质激素对小胶质细胞内钙的影响
何舒翘,钱 旭,张贵平,张维文,张 梅
(广州医科大学药学院药理教研室,广州 广东 511436)
目的 观察糖皮质激素对小胶质细胞内钙的影响并初步探讨其机制。方法 体外培养神经小胶质细胞株BV-2,使用Fluo3-AM作为钙荧光染料,激光共聚焦显微镜实时扫描观察氢化可的松处理后BV-2细胞内钙浓度的动态变化情况。结果 氢化可的松和阳性对照药尼古丁均能显著升高BV-2细胞内钙水平(P<0.05);实时扫描显示氢化可的松即刻引起细胞内钙升高,15 s左右达到峰值,持续约10 s后开始下降,200 s左右恢复至基态,并且这一作用显示出与尼古丁升高细胞内钙效应的一致性。糖皮质激素受体拮抗剂RU486不能取消氢化可的松升高BV-2细胞内钙的效应(P>0.05);而α7烟碱型乙酰胆碱受体(α7nAChR)阻断剂甲基牛扁亭碱(MLA)可以拮抗氢化可的松升高BV-2细胞内钙的效应(P<0.05)。结论 氢化可的松通过影响α7nAChR升高小胶质细胞内钙水平,这一作用不但证实了糖皮质激素的非基因组效应,同时提示糖皮质激素可能作为α7nAChR的内源性配体。
糖皮质激素;小胶质细胞;α7nAChR;尼古丁;甲基牛扁亭碱
糖皮质激素(glucocorticoids, GCs)是肾上腺皮质分泌的内源性分子,具有抗炎、抑制免疫反应等多种作用,是临床广泛使用的抗炎药物。传统观点认为药理剂量GCs才具有抗炎作用,但近年的研究表明内源性(或生理浓度)GCs同样具有抗炎效应,并且在很多炎症相关性疾病的发生发展中起重要作用[1-2]。GCs是体液抗炎系统的重要组成部分,而神经抗炎机制——胆碱能抗炎通路的发现进一步丰富了机体内源性抗炎系统的内涵。介导胆碱能抗炎通路的是迷走神经,其通过递质乙酰胆碱作用于免疫细胞,抑制炎症因子释放起到抗炎作用,研究发现α7烟碱型乙酰胆碱受体(α7 nicotinic acetylcholine receptor,α7nAChR)处于胆碱能抗炎通路的核心,是该通路调控炎症反应的关键分子[3]。我们前期发现,生理浓度GCs可以抑制LPS刺激小胶质细胞引起的炎症反应,并且α7nAChR的特异性阻断剂甲基牛扁亭碱(methyllycaconitine,MLA)可拮抗GCs的这一作用,提示GCs的抗炎作用与α7nAChR有关,两条内源性抗炎通路之间可能存在联系[4]。
α7nAChR是烟碱型胆碱能受体家族的一员,由5个α7亚基构成同源聚合体,为促离子型受体,属于配体门控的离子通道[5]。α7nAChR开放时可以通过钠、钾和钙离子,尤其对钙离子具有高度通透性,可影响细胞内钙离子浓度,属于高钙依赖性离子通道[5]。GCs的经典作用模式是通过与糖皮质激素受体结合影响基因转录而发挥抗炎作用。我们的研究显示GCs的抗炎作用与胆碱能通路α7nAChR有关,但这一作用是否通过GCs直接影响α7nAChR功能,尚不得而知。鉴于α7nAChR是高钙通透性离子通道,本研究拟通过检测小胶质细胞内钙离子浓度变化,借此反映α7nAChR开放情况,揭示GCs是否作为内源性配体影响α7nAChR功能。
1 材料与方法
1.1 材料
1.1.1 细胞培养 神经小胶质细胞株BV-2由中科院上海细胞库提供。BV-2细胞培养于含10%胎牛血清的高糖DMEM培养基,置于37℃、5% CO2培养箱,选取对数生长期的细胞进行实验。
1.1.2 主要试剂和仪器 DMEM高糖培养基、胎牛血清和胰酶均购自Gibco公司;HBSS缓冲液(含Ca2+、Mg2+)购自索莱宝公司;Fluo3-AM为日本同仁化学研究所产品;氢化可的松(hydrocortisone,Hydro)、尼古丁(nicotine,Nic)、MLA和DMSO来自Sigma公司;RU486为MCE 公司产品。激光共聚焦显微镜(A1ver 4.30)为Nikon公司产品。
1.2 方法
1.2.1 药物处理和实验分组 实验分组主要包括control、Hydro、Hydro+RU486、Hydro+MLA和Nic组,在此Nic作为阳性对照药。药物的工作浓度:Hydro为300 nmol·L-1,Nic为50 μmol·L-1,糖皮质激素受体阻断剂RU486为100 nmol·L-1,α7nAChR阻断剂MLA为10 nmol·L-1。受体阻断剂预先孵育细胞30 min后给予药物处理。另单独设立MLA和RU486组观察对细胞内钙的影响。

Fig 1 The effect of hydrocortisone on intracellular calcium in BV-2 cells
A a:Untreated cells;b:Cells were treated with hydrocortisone;c:Cells were treated with nicotine. B Statistical analysis for peak amplitude of[Ca2+]iafter drug treatment.*P<0.05vscontrol
1.2.2 Fluo3-AM负载细胞 BV-2细胞接种于共聚焦专用小皿,HBSS溶液洗涤细胞后加入Fluo3-AM工作液(2.5 μmol·L-1),于37℃避光孵育30 min后除去Fluo3-AM,用HBSS溶液洗涤细胞3次备用。
1.2.3 BV-2细胞内Ca2+荧光量动态变化测定 激光共聚焦系统的测量参数:激发波长为488 nm,发射波长为526 nm;设置扫描的全时程为5 min,扫描间隔为每5 s一次,扫描至1.5 min时加入药物,于第5 min停止扫描。对扫描过程中细胞内钙水平变化的时间曲线进行分析:细胞内钙水平的达峰时间、峰值持续时间和恢复基态时间。使用激光共聚焦系统的NIS-Elements AR Analysis 4.40.00 64-bit软件分析细胞内钙荧光强度。


Fig 2 Dynamics of intracellular calcium in response to Hydro and Nic in BV-2 cells
A:The instantaneous[Ca2+]icurve after drug treatment;B:Statistical analysis for dynamic change of[Ca2+]iafter drug treatment
2 结果
2.1 Hydro对小胶质细胞内钙的影响 激光共聚焦显微镜实时扫描显示,Fluo3-AM负载的BV-2细胞在给予Hydro和Nic(Fig 1A)后胞内绿色荧光明显增强,而对照组细胞内无明显绿色荧光。胞质内钙荧光强度扫描分析显示,Hydro和Nic均可引起BV-2细胞内钙的明显升高(P<0.05)(Fig 1B)。
2.2 Hydro对小胶质细胞内钙动态变化过程的影响 激光共聚焦显微镜实时扫描BV-2细胞内钙的动态变化,钙浓度变化的经时曲线显示在加入Hydro和Nic后细胞内钙立刻开始升高:Hydro引起的细胞内钙升高在15 s左右达到峰值,持续约10 s后开始下降;Nic引起的细胞内钙升高在28 s左右达到峰值,持续约30 s后下降(Fig 2B)。两者引起的细胞内钙升高均在200 s左右恢复至基态(Fig 2B)。
2.3 RU486对Hydro升高小胶质细胞内钙的影响 为了探明Hydro引起BV-2细胞内钙上升的原因,在Hydro处理前预先给予糖皮质激素受体阻断剂RU486孵育,结果显示RU486不能拮抗Hydro升高BV-2细胞内钙的效应(P>0.05)(Fig 3)。此外,RU486单独使用并不影响BV-2细胞内钙水平(Fig 3)。
2.4 MLA对Hydro升高小胶质细胞内钙的影响 为了揭示Hydro引起BV-2细胞内钙上升是否由α7nAChR介导,在Hydro处理前预先给予α7nAChR受体阻断剂MLA孵育,结果显示Hydro升高BV-2细胞内钙的效应被MLA拮抗(Fig 4)(P<0.05)。MLA单独使用并不影响BV-2细胞内钙水平(Fig 4)。
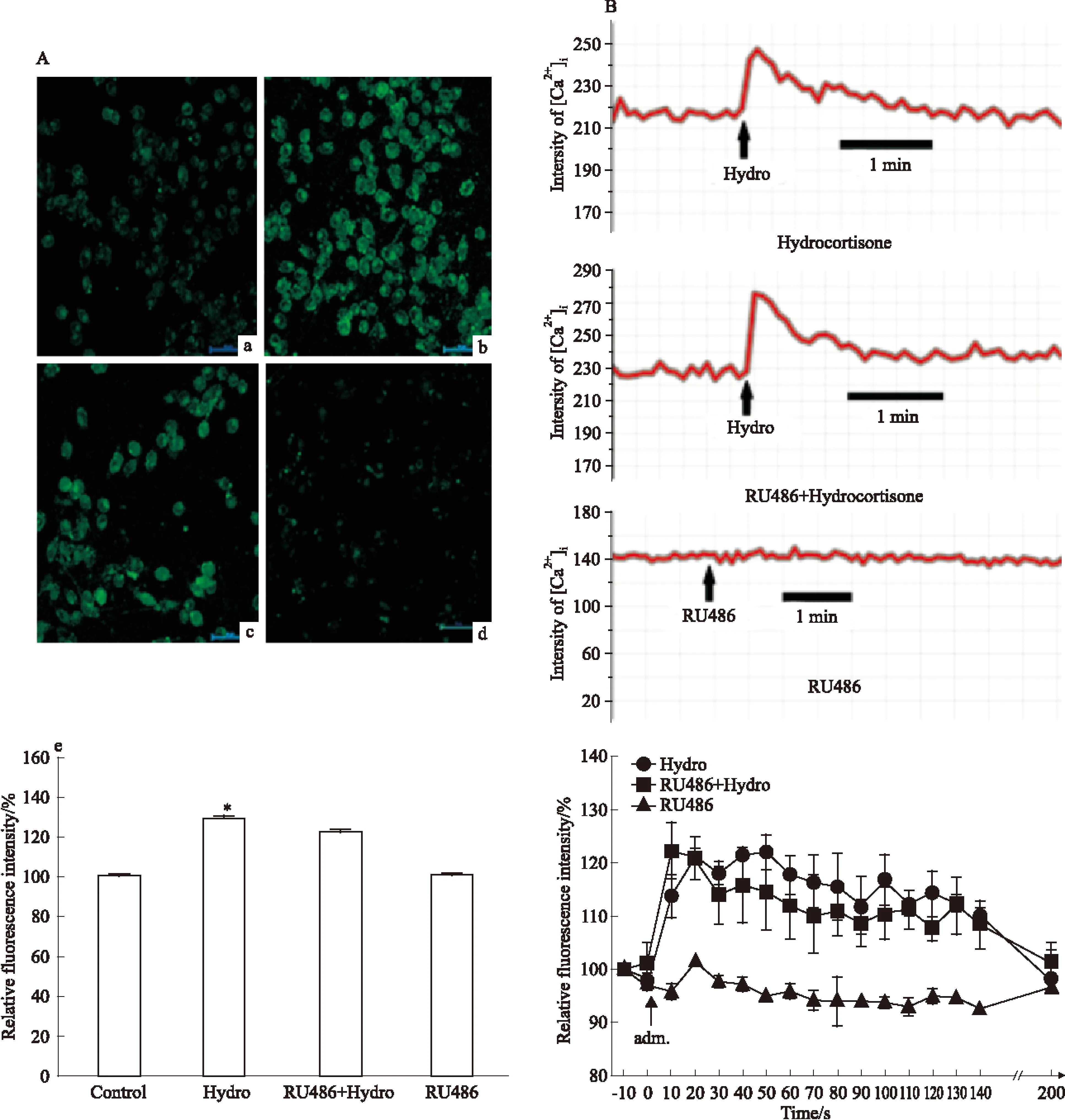
Fig 3 Effect of RU486 on elevation of intracellular calcium induced by hydrocortisone in BV-2 cells
A a: Untreated cells;b:Cells were treated with hydro;c:Cells were treated with hydro after RU486;d: Cells were treated with RU486 only.B The dynamics of intracellular calcium in response to drug indicated.*P<0.05vscontrol
3 讨论
小胶质细胞是中枢神经系统内的巨噬细胞,参与一系列免疫反应,尤其是在脑内炎症反应过程中起重要作用。小胶质细胞上有含量丰富的糖皮质激素受体(GRs),亦大量表达α7nAChR,不仅是GCs的直接抗炎靶标,也是联接GCs(体液抗炎系统)和胆碱能抗炎通路的重要枢纽。我们前期在小胶质细胞的研究表明α7nAChR参与了生理浓度GCs的抗炎作用,但GCs如何影响α7nAChR功能却不清楚。α7nAChR是高钙通透性的阳离子通道,在激动剂的作用下离子通道开放,使细胞内钙水平升高,钙离子内流可引发细胞内一系列的下游信号事件,产生诸多生物效应。
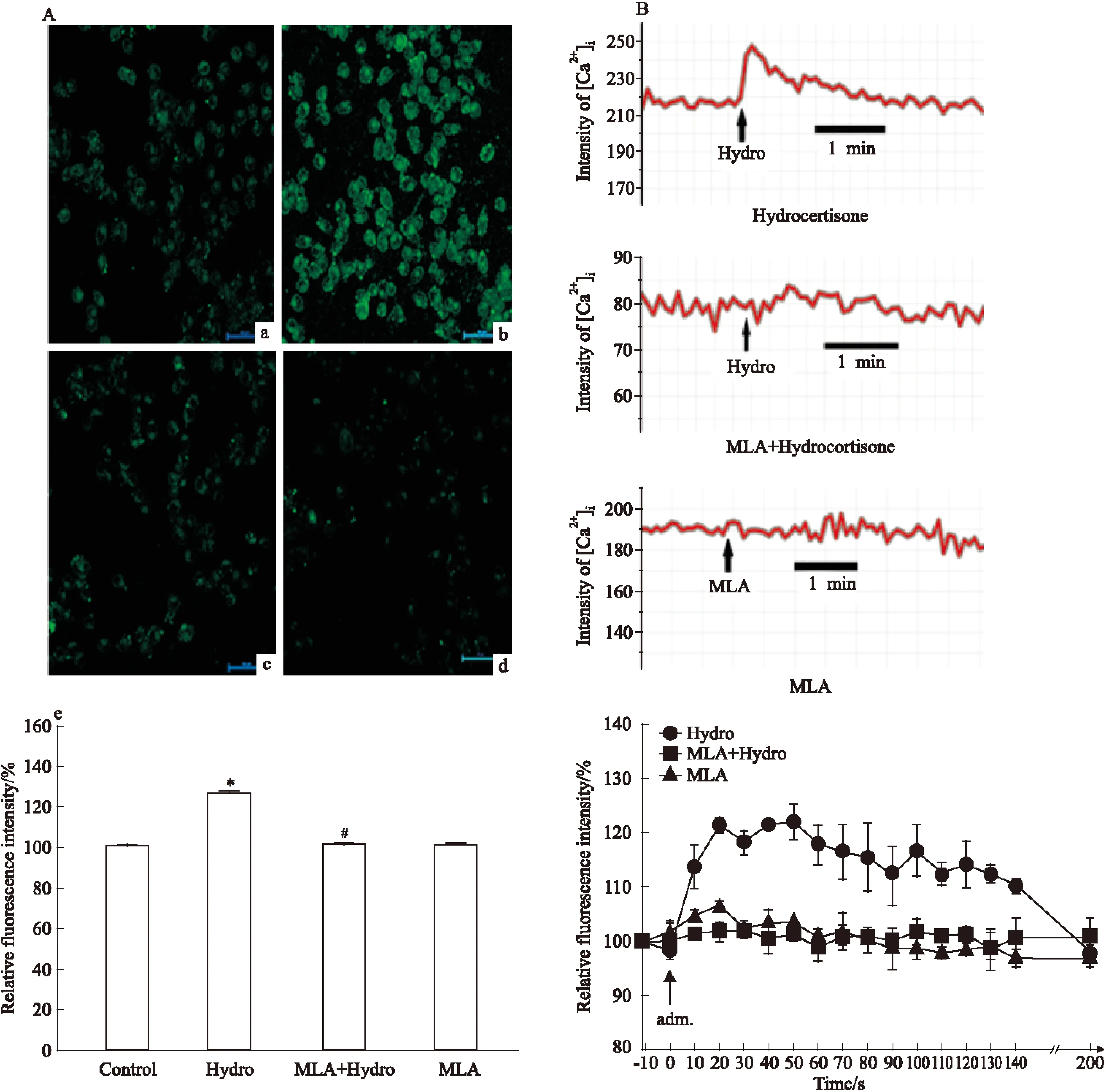
Fig 4 Effect of MLA on the elevation of intracellular calcium induced by hydrocortisone in BV-2 cells
A a: Untreated cells;b:Cells were treated with hydro;c:Cells were treated with hydro after MLA;d:Cells were treated with MLA only. B The dynamics of intracellular calcium in response to drug indicated.*P<0.05vscontrol;#P<0.05vshydrocortisone
本研究中使用激光共聚焦显微镜对BV-2细胞内钙的变化进行实时观察,结果显示在加入氢化可的松和尼古丁后细胞内钙立刻开始升高,氢化可的松较尼古丁达峰时间稍快,但尼古丁引起细胞内钙上升的峰值更高,持续时间更长,两者引起的细胞内钙升高均在200 s左右恢复至基态。尼古丁是烟碱受体的特异激动剂,研究显示其通过激动α7nAChR开放离子通道使细胞内钙升高,发挥对多巴胺神经元的保护作用[6]。我们的结果证实糖皮质激素可以引起小胶质细胞内钙浓度升高,并且这一作用显示出与尼古丁升高细胞内钙效应特征的一致性。有关糖皮质激素对细胞内钙的影响,结果不尽相同。在脊髓背根神经元的研究显示,皮质酮可以抑制ATP引起的细胞内钙升高,并认为这一作用与PKA通路有关[7];在海马神经元的研究显示,生理浓度的皮质酮可以增强细胞去极化引起的钙内流,且这一作用与影响转录有关[8]。但上述研究结果均未证实皮质酮通过作用于离子通道影响细胞内钙。
为了探明氢化可的松引起BV-2细胞内钙上升的原因,我们分别预先给予GRs和α7nAChR的阻断剂,观察氢化可的松对细胞内钙的影响,发现阻断GRs并不影响细胞内钙的变化,而α7nAChR阻断剂可拮抗氢化可的松升高细胞内钙的效应。这一结果说明氢化可的松引起小胶质细胞内钙升高的效应并不是通过其传统的受体途径实现,而是通过促进α7nAChR开放引起细胞外的钙离子内流所致。有关GCs和α7nAChR关系研究的报道一直不多。早年对小鼠大脑的放射显影测定显示,血浆皮质酮水平变化可影响多个脑区α7nAChR数目[9];随后在肾上腺嗜铬细胞的研究证明GCs通过早期生长反应因子参与对α7nAChR基因启动子的调节[10]。但作为小胶质细胞上重要的抗炎靶点,α7nAChR和GCs的关系一直未见报道。本研究显示GCs通过作用于α7nAChR引起细胞内钙离子浓度增加,不仅证实和拓展了GCs药理作用的非基因组效应,提示GCs可作为α7nAChR的内源性配体发挥抗炎作用;并且首次在小胶质细胞揭示以GCs为代表的体液抗炎通路和胆碱能抗炎通路之间存在联系,而α7nAChR作为这一连接的关键分子。最近的研究显示可利用同源建模的方式研究钙离子通道的三维结构[11]。GCs与小胶质细胞α7nAChR的结合形式是否可通过这种同源建模的方式进行探索,是值得本研究去尝试的方法。此外,体液和胆碱能抗炎通路如何在体内协同发挥作用,尚需在后续的研究工作中进行阐明。
(致谢:本研究在广州医科大学药学院药理学广州市重点实验室完成,特此致谢!)
[1] He Y H, Zhang H N, Zhang G P, et al. A physiological concentration of glucocorticoid inhibits the pro-inflammatory cytokine-induced proliferation of adult rat cardiac fibroblasts: roles of extracellular signal-regulated kinase 1/2 and nuclear factor-κB[J].ClinExpPharmacolPhysiol, 2011, 38(11):739-46.
[2] Zhang H N,He Y H,Zhang G S, et al. Endogenous glucocorticoids inhibit myocardial inflammation induced by lipopolysaccharide: involvement of regulation of histone deacetylation[J].JCardiovascPharmacol,2012,60(1):33-41.
[3] Wang H, Yu M, Ochani M, et al. Nicotinic acetylcholine receptor alpha7 subunit is an essential regulator of inflammation[J].Nature,2003,421:384-8.
[4] 陈依雨, 吕俊华, 张 梅.α7nAChR参与生理浓度糖皮质激素的抗炎作用[J]. 中国病理生理杂志, 2014, 30(4): 706-10.
[4] Chen Y Y, Lyu J H, Zhang M.α7nAChR involved in anti-inflammation of physiological concentration of glucocorticoids[J].ChinJPathophys, 2014, 30(4):706-10.
[5] Amiri S,Tai K,Beckstein O,et al. The alpha7 nicotinic acetylcholine receptor: molecular modelling, electrostatics, and energetics[J].MolMembrBiol, 2005, 22(3):151-62.
[6] Toulorge D, Guerreiro S, Hild A, et al. Neuroprotection of midbrain dopamine neurons by nicotine is gated by cytoplasmic Ca2+[J].FasebJ, 2011, 25(8):2563-73.
[7] Liu X, Zeng J, Zhao Y, et al. Inhibition of ATP-induced Ca2+influx by corticosterone in dorsal root ganglion neurons[J].NeurochemRes, 2010, 35(5):804-10.
[8] Chatterjee S, Sikdar S K. Corticosterone targets distinct steps of synaptic transmission via concentration specific activation of mineralocorticoid and glucocorticoid receptors[J].JNeurochem, 2014, 128(4):476-90.
[9] Stitzel J A, Farnham D A, Collins A C. Chronic corticosterone treatment elicits dose-dependent changes in mouse brain alpha-bungarotoxin binding[J].Neuroscience, 1996, 72(3):791-9.
[10]Carrasco-Serrano C, Campos-Caro A, Viniegra S, et al. GC-and E-box motifs as regulatory elements in the proximal promoter region of the neuronal nicotinic receptor alpha7 subunit gene[J].JBiolChem, 1998, 273(32):20021-8.
[11]雷 明, 苏敬阳, 李 卓,等. Cav1.2钙离子通道三维结构的同源建模及其应用[J]. 中国药理学通报,2017, 33(1): 95-9.
[11]Lei M, Su J Y, Li Z, et al. Homology modeling and application of three dimensional structure of Cav1.2 calcium channel[J].ChinPharmacolBull, 2017, 33(1): 95-9.
Effects of glucocorticoids on intracellular calcium in microglial cells
HE Shu-qiao, QIAN Xu, ZHANG Gui-ping, ZHANG Wei-wen, ZHANG Mei
(DeptofPharmacology,SchoolofPharmaceuticalSciences,GuangzhouMedicalUniversity,Guangzhou511436,China)
Aim To explore the effects of hydrocortisone on intracellular calcium in microglial cells.Methods The intracellular calcium was measured by instantaneous scanning with confocal laser microscope(CLM) in BV-2 cells, and fluo3-AM was used to dye the intracellular calcium.Results Both hydrocortisone and nicotine could obviously increase intracellular calcium in BV-2 cells(P<0.05). It was indicated by instantaneous scanning with CLM that hydrocortisone induced the rising of intracellular calcium immediately, and reached the peak about at the fifteenth second, and sustained for 10 seconds, then declined to baseline at 200th second. The effect of hydrocortisone on intracellular calcium exhibited a highly consistency with nicotine. Antagonist of glucocorticoid receptors RU486 could not abolish the rising of intracellular calcium induced by hydrocortisone(P>0.05); but the blocker of α7 nicotinic acetylcholine receptor(α7nAChR) methyllycaconitine could suppress the rising of intracellular calcium induced by hydrocortisone(P<0.05).Conclusion Hydrocortisone enhances intracellular calcium via α7nAChR in microglial cells, which not only demonstrates the non-genomic effect of glucocorticoid, but also suggests that glucocorticoid could serve as endogenous ligand of α7nAChR.
glucocorticoid;microglia;α7nAChR;calcium;nicotine;MLA
时间:2017-5-25 17:44 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170525.1744.052.html
2016-12-15,
2017-01-10
广东省科技计划资助项目(No 2013B022000096);广东省自然科学基金资助项目(No 2016A030313568)
何舒翘(1991-),女,硕士生,研究方向:神经药理学,E-mail: 1547227027@qq.com; 张 梅(1971-),女,博士,教授,硕士生导师,研究方向:神经药理学,通讯作者,E-mail: zhmeic@hotmail.com
10.3969/j.issn.1001-1978.2017.06.026
A
1001-1978(2017)06-0878-06
R322.8;R348.1;R392.11;R977.11