CMPK1蛋白与阿霉素引起的多药耐药的相关性研究
陈淑娴,叶向晖,王 叙,金 坚
(江南大学药学院 药物设计与分子药理研究室,江苏 无锡 214122)
CMPK1蛋白与阿霉素引起的多药耐药的相关性研究
陈淑娴,叶向晖,王 叙,金 坚
(江南大学药学院 药物设计与分子药理研究室,江苏 无锡 214122)
阿霉素;IC50;药敏性;多药耐药;CMPK1;紫杉醇;吉西他滨
多药耐药(multidrug resistance, MDR)是在药物治疗的过程中,经一种药物的诱发导致细胞对其他结构和功能各异的药物也产生耐药的现象,具广谱耐药特性[1]。肿瘤细胞的MDR严重影响了临床疗效及患者预后,是引发化疗失败的主要原因[2]。MDR的机制较为复杂,单一靶点的抗肿瘤药物极易产生耐药[3],蒽环类化合物阿霉素(Adriamycin, ADM)虽自20世纪70年代进入临床使用以来就迅速成为乳腺癌一线使用药物,并被美国FDA认为最有效的化疗药物之一[4-5],但近些年日趋严重的MDR现象严重制约了其作为临床一线用药的使用,相较于MDR逆转剂的研究,对MDR具体机制的探究则更为迫切。我们此前首次应用含17 000种蛋白的芯片对阿霉素的作用靶点进行了研究,初步筛选出了14个阿霉素可能的作用靶点。针对近些年出现的阿霉素耐药现象,本文着重筛选阿霉素耐药相关蛋白并加以解析。
CMPK1定位于细胞质,以ATP为磷酸供体,将单磷酸胞苷酸(CMP)、尿苷酸(UMP)和脱氧胞苷酸[(d)CMP]磷酸化为对应的双磷酸胞苷酸(CDP)、尿苷酸(UDP)和脱氧胞苷酸[(d)CDP],为胞内的核酸合成提供前体物质,在细胞中起着重要的作用[6]。同时,CMPK1还可以有效激活脱氧胞苷酸类似物的活性,这些脱氧胞苷酸类似物可被用于抑制肿瘤或抗病毒方面的治疗,包括吉西他滨被用于胰腺癌等实体瘤、Ara-C被用于恶性血液病;并且ddC,3-TC可有效地抗自身免疫性病毒及乙肝病毒[7]。CMPK1是非小细胞肺癌和吉西他滨相关化疗方案预后因子[8-9]。在三阴性乳腺癌中CMPK1的细胞核定位可提示治疗的不良预后[10]。CMPK1与ADM的关系还未被研究过,本文着重探究CMPK1蛋白与阿霉素耐药的关系,并解析CMPK1低表达引发细胞阿霉素耐药的机制。
1 材料与方法
1.1 材料 HEK293细胞、MCF7细胞均引自中科院上海细胞库,MCF7/ADM细胞为笔者实验室建株。质粒、CMPK1抗体均来源于Origen公司。羊抗鼠辣根过氧化酶标记二抗为Proteintech公司产品。DMEM高糖培养基、胎牛血清、Lipo2000脂质体转染试剂均为Invitrogen公司产品。胰酶/EDTA、双抗均为吉诺公司产品。Cell-Titer Blue细胞活性检测试剂为Promega公司产品。CMPK1 siRNA为Santa Cruz公司产品。阿霉素购自大连美仑,紫杉醇购自红豆杉药业,吉西他滨为MedChem Express公司产品。RIPA裂解液购自碧云天。ECL显色试剂盒为七海生物公司产品。RNA提取试剂盒及逆转录试剂盒为TaKaRa公司产品。其他试剂均为国产分析纯。
1.2 方法
1.2.1 细胞培养 细胞均培养于含有10%胎牛血清,100 kU·L-1青霉素和100 kU·L-1链霉素的DMEM完全培养基中,MCF7细胞及MCF7/ADM细胞培养时补加终浓度2 kU·L-1的胰岛素,放置于37℃,5% CO2饱和湿度的恒温培养箱(Thermo Forma公司)培养。细胞传代时使用0.25%胰酶/EDTA。
1.2.2 质粒及siRNA转染 细胞常规培养至汇合度达80%~90%,胰酶消化收集细胞,每皿5×106加到10 cm细胞培养皿中,按照Lipo 2000脂质体转染试剂的说明书进行转染,18~40 h后进行后续试验。
1.2.3 IC50检测 参照马晓峰等[11],消化收集细胞,调整细胞浓度,按照5 000~8 000/孔接种于96孔细胞板。将待测药物进行倍比稀释,吸除96孔板中的培养基,将稀释好的药物按照每个浓度3个复孔加入到96孔板内,每孔100 μL,放置细胞培养箱正常培养48 h,取出96孔板,每孔加入10 μL CellTiter Blue试剂,继续放置于培养箱正常培养1~4 h,取出96孔板于酶标仪检测每孔荧光值IF(Excitation:560 nm;Emission:590 nm),按以下公式计算细胞活力,Graph Pad 5.0作图进行IC50分析。

1.2.4 RT-PCR检测基因表达 按照试剂盒要求操作,提取细胞RNA,NanoDrop 2000(Thermo Scientific公司)检测RNA浓度和纯度,10%甲醛变性琼脂糖凝胶电泳检测RNA的完整性,按照TaKaRa逆转录试剂盒进行逆转录,PCR扩增序列见Tab 1。PCR产物经1.5%琼脂糖电泳,紫外灯凝胶成像系统拍照,Image J分析各PCR条带灰度值,Graph Pad软件作图分析。
1.2.5 Western blot (WB)检测蛋白表达 胰酶消化收集细胞,并用PBS离心法洗涤3次,每次3 min,500×g,4℃。向细胞沉淀内加入RIPA后混匀并置于冰上裂解10 min,12 000×g离心15 min,取上清,NanoDrop 2 000检测蛋白浓度后将蛋白用RIPA调整至相同浓度,加入上样缓冲液于100℃热变性5 min,进行SDS-PAGE凝胶电泳,取出凝胶,按照顺序放置凝胶及PVDF膜后调整电压(100 V)及时间(60 min),转膜后取出PVDF膜,加入封闭液(5%脱脂奶粉:TBS配制)封闭1 h,PBST洗涤3次,每次5 min,加入一抗4℃孵育过夜,PBST洗涤3次,每次5 min,加入二抗37℃孵育1 h,按照ECL显色说明书要求进行显色,于成像仪进行拍照。Image J分析各条带灰度值,Graph Pad软件作图分析。

Tab 1 Primer for 14 genes of protein candidates and β-actin gene
1.3 统计学处理 采用Graph Pad软件进行组间t检验。
2 结果
2.1 质粒转染后细胞药敏性检测 Fig 1是分别转染14种质粒的HEK293细胞以及未转染的HEK293细胞对阿霉素的IC50,由图可见,与野生型细胞相比,转染后IC50增加的有:DYNLL1和COX6B2;转染后IC50降低的有:TNFAIP6、APOA2、TRMT112、MGAT1、COASY、CMPK1、CLIC1、DVL2。转染后细胞的IC50增加的程度较低,与对照组的比值均在2以内,而转染后IC50减少的细胞中,CMPK1过表达的细胞IC50最低,IC50HEK293-CMPK1/IC50HEK293-Control=0.15,P<0.01。提示作为转染后IC50变化最大的表达蛋白,CMPK1与细胞耐药相关的可能性较大,CMPK1高表达细胞对药物的耐受性降低,药敏性提高。
2.2 RT-PCR检测CMPK1基因表达 实验室人乳腺癌阿霉素耐药细胞MCF7/ADM是张莲芬等[12]建立的。RT-PCR对人乳腺癌亲本细胞MCF7和阿霉素耐药细胞MCF7/ADM内的14种相关基因进行分析,耐药细胞MCF7/ADM细胞中的CMPK1基因表达低于亲本细胞MCF7(P<0.05)。

Fig 1 IC50 assay of overexpression HEK293 cells to ADM
1:Control;2:TNF AIP6;3:APOA2;4:DYNLL1;5:TRMT112;6:MGAT1;7:SLC22A6;8:COASY;9:CMPK1;10:COX6B2;11:CLIC2;12:DVL2;13:ZNF684;14:TRDMT1;15:H3F3B.*P<0.05,**P<0.01vscontrol
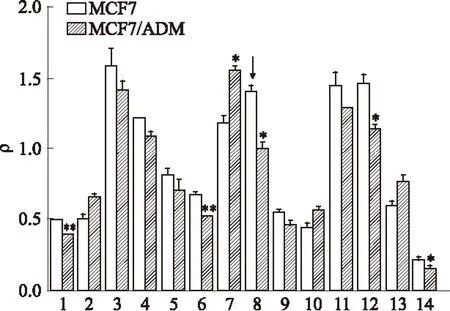
Fig 2 RT-PCR assay of gene expression in MCF7 cells and MCF7/ADM cells
ρ,means the expression of certain gene over β-actin gene.1:TNFAIF6;2:APOA2;3:DYNLL1;4:TRMT112;5:MGAT1;6:SLC22A6;7:COASY;8:CMPK1;9:COX6B2;10:CLIC2;11:DVL2;12:H3F3B;13:TRDMT1;14:ZNF684.*P<0.05,**P<0.01vsMCF7
2.3 WB检测CMPK1蛋白表达 Fig 3显示人乳腺癌耐药细胞MCF7/ADM中CMPK1蛋白的表达水平低于亲本MCF7细胞(P<0.01),CMPK1蛋白的表达在耐药细胞中有所降低,CMPK1表达的降低可能与细胞耐药相关。
2.4 CMPK1 siRNA作用后药敏性变化 MCF7细胞转染CMPK1 siRNA后,CMPK1蛋白表达水平下降(Fig 4),细胞对阿霉素的IC50增加:IC50MCF7-siCMPK1/IC50MCF7-Control=4.8,P<0.05,且CMPK1低表达的细胞对紫杉醇(IC50MCF7-siCMPK1/IC50MCF7-Control=3.6)、吉西他滨(IC50MCF7-siCMPK1/IC50MCF7-Control=3.5)的IC50也增加,P<0.05(Tab 2),表明CMPK1表达水平降低的同时,也降低了细胞对多种化疗药物的药敏性。细胞对药物的耐受性增加。
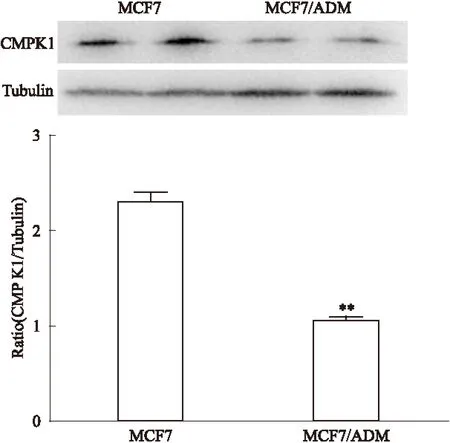
Fig 3 WB assay of CMPK1 expression in MCF7 cells and MCF7/ADM cells
**P<0.01vscontrol
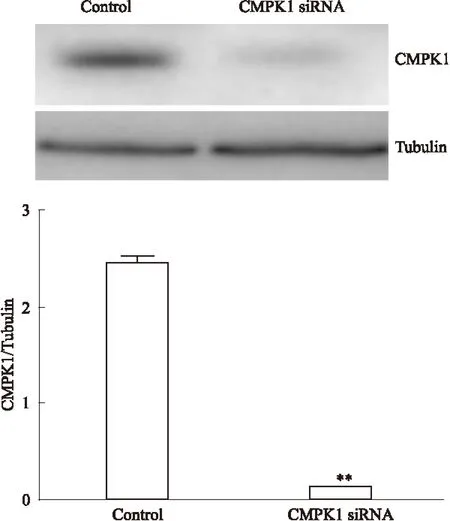
Fig 4 Expression of CMPK1 in CMPK1 siRNA transfected MCF7 cells and non-transfected control
**P<0.01vscontrol
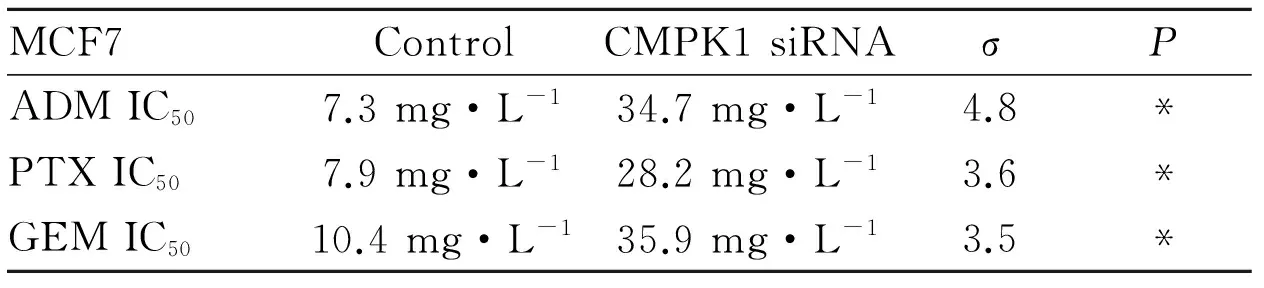
Tab 2 IC50 assays of CMPK1 siRNA transfected MCF cells and non-transfected control MCF7 cells
σ,means IC50MCF7-siCMPK1/IC50MCF7-Control,*P<0.05vscontrol
3 讨论
目前已经发现的与阿霉素引起的多药耐药相关的主要是ABC(ATP-binding cassette)转运蛋白家族,转运蛋白家族主要包括P糖蛋白、多药耐药相关蛋白等[13]。多药耐药细胞还表现出失巢凋亡(Anoikis)逃避现象[14]。药物在胞内的再修饰作用也与耐药相关,譬如参与阿霉素代谢修饰的醛酮还原酶家族[15]及羰基还原酶家族[16]等,将阿霉素代谢为阿霉素醇,从而减弱了阿霉素本身插入DNA的功能,文献表明阿霉素醇的毒性较阿霉素小了数10倍之多[17],阿霉素耐药细胞中这些酶的表达要远高于野生型细胞。
文中所用的14中质粒是此前实验组在Origene公司17K蛋白芯片[18]上的阳性筛选结果对应的质粒,前期实验表明该14种质粒表达的蛋白皆为阿霉素在细胞内可能的作用靶点,阿霉素引起的耐药已经引起众多研究者的注意并迫切需要解决,本文暂从细胞耐药方面考虑,从14个可能的结合位点中筛选阿霉素耐药相关蛋白。HEK293细胞的转染效率比较高,可以达到80%~90%。在不考虑质粒个体转染差异的前提下,我们选取了IC50变化最大的表达蛋白CMPK1作为研究对象。
文中药敏性检测结果表明CMPK1蛋白表达的增加提高了阿霉素的药敏性。Réjiba等[19]还发现CMPK1蛋白表达的增加亦可提高吉西他滨、氟尿嘧啶等核苷类似物的药敏性,并且Humeniuk等[20]发现氟尿嘧啶耐药细胞及吉西他滨耐药细胞中CMPK1的蛋白表达均有所下降,而本文阿霉素耐药细胞中CMPK1的蛋白表达亦有所下降,RT-PCR结果还表明耐药细胞的CMPK1基因表达降低。本文所用的阿霉素非核苷类似物,阿霉素耐药细胞中CMPK1蛋白含量的变化由因化疗药阿霉素引起,因而可以推断化疗药物阿霉素可能引发细胞内CMPK1蛋白含量的降低,进而引起细胞对多种药物的耐药,包括核苷类似物、紫杉醇类似物等的耐药。
CMPK包括CMPK1和CMPK2,CMPK2主要分布于线粒体[21],因而研究较多的为CMPK1,核苷类似物与CMPK1耐药的关系是由于CMPK1对核苷类似物的激活作用,因而其含量的变化与药物的效能密切相关。笔者对与CMPK1激酶作用后的ADM进行HPLC及LC/MS分析,研究表明与CMPK1作用后ADM本身的结构未发生变化或修饰,而是CMPK1的活性在ADM存在的情况下有所激活,因此我们猜测ADM耐药细胞导致CMPK1表达量的降低可能是由于ADM的持续使用而导致细胞内CMPK1活性的持续增加,而机体需要的CMPK1发挥的活性的量是一定的,细胞机体因此进行反馈调节,因而减少了CMPK1在蛋白水平的表达,进而又影响到ADM及其他药物的药敏性。研究又表明CMPK1可能与细胞外基质的紊乱及细胞周期的失调相关[10],紫杉烷类主要是影响细胞微管及微丝的聚合,影响细胞周期,因而CMPK1的变化引发紫杉醇的耐药可能与此相关。
简言之,CMPK1的表达与细胞对阿霉素的药敏性呈正相关,并可能因此引起紫杉烷类及核苷类似物的耐药。
(致谢:感谢前期Origen technology公司提供的蛋白芯片及技术支持,再此表示由衷的感谢。)
[1] 申 勇, 孙伟莉, 袁 超, 等. 99m Tc-MIBI 评价2-脱氧-D-葡萄糖对鼻咽癌耐药株多药耐药的逆转作用及机制[J]. 中国药理学通报, 2015, 31(10):1433-8.
[1] Shen Y, Shun W L, Yuan C, et al. Evaluation of reversal effect of 2-DE on multidrug resistance by detecting up take of 99m Tc-MIBI in HNE1/DDP cells[J].ChinPharmacolBull, 2015, 31(10): 1433-8.
[2] 林 姝, 焦旭阳, 赵 琳, 等. miR-181a 对乳腺癌耐药蛋白表达调控的研究[J]. 中国药理学通报, 2014, 30(8):1073-8.
[2] Lin S, Jiao X Y, Zhao L, et al. Regulatory effect of miR-181a on breast cancer resistance protein[J].ChinPharmacolBull, 2014, 30(8):1073-8.
[3] 于存志, 戚新明, 任 进. 靶向乳腺癌耐药蛋白逆转肿瘤耐药: 研究进展与药物开发[J]. 中国药理学通报,2014,30(5): 615-8.
[3] Yu C Z, Qi X M, Ren J. MCRP-targeted reverse of multidrug resistance: research progress and drug development[J].ChinPharmacolBull, 2014, 30(5): 615-8.
[4] Tacara O, Sriamornsak P, Dass C R. Doxorubicin: an update on anticancer molecular action, toxicity and novel drug delivery systems[J].JPharmPharmacol, 2013, 65:157-70.
[5] Yang F, Teves S S, Kemp C J, et al. Doxorubicin, DNA torsion, and chromatin dynamics[J].BiochimBiophysActa,2014,1845(1): 84-9.
[6] Hsu C H, Liou J Y, Dutschman G E, et al. Phosphorylation of Cytidine, Deoxycytidine, and their analog monophosphates by human UMP/CMP kinase is differentially regulated by ATP and magnesium[J].MolPharmacol, 2005, 67(3): 806-14.
[7] Topalis D, Nogueira T C, De Schutter T, et al. Resistance to the nucleotide analogue cidofovir in HPV(+) cells: a multifactorial process involving UMP/CMP kinase 1[J].Oncontarget, 2016, 7(9): 10386-401.
[8] Ryu J S, Shin E S, Nam H S, et al. Differential effect of polymorphisms of CMPK1 and RRM1 on survival in advanced non-small cell lung cancer patients treated with gemcitabine or taxane/cisplatinum[J],JThoracOncol,2011,6(8): 1320-9.
[9] Réjiba S, Bigand C, Parmentier C, et al. Gemcitabine-based chemogene therapy for pancreatic cancer using Ad-dCK:UMK GDEPT and TS/RR siRNA Strategies[J].Neoplasia, 2009, 11(7): 637-50.
[10]Liu N Q, De Marchi T, Timmermans A, et al. Prognostic signifcance of nuclear expression of UMP-CMP kinase in triple negative breast cancer patients[J].SciRep, 2016, 6:32027.
[11]马晓峰, 张莲芬, 屈 琳, 等. 化疗药体外干预诱导乳腺癌细胞产生耐药性的研究[J]. 中国药理学通报,2009, 25(11): 1456-9.
[11]Ma X F, Zhang L F, Qu L, et al. Induction of multidrug resistance in human breast cancer cells by exposure to chemotherapeutic druginvitro[J].ChinPharmacolBull, 2009, 25(11): 1456-9.
[12]张莲芬, 马晓峰, 金 坚, 等. 阿霉素和紫杉醇诱发的人乳腺癌耐药细胞株的比较[J]. 中国药理学通报,2009, 25(5): 609-13.
[12]Zhang L F, Ma X F, Jin J, et al. Comparison research on MDR human breast cancer cell lines induced by Adr and Tax[J].ChinPharmacolBull, 2009, 25(5): 209-13.
[13]张志强, 魏寅祥, 赵 青, 等. 瓦他拉尼对乳腺癌耐药蛋白介导的肿瘤多药耐药的逆转研究[J]. 中国药理学通报,2014,30(6): 774-82.
[13]Zhang Z Q, Wei Y X, Zhao Q, et al. Reversal effect of vatalanib on BCRP-mediated multidrug resistance[J].ChinPharmacolBull, 2014, 30(6): 774-82.
[14]Zheng H, Li Y, Wang Y, et al. Downregulation of COX-2 and CYP 4A signaling by isoliquiritigenin inhibits human breast cancer metastasis through preventing anoikis resistance, migration and invasion[J].ToxicolApplPharmacol, 2014, 280(1): 10-20.
[15]Hofman J, Malcekova B, Wsol V, et al. Anthracycline resistance mediated by reductive metabolism in cancer cells: The role of aldo-ketoreductase 1C3[J].ToxicolApplPharma, 2014, 278:238-48. [16]Heibein A D, Guo B, Parissenti A M, et al. Role of aldo-keto reductases and other doxorubicin pharmacokinetic genes in doxorubicin resistance, DNA binding, and subcellular localization[J].BMCCancer, 2012, 12: 381.
[17]Kassner N, Huse K, Wojnowski L, et al. Carbonyl reductase 1 is a predominant doxorubicin reductase in the human liver[J].DrugMetabDispos,2008,36:2113-20.
[18]Ma D H, Baruch D, He W W, et al. Using protein microarray technology to screen anti-ERCC1 monoclonal antibodies for specificity and applications in pathology[J].BMCBiotechnol, 2012, 12:88.
[19]Réjiba S, Bigand C, Parmentier C, et al. Gemcitabine-based chemogene therapy for pancreatic cancer using Ad-dCK::UMK GDEPT and TS/RR siRNA Strategies[J].Neoplasia,2009,11:637-50.
[20]Humeniuk R, Menon L G, Banerjee D, et al. Decreased levels of UMP kinase as a mechanism of fluoropyrimidine resistance[J].MolCancerTher, 2009, 8(5): 1037-44.
[21]Tsao N,Lee M H,Zhang W, et al. The contribution of CMP kinase to the efficiency of DNA repair[J].Cellcycle, 2015,14(3): 354-63.
Relationship between CMPK1 protein and ADM caused multidrug resistance
CHEN Shu-xian,YE Xiang-hui, WANG Xu, JIN Jian
(LaboratoryofdrugdesignandMolecularPharmacology,SchoolofMedicineandPharmaceutics,JiangnanUniversity,WuxiJiangsu214122,China)
Aim To assay the possible targets of adriamycin (ADM), screening ADM resistance related proteins. Methods The drug sensitivity of the cells was analyzed by IC50assay; RT-PCR assay was used to detect the expression of genes in the cells; CMPK1 protein expression was tested by Western blot assay; the expression of CMPK1 in the cells was decreased by siRNA of CMPK1. Results Data from IC50assay showed the sensitivity of cells transfected with CMPK1 was increased most(IC50HEK293-CMPK /IC50HEK293-Control=0.15,P<0.01), and the expression of CMPK1 protein in ADM resistant breast cells (MCF7/ADM) was lower than that in parent MCF7 cells (P<0.05). When the expression level of CMPK1 was decreased by CMPK1 siRNA, the sensitivity of MCF7 cells to ADM decreased (IC50MCF7-siCMPK1/IC50MCF7-Control=3.6,P< 0.01), and the sensitivity of MCF7 cells to paclitaxel and gemcitabine also decreased. Conclusions CMPK1 was related to the multidrug resistance of cells, and the expression of CMPK1 was positively related to the sensitivity to drugs, which provides the possibility of CMPK1 as a target in the treatment of multidrug resistance.
adriamycin; IC50; drug sensitivity; CMPK1; paclitaxel; gemcitabine
时间:2017-5-25 17:44 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170525.1744.020.html
2017-01-10,
2017-03-01
国家自然科学基金国际(地区)合作与交流项目(No 81361168001);江苏省临床医学科技专项(No BL 2014019)
陈淑娴(1986-),女,博士,研究方向:药物设计与分子药理学,E-mail:csx.ss@163.com; 金 坚(1960-),男,博士,教授,博士生导师,研究方向:药物设计与分子药理学,通讯作者,E-mail:jinjian31@hotmail.com
10.3969/j.issn.1001-1978.2017.06.010
A
1001-1978(2017)06-0788-05
R329.24;R394.2;R737.902.2;R737.905.3;R979.1;R977.6摘要:目的 对阿霉素可能的作用靶点进行分析,筛选阿霉素耐药相关蛋白。方法 质粒转染HEK239细胞以构建蛋白高表达模型;IC50检测细胞的药敏性;RT-PCR检测细胞内基因的表达;Western blot检测CMPK1蛋白的表达;CMPK1 siRNA构建CMPK1蛋白低表达模型。结果 IC50检测结果表明高表达CMPK1蛋白的细胞对阿霉素的敏感性增加程度最大(IC50HEK293-CMPK1/IC50HEK293-Control=0.15,P<0.01),且阿霉素耐药细胞(MCF7/ADM)中CMPK1蛋白的表达低于乳腺癌亲本细胞MCF7(P<0.05)。MCF7细胞中,CMPK1蛋白表达水平经CMPK1 siRNA下调之后,对阿霉素的药敏性随之降低 (IC50MCF7-siCMPK1/IC50MCF7-Control=3.6,P<0.01),且对紫杉醇、吉西他滨的药敏性也随之降低。结论 CMPK1与细胞的多药耐药相关,且CMPK1蛋白的表达与药敏性呈正相关,提示了CMPK1作为多药耐药治疗靶点的可能性。