2型糖尿病大鼠心肌PI3K/Akt/mTOR信号通路的改变及Sirt1的调控机制研究
孙晓慧,王 燕,牟艳玲
(1.济南大学 山东省医学科学院医学与生命科学学院,山东 济南 250200;2.山东省医学科学院药物研究所,山东 济南 250062;3.国家卫生部生物技术药物重点实验室,山东 济南 250062;4.山东省罕少见病重点实验室,山东 济南 250062)
2型糖尿病大鼠心肌PI3K/Akt/mTOR信号通路的改变及Sirt1的调控机制研究
孙晓慧1,2,3,4,王 燕2,3,4,牟艳玲2,3,4
(1.济南大学 山东省医学科学院医学与生命科学学院,山东 济南 250200;2.山东省医学科学院药物研究所,山东 济南 250062;3.国家卫生部生物技术药物重点实验室,山东 济南 250062;4.山东省罕少见病重点实验室,山东 济南 250062)
目的 检测Sirt1及PI3K/Akt/mTOR信号通路相关蛋白在糖尿病大鼠心肌及高糖培养的H9C2细胞中的表达变化,明确其在糖尿病心肌病发生发展中的作用。方法 高脂饮食联合链脲佐菌素建立2 型糖尿病大鼠模型,实验将大鼠分为糖尿病2周、4周、8周模型组和对照组,超声心动图检测大鼠心功能变化,Western blot检测大鼠心肌Sirt1、PI3K、Akt、mTOR、S6K1蛋白表达变化。将H9C2细胞分为正常对照组、DMSO组(78.12 mmol·L-1)、高糖(HG)组(33 mmol·L-1)、白藜芦醇(Res)组(20 μmol·L-1)、尼克酰胺(Nam)组(40 mmol·L-1),Western blot及qRT-PCR研究心肌细胞Sirt1、PI3K、Akt、mTOR、S6K1相关蛋白基因转录及表达,研究Sirt1对该信号通路的调控机制。结果 在动物实验中,与2周DM大鼠比较,8周DM大鼠心肌Sirt1蛋白表达明显增加。2周模型组大鼠相对于正常对照组心肌PI3K、Akt、mTOR、S6K1表达明显增加,且S6K1表达4 周模型组比2周模型组增加更明显,但8周表达降低。在高糖培养的H9C2细胞中,与对照组相比,高糖组Sirt1, PI3K, Akt, mTOR和S6K1表达明显增高。Nam处理组Sirt1表达明显降低,PI3K, Akt, mTOR和S6K1表达增高。Res处理组Sirt1表达明显增高,而PI3K, Akt, mTOR和S6K1表达降低。结论 Sirt1通过负调控PI3K/Akt/mTOR信号通路参与糖尿病心肌损伤,参与早期糖尿病心肌病的发生发展。
2型糖尿病;PI3K/Akt/mTOR信号通路;Sirt1;心功能;心肌损伤;白藜芦醇;尼克酰胺
近年来,糖尿病(diabetes mellitus,DM)患病率急剧上升,已成为影响人类身体健康的主要疾病之一。糖尿病若未能得到及时诊断和正规治疗,可引起多种慢性并发症。其中,糖尿病心肌病(diabetic cardiomyopathy,DCM)是DM心血管并发症中一种独立、特异的心肌病,与糖尿病患者发生心力衰竭和死亡率升高密切相关,是DM患者死亡的主要原因[1]。 研究表明,PI3K/Akt/mTOR信号通路调节多种细胞的生命活动,包括细胞的生长、增殖和分化,其过度激活参与糖尿病视网膜病变、糖尿病肾病、认知功能障碍和胰岛素抵抗等[2]。此外,Sirt1作为体内关键的生物信号调节因子,广泛参与多种信号通路的激活与抑制调控,已被广泛研究。有研究表明[3],Sirtl失活条件下,PI3K/Akt/mTOR通路激活,进而诱发动脉粥样硬化发生。而在2型DCM中,Sirt1对该信号通路的调控作用尚未明确。本文通过检测Sirtl及PI3K/Akt/mTOR信号通路相关蛋白在DM大鼠心肌及高糖培养的H9C2细胞中的表达变化,并将白藜芦醇和尼克酰胺——Sirt1的特异性激动剂及抑制剂作用于高糖培养的H9C2细胞中,探讨Sirtl对该信号通路的调控作用,为糖尿病心肌病的治疗提供理论基础。
1 材料与方法
1.1 实验动物及模型建立 体质量200~220 g的♂健康SD大鼠40只,购自山东鲁抗医药股份有限公司实验动物中心。适应性喂养1周后,采用高脂饮食(猪油30%,胆固醇2.5%,脱氧胆酸钠1%,常规饲料66.5%)随机对30只大鼠灌胃,设为糖尿病模型组(DM组),另设正常对照组(Control组)10只,并于5周末禁食12 h后,DM组大鼠一次性腹腔注射1%链脲菌素(30 mg·kg-1,pH=4.5柠檬酸-柠檬酸三钠缓冲液),Control组大鼠注射同体积柠檬酸-柠檬酸三钠缓冲液。72 h后尾静脉采血,血糖试纸检测空腹血糖值(fasting blood glucose,FBG)。DM组造模成功大鼠随机分为2周模型组、4周模型组和8周模型组,继续高脂饮食灌胃,Control组继续以普通饲料喂养8周。
1.2 细胞及模型建立 大鼠心肌细胞株H9C2,由美国标准菌种收藏所提供。将对数生长期细胞分为正常对照组、DMSO组(78.12 mmol·L-1)、高糖(HG)组(33 mmol·L-1)、白藜芦醇(Res)组(20 μmol·L-1)、尼克酰胺(Nam)组(40 mmol·L-1),作用24 h。
1.3 材料与试剂 链脲菌素、戊巴比妥钠(美国Sigma公司);血糖试纸(强生中国医疗器材有限公司);SABC免疫组化染色试剂盒(武汉博士德生物技术有限公司);辣根酶标记山羊抗兔(北京中杉金桥生物技术有限公司);TRIzol(上海东洋纺生物科技有限公司);RIPA裂解液、Western转膜液、BCA蛋白浓度测定试剂盒、SDS-PAGE凝胶配制试剂盒和SDS-PAGE电泳液均购自碧云天生物技术研究所;PVDF膜(0.45 μm,美国SERVA公司);所用单克隆抗体为:Sirt1(美国Novus公司),PI3K、Akt、mTOR(美国Cell Signaling Technology公司),S6K1(美国Abcam公司)。
1.4 大鼠空腹血糖检测 DM组大鼠分别于2、4和8周末禁食12 h,颈静脉窦取血,离心分离血清,检测FBG及胰岛素(fasting insulin,FINS)水平,计算胰岛素敏感指数(insulin sensitive index,ISI),公式为 ISI=ln[1/(FINS×FBG)]。
1.5 大鼠超声心动图 大鼠分别于造模2、4、8周末,禁食12 h,戊巴比妥钠腹腔注射麻醉,并固定于手术台上,使用小动物超声成像系统Vevo 2100(维胜中国)检测左心室舒张末期内径(left ventricular internal diastolic diameter,LVIDd)、左心室收缩末期内径(left ventricular internal diameter at end-systole,LVIDs)、左室舒张末期室壁厚度(left ventricular posterior wall thickness in diastole,LVPWd)、左室收缩末期室壁厚度(left ventricular posterior wall thickness in systole,LVPWs)、短轴缩短率(fractional shortening,FS)、左心室射血分数(left ventricular ejection fraction, LVEF)及左心室质量(left ventricular mass,LV Mass)。
1.6 大鼠心肌标本收集 大鼠麻醉后迅速取出心脏,用预冷生理盐水洗净并用滤纸吸干,剔除血管、脂肪等非心肌组织,分别称取心脏重量(heart weight,HW)和左心室(含室间隔)重量(LV Mass),并计算心脏(左心)指数=心脏(左心室)重量(mg)/体重(g),置于-80℃中保存待用。
1.7 Western blot实验 提取蛋白,BCA法测定各组总蛋白浓度,于SDS-PAGE凝胶电泳进行分离。冰浴下湿法转膜2h后,用体积分数为5%的脱脂奶粉封闭1 h,一抗4℃孵育过夜。次日与辣根过氧化物标记的二抗共孵育,用增强型化学发光试剂进行显色,并利用灰度分析软件定量分析。
1.8 qRT-PCR 将细胞用胰蛋白酶消化,1 000 r·min-1,离心5 min收集细胞。按TRIzol提取程序(说明书)提取细胞总RNA,按AWV逆转录试剂盒操作说明进行逆转录后,4℃保存。各目的基因的扩增引物序列如Tab 1所示,扩增条件:94℃预变性3 min,然后94℃变性30 s,55℃变性30 s,72℃延伸60 s,共35个循环,最后72℃延伸5 min,快速冷却至4℃保存。2%琼脂糖凝胶电泳后,凝胶成像仪观察。用BandScan5.0软件测定条带灰度值,进行统计学分析。
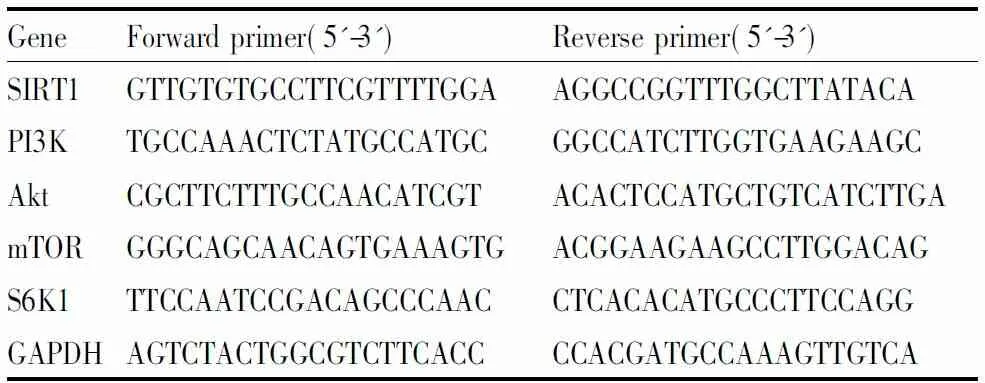
Tab 1 PCR primer used in experiment

2 结果
2.1 大鼠DM模型建立情况 实验期间,Control组大鼠一般状态良好、健壮、皮毛有光泽,对外界反应灵敏,无死亡。与Control组比较,DM组大鼠精神萎靡,皮毛无光泽,出现多饮、多食、多尿,腥臊酮臭味加重等。STZ造模后72 h,检测高糖模型成功28只。DM组大鼠与对照组大鼠比较,血清FBG、FINS明显升高(P<0.05),ISI明显下降(P<0.01),表明2型糖尿病大鼠造模成功。见Tab 2。


GroupnFBG/mmol·L-1FINS/mU·L-1ISIControl105.973±0.13722.147±0.586-5.084±0.998DMMod-el2831.341±0.368*28.817±0.743*-7.132±0.577**
*P<0.05,**P<0.01vscontrol
2.2 糖尿病大鼠超声心动图变化 与对照组比较,2周 DM大鼠的LVIDd及LVIDs值明显增大(P<0.05),LVPWd及LVPWs明显增厚(P<0.05),FS及LV Mass值明显降低(P<0.01),LVEF及LVMass/Body Weight值无明显变化;随着糖尿病的发展,4周、8周 LVIDd、LVIDs、LVPWd及LVPWs值增加更明显(P<0.01),FS、LVEF及LV Mass值降低更明显(P<0.01),LV Mass/Body Weight值增加更明显(P<0.01),且与2周 DM组比较,都具有明显差异(P<0.05)。见Fig 1和Tab 3。
Tab 3 Changes of structural and functional parameters in left ventricle of DM ±s)
LVIDd, Left ventricle(LV) internal diameter in diastole;LVIDs,LV internal diameter in systole;LVEF,LV ejection fraction;FS,fractional shortening,and LV Mass(AW) were automatically calculated by the ultrasound machine.*P<0.05,**P<0.01vsND group;△P<0.05,△△P<0.01vs2 week DM
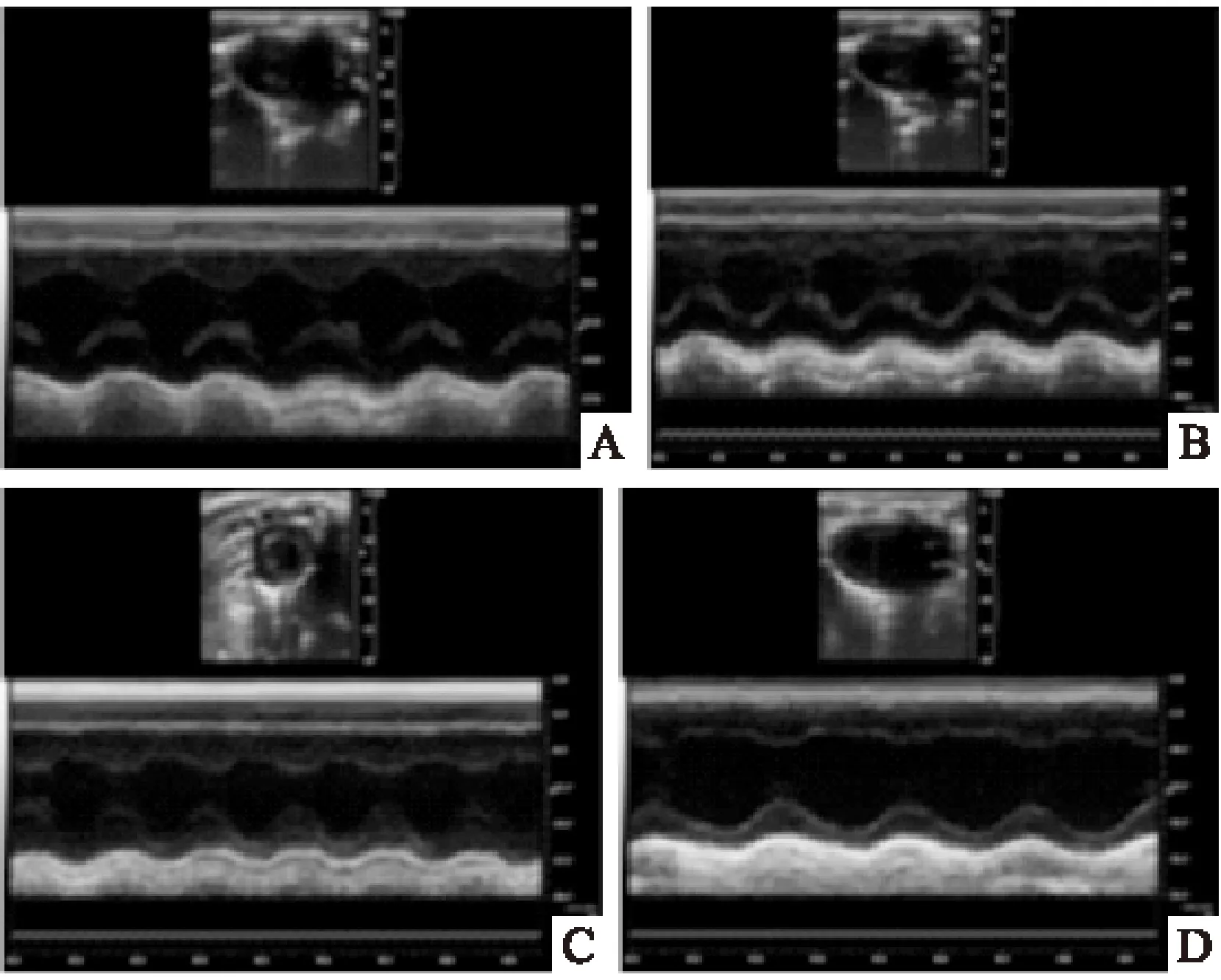
Fig 1 Representative images of M-modechocardiogram
A:Control group;B:2 wk DM;C:4 wk DM; D:8 wk DM
2.3 糖尿病大鼠心肌SIRT1/PI3K/Akt/mTOR信号通路相关蛋白的变化 WB结果表明,2周、4周 DM大鼠心肌中Sirt1蛋白的表达相对于Control组无明显变化,但与2周 DM大鼠比较,8周 DM大鼠心肌表达明显增加(P<0.01)。与Control组大鼠比较,2周 DM大鼠PI3K、Akt、mTOR及S6K1表达明显增加(P<0.01),2周之后,PI3K、Akt、mTOR表达无明显变化,但S6K1在4周增加最明显(P<0.01),8周表达降低。见Fig 2。
2.4 高糖条件下大鼠心肌细胞SIRT1/PI3K/Akt/mTOR信号通路相关蛋白的变化 WB结果表明,与对照组相比,高糖组Sirt1, PI3K, Akt, mTOR 和S6K1表达明显增高。与高糖组相比,Nam处理组Sirt1表达明显降低,PI3K、Akt、mTOR和S6K1表达增高。Res处理组PI3K、Akt、mTOR和S6K1表达降低,结果见Fig 3。

Fig 2 Expression of PI3K,Akt,mTOR,S6K1,Sirt1 in cardiac tissue from each group via ±s,n=28)
A:Respresentative Western blot analysis of the time-dependent changes of protein levels; B:Bar graph shows quantification of protein levels(fold of net intensity of bands with β-actin).**P<0.01vscontrol;△△P<0.01vs2 wk DM
2.5 qRT-PCR检测高糖条件下大鼠心肌细胞SIRT1/PI3K/Akt/mTOR信号通路相关基因的变化 qRT-PCR结果与上述WB结果相一致,高糖培养H9C2细胞中Sirt1及PI3K/Akt/mTOR信号通路相关基因(PI3K、 Akt、mTOR、S6K1)表达明显增高。Nam处理组Sirt1表达明显降低, PI3K/Akt/mTOR信号通路相关基因表达增高。Res处理组Sirt1表达明显增高,而PI3K/Akt/mTOR信号通路相关基因表达降低,见Fig 4。

Fig 3 Expression of Sirt1,PI3K,Akt,m-TOR

A:Respresentative Western blot analysis of the changes of protein levels; B:Bar graph shows quantification of protein levels(fold of net intensity of bands with β-actin).**P<0.01vscontrol group;△△P<0.01vsHG group
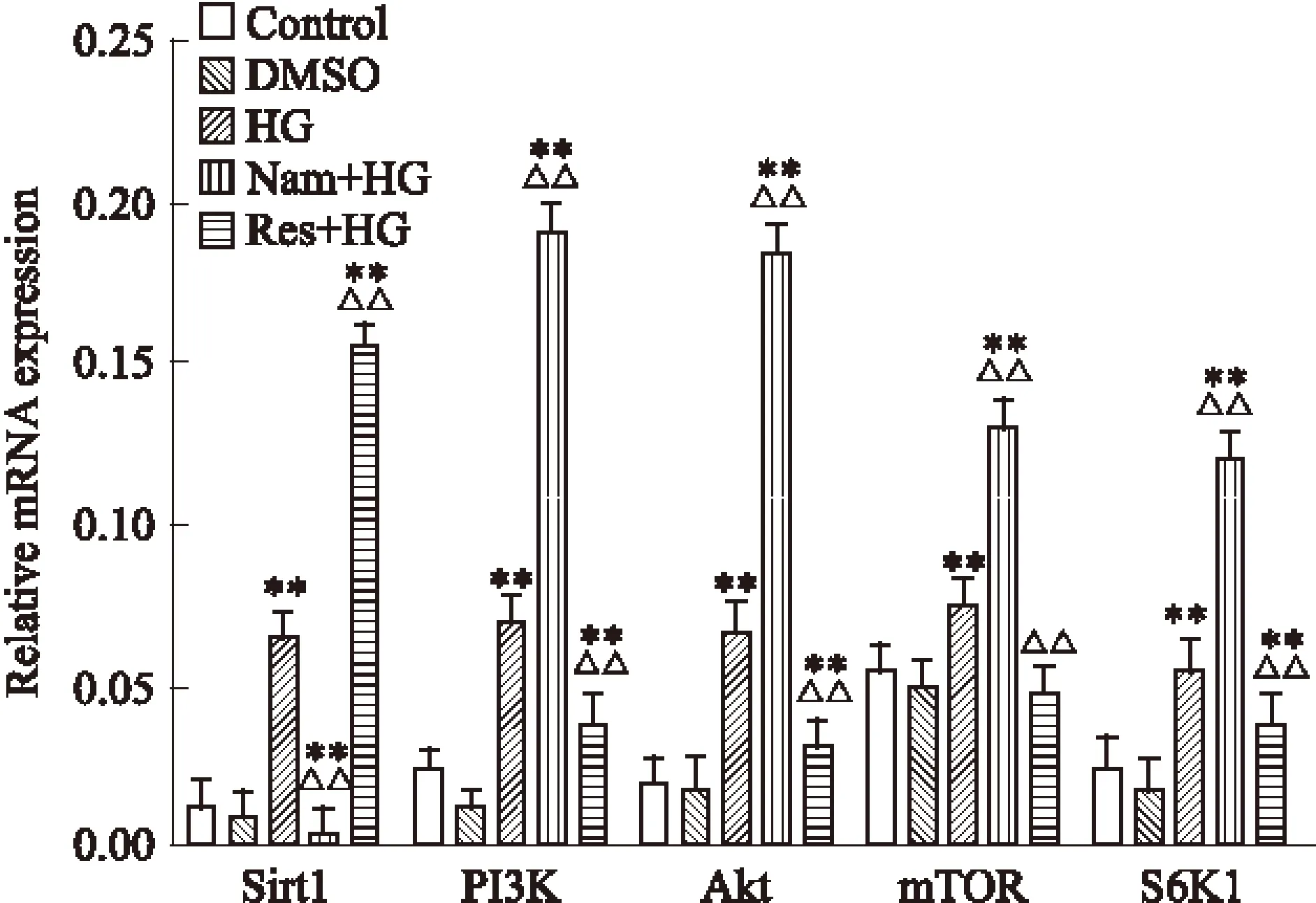
Fig 4 The mRNA expression of Sirt1,PI3K, Akt, mTOR and S6K1 in total RNA extracts from H9C2 cells using ±s)
Bar graph shows quantification of mRNA expression(2-ΔCt).**P<0.01vscontrol;△△P<0.01vsHG
3 讨论
PI3K/Akt/mTOR信号通路是目前研究的热点[4]。PI3K作为该信号通路的起始因子,可被多种生长因子激活,各种生长因子作用于膜受体而使PI3K激活,然后质膜上产生第二信使PIP3,PIP3与细胞内含有PH结构域的信号蛋白Akt和PDK1结合,促使PDK1磷酸化Akt蛋白的Thr308位点,促使Akt活化。活化的Akt可以磷酸化激活其下有多种靶蛋白如mTOR,进而诱导细胞生长,促进细胞存活,是重要的抗凋亡调节因子。
沉默信息调节因子1(silent informationregulator1,Sirt1)为哺乳动物Sirtuins家族成员之一,是一种依赖于烟酰胺腺嘌呤二核苷酸(NAD+)的去乙酰化酶,与酵母沉默信息调节因子2(silent informationregulator 2, Sir2)高度同源。人们将在哺乳动物体内发现的Sir2的同源基因按照其发现的先后顺序依次称为Sirt1-7,并统称为Sirtuins家族。其中,Sirt1在DNA修复、体内能量平衡、氧化还原平衡、抗衰老及胰岛素分泌等方面具有重要的调控功能[5-6]。白藜芦醇是葡萄中含有的一种多羟基酚类化合物,具有抗氧化、抗肿瘤、保护心血管、保护肝细胞、抗肥胖的功效,特异性激活Sirt1[7],提高Sirt1蛋白表达量并升高其活性[8]。尼克酰胺是Sirt1特异性抑制剂,能防止STZ处理的胰岛细胞中NAD+减少,抑制胰岛素前体合成,延迟STZ诱导的糖尿病的发生[9]。Sirt1可以通过调节FOXOs、Wnt等相关信号通路,对多种心血管疾病的病理生理过程产生重要影响,发挥保护心肌、舒张血管、抑制动脉粥样硬化等作用[10-12]。研究表明[13],Sirt1可以通过抑制PI3K/Akt/mTOR信号通路,发挥神经保护作用。Takeda等[3]认为,在单核-吞噬细胞中,Sirtl失活条件下,PI3K/Akt/mTOR通路激活,进而诱发动脉粥样硬化发生。但是,Sirt1在2型糖尿病心血管系统对PI3K/Akt/mTOR信号通路的调节还不清楚。
本研究表明,DM大鼠Sirt1及PI3K、Akt、mTOR表达较对照组明显增加,其下游S6K1表达2周模型组大鼠相对于正常对照组表达明显增加,且4周模型组比2 周模型组增加更明显,8周表达降低,说明8周之内Sirt1被激活,而PI3K/Akt/mTOR信号通路有表达降低的趋势,因此我们推断,在2型DCM中,Sirt1可抑制该信号通路的表达。为了研究二者之间的调控机制,我们采用体外研究的方法,构建细胞高糖模型。在高糖培养的H9C2细胞中,WB及qRT-PCR结果表明,与对照组相比,高糖组Sirt1、PI3K、Akt、mTOR和S6K1表达明显增高,表明高糖条件下H9C2细胞Sirt1及PI3K/Akt/mTOR信号通路激活,与DM大鼠心肌中相应蛋白表达结果相一致。Nam处理组Sirt1表达明显降低,导致PI3K、Akt、mTOR和S6K1表达增高。Res处理组Sirt1表达明显增高,而PI3K, Akt, mTOR和S6K1表达降低。表明在高糖诱导的H9C2细胞中,Sirt1低表达时,PI3K/Akt/mTOR信号通路激活;Sirt1高表达时,PI3K/Akt/mTOR信号通路被抑制。因此,我们得出结论,Sirt1作为PI3K/Akt/mTOR信号通路的上游调节因子,通过负调节PI3K/Akt/mTOR信号通路,参与糖尿病心肌病的发生发展。
综上所述,Sirt1/PI3K/Akt/mTOR信号通路在糖尿病心肌病的发生和发展过程中被激活,参与早期糖尿病心肌损伤。糖尿病心肌病是糖尿病性心脏病的特异性病变,是糖尿病心血管严重并发症的重要组成部分,明确其发生发展过程中心肌相关指标的变化,进而做到早期诊断成为研究热点。我们将深人了解其在糖尿病心肌病中的作用并阐明其机制,以期为糖尿病心肌病的早期治疗提供理论依据。
(致谢:本实验全部由山东省医学科学院药物研究所药理学实验室牟艳玲老师课题组独立完成,感谢山东省医学科学院医药卫生科技创新工程的资助。)
[1] 尹茂山, 许淑红, 王 燕, 等. 2型糖尿病大鼠主动脉Wnt/-catenin信号通路的变化及SIRT1的调节作用[J]. 中国药理学通报,2016, 33(3): 337-42.
[1] Yin M S, Xu S H, Wang Y, et al. Alteration of Wnt/-catenin signaling pathway in type 2 diabetic rats′aorta and regulation of SIRT1[J].ChinPharmacolBull, 2016, 33(3): 337-42.
[2] Zhang C, Yoon M S, Chen J. Amino acid-sensing mTOR signaling is involved in modulation of lipoly by chronic insulin treatment in adipocytes[J].AmJPhysiolEndocrinolMetab, 2009, 296(4): 862-8.
[3] Takeda W A, Kitada M, Kanasaki K, et al. SIRT1 in activation induces inflammation through the dysregulation of autophagy in human THP-1 cells[J].BiochemBiophysResCommun, 2012, 427(1): 191-6.
[4] Papadimitrakopoulou V.Development of PI3K/Akt/mTOR pathway inhibitors and their application in personalized therapy for non-small-cell lung cancer[J].JThoracOncol,2012,7(8):1315-26.[5] Vetterli L, Brun T, Giovannoni L, et al. Resveratrol potentiates glucose-stimulated insulin secretion in INS-1E beta-cells and human islets through a SIRT1-dependent mechanism[J].JBiolChem,2011,286:6049-60.
[6] Shoba B,Lwin Z M,Ling L S, et al. Function of sirtuins in biological tissues[J].AnatRec,2009,292:536-43.
[7] Bagul P K,Banerjee S K. Application of resveratrol in diabetes: rationale, strategies and challenges[J].CurrMolMed,2015,15:312-30.
[8] Jian B. Resveratrol restores Sirtuin(SIRT1) activity and pyruvate dehydrogenase kinase1 expression after hemorrhagic injury in a rat model[J].MolMed, 2014, 20(1):10-6.
[9] Zhang Y, Rosnberg P A. Caspase-1 and poly(ADP-tibose) polymerase inhibitors may protect against peroxynitrite-induced neurotoxicity independent of their enzyne inhibitor activity[J].EurJNeurosci, 2014, 20(7): 1727-36.
[10]Cappetta D, Esposito G,Piegari E,et al. SIRT1 activation attenuates diastolic dysfunction by reducing cardiac fibrosis in a model of anthracycline cardiomyopathy[J], 2016,15(205):99-110.
[11]Hu M Z,Zhou B,Mao H Y, et al.Exogenous hydrogen sulfide postconditioning protects isolated rat hearts from ischemia/reperfusion injury through Sirt1/PGC-1α signaling pathway[J].IntHeartJ,2016,29:3249-99.
[12]尹茂山, 牟艳玲. Sirt1与心肌保护[J]. 生命科学, 2015, 27(5): 601-7.
[12]Yin M S, Mu Y L. The function of Sirt1 in myocardial protection[J].ChinBullofLifeSci, 2015, 27(5): 601-7.
[13]Ma L,Dong W,Wang R,et al. Effect of caloric restriction on the SIRT1/mTORsignaling pathways in senile mice[J].BrainResBull,2015,116:67-72.
Alteration of PI3K/Akt/mTOR signaling during development of diabetic cardiomyopathy and regulation of SIRT1
SUN Xiao-hui1,2,3,4, Wang Yan2,3,4, MU Yan-ling2,3,4
(1.SchoolofMedicineandLifeSciences,UniversityofJinan-ShandongAcademyofMedicalSciences,Jinan250200,China;2.InstituteofMateriaMedica,ShandongAcademyofMedicalSciences,Jinan250062,China;3.KeyLaboratoryforBiotech-Drugs,MinistryofHealth,Jinan250062,China;4.KeyLaboratoryforRare&UncommonDiseasesofShandongProvince,Jinan250062,China)
Aim To investigate the alteration of Sirt1 and PI3K/Akt/mTOR signaling pathway in type 2 diabetic rats′cardiomyopathy and clarify its role in development of diabetic myocardium.Methods The type 2 diabetes rat model was established by injection of streptozocin after five-week of high fat diet.The rats were randomly divided into model group of 2 weeks, model group of 4 weeks, model group of 8 weeks and control group.The changes of heart function were detected by echocardiography. The alteration of Sirt1, PI3K, Akt, mTOR and S6K1 in myocardium was determined by Western blot.The myocardial cells were randomly divided into following groups:① Control group(normal glucose concentration, 5.5 mmol·L-1);② DMSO group(78.12 mmol·L-1);③ High glucose group(HG,33 mmol·L-1);④ HG+Res(20 μmol·L-1) group;⑤ HG+Nam(40 mmol·L-1) group. The alteration of Sirt1, PI3K, Akt, mTOR and S6K1 in H9C2 cells was determined by Western blot and qRT-PCR.Results WB results showed that Sirt1 was markedly increased in 8 weeks DM rats,compared with 2 weeks DM rats. However,the expressions of PI3K, Akt and mTOR in 2 weeks were significantly increased, without significant change in 4 and 8 weeks. The increased expression of mTOR induced accumulation of S6K1, which was also remarkably increased in 4 weeks after STZ injection, and then it was decreased as DCM developed. WB and qRT-PCR results showed that the expressions of Sirt1, PI3K, Akt, mTOR and S6K1 in HG group were significantly increased compared with control group. Nam treatment significantly lowered Sirt1 expression, resulting in a higher expression of PI3K, Akt, mTOR and S6K1. However,H9C2 cells treated with Res showed a higher expression of Sirt1, resulting in a lower expression of PI3K, Akt, mTOR and S6K1.Conclusion Sirt1 could negatively regulate mTOR signaling in DCM and these changes may be valuable to find a new therapeutic target for diabetic cardiomyopathy.
type 2 diabetes;mTOR signaling pathway;Sirt1;heart function; myocardial injury; resveratol; nicotinamide
时间:2017-5-25 17:44 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170525.1744.022.html
2016-12-15,
2017-02-27
国家自然科学基金资助项目(No 30701022);山东省医学科学院医药卫生科技创新工程;山东省优秀中青年科学家科研奖励基金计划(No BS2013SW008)
孙晓慧(1992-),女,硕士,研究方向:心血管药理学,E-mail:1214576499@qq.com; 牟艳玲(1975-),女,博士,副研究员,研究方向:心脑血管药理学,通讯作者,E-mail:myling501@hotmail.com
10.3969/j.issn.1001-1978.2017.06.011
A
1001-1978(2017)06-0793-06
R-332;R322.11;R341;R394.2;R587.2