异丙酚对宫内窘迫胎鼠的神经保护作用
蔡劲松,冯 帅,戚 翔,梁 治,徐 雪
(河北医科大学二院麻醉科,河北 石家庄 050000)
异丙酚对宫内窘迫胎鼠的神经保护作用
蔡劲松,冯 帅,戚 翔,梁 治,徐 雪
(河北医科大学二院麻醉科,河北 石家庄 050000)
异丙酚;胎鼠宫内窘迫;缺血/再灌注损伤;神经元损伤指数;丙二醛;荷包牡丹碱
很多宫内窘迫的胎儿在出生后会罹患新生儿脑病,出现认知功能障碍、癫痫、脑瘫甚至死亡,给患者、家庭以及社会都带来沉重的负担[1-2]。异丙酚是一种临床广泛应用的全身麻醉药,很多研究表明异丙酚对全脑缺血大鼠及体外培养的神经细胞具有神经保护作用[3-5],但其对宫内窘迫的胎鼠是否具有神经保护作用在国内还未见报道,国外的研究也有限且结论不一。本研究拟利用胎鼠的宫内窘迫模型,观察异丙酚施加于孕鼠后对胎鼠神经细胞是否具有保护作用。
1 材料与方法
1.1 动物及分组 清洁级成年SD大鼠24只,其中♀ 18只,♂ 6只,体质量240~280 g。将♀鼠与♂鼠分别随机编号,按♀ ∶♂为3 ∶1合笼。次日晨进行阴道涂片镜检,若发现精子即可确定交配,记为孕0 d,孕18 d时进行实验。 将孕鼠编号后随机分为6组,每组3只。S组(假手术组):孕鼠剖腹手术前30 min,使用大鼠固定器在清醒状态下经尾静脉注射生理盐水1 ml,孕鼠仅接受剖腹手术,不夹闭双侧子宫动脉。IR组(缺血/再灌注组):孕鼠剖腹手术前30 min,经尾静脉注射生理盐水1 ml,术中夹闭双侧子宫动脉以造成胎鼠宫内窘迫。P1~P3组(异丙酚组):孕鼠剖腹手术前30 min,经尾静脉分别注射异丙酚10,30,50 mg·kg-1,术中夹闭双侧子宫动脉以造成胎鼠宫内窘迫。B组(荷包牡丹碱组):孕鼠剖腹手术前30 min,经尾静脉注射异丙酚50 mg·kg-1,同时腹腔注射荷包牡丹碱5 mg·kg-1,术中夹闭双侧子宫动脉以造成胎鼠宫内窘迫。以上各组于关腹后3 d剖宫取胎鼠脑组织。
1.2 胎鼠宫内窘迫模型的制备 体积分数为0.10的水合氯醛3 mg·kg-1腹腔麻醉,待其意识、角膜反射消失,肌松良好后,仰卧位固定于手术台上。备皮、消毒后铺单,逐层剪开下腹部皮肤、肌层,暴露妊娠子宫及通向子宫卵巢的血管。小心分离出双侧子宫卵巢动脉后,用两个无创动脉钳夹分别夹闭两侧动脉以造成胎鼠宫内窘迫。术中用温湿的生理盐水纱布及高架台灯保持妊娠子宫及腹腔内的温度。11 min后去除动脉钳夹恢复子宫及胎盘血供。确定其再灌注情况良好后,腹腔消毒,还纳子宫及腹腔脏器并关腹。
1.3 取材 体积分数为0.10的水合氯醛3 mg·kg-1行腹腔麻醉后,将孕鼠仰卧位固定在操作台上,消毒,铺单,按原切口逐层剪开皮肤、肌层,暴露妊娠子宫,并观察双侧子宫角及其内胎鼠的大体形态,胎盘有无淤血。其中胎盘附着有力、脐血管内血流清晰者为再灌注良好、造模成功的胎鼠。将胎鼠剖宫取出,剪断脐带、清理分泌物后断头取脑,并观察全脑大体形态。在冰袋上分离出从视交叉向尾侧厚约3 mm的冠状脑组织块,迅速投入体积分数为0.40的多聚甲醛溶液中固定,其余部分在液氮中快速冷冻后,置于-80℃冰箱保存,以备脑组织MDA的检测。每只孕鼠取2个胎鼠脑标本,共36个样本。
1.4 胎鼠宫内窘迫情况的评估 剖宫产时观察羊水质量,胎鼠皮肤颜色,脐带断离后自主呼吸,四肢活动及胎鼠脑膜血管的情况,同时观察有无脑出血、脑水肿的发生。以上观察指标正常时得1分,不正常时得0分,满分为7分。
1.5 胎鼠脑组织病理学评估 组织块固定后,经脱水、透明、浸蜡、包埋等一系列步骤制成石蜡组织块。石蜡块上机沿包埋面进行切片。先以20 μm粗切,找到双侧海马最大平面后,改用5 μm进行细切。用镊子小心夹取切片放入展片仪中展开,展片完全后用多聚赖氨酸载玻片捞片、晾干后苏木精伊红染色(HE)。再经脱色,透明,封片后在光镜下观察,行神经病理学评估。每张切片取5个海马CA1区的高倍镜视野,统计各视野中每100个神经元中损伤的神经元数目,并将5个视野中损伤的神经元总和除以500,计算神经元损伤指数(LI)。
1.6 硫代巴比妥酸法测定脑组织MDA 将脑组织从-80℃冰箱中取出,用滤纸吸干表面的水分,在电子天平上精确称重。加入10倍体积的冰生理盐水,玻璃匀浆机充分研磨后,在高速低温离心机上4 000 r·min-1离心15 min,每个样本取匀浆上清液0.1 ml,按MDA试剂盒说明书进行加样操作。加样完毕后混匀,封闭离心管口并用针刺一小孔,置于沸水浴中45 min,取出后冷却,4 000 r·min-1离心10 min取上清液备用。取离心后的上清液200 μL,加入至96孔板中,设置酶标仪的测定波长为532 nm,上机检测各管的吸光值,并按照下面的公式计算脑组织中MDA含量:MDA=(测定管-空白管)/(标准管-空白管)×标准品浓度/待测样本蛋白浓度

2 结果
2.1 胎鼠宫内窘迫模型制备成功 通过病理切片可以观察到IR组海马CA1区大量死亡的神经元(染色质凝集或边集、核固缩深染),表明本实验中所建立的胎鼠宫内窘迫模型是成功的。
2.2 剖宫产后各组胎鼠宫内窘迫情况的评估 S组:剖宫产时羊水清亮,量中等。胎鼠皮肤颜色红润,脐带断离后可进行自主呼吸,四肢活动良好。胎鼠脑膜血管清晰,无血管扩张及脑出血、脑水肿。
IR组:剖宫产时可见羊水量少浑浊,黄绿色粪染。胎鼠皮肤苍白或发绀,无自主呼吸,对外界刺激无反应。脑膜血管明显扩张充血,脑水肿发生率高于0.80,个别胎鼠脑伴有脑出血现象。
P组:与IR组相比,各治疗组的胎鼠脑损伤均有不同程度的改善。羊水相对清亮,粪染较少。胎鼠皮肤颜色粉红,在人工刺激下可进行呼吸,外界刺激可有四肢活动。脑膜血管扩张充血明显改善,脑组织水肿明显减轻,无脑出血发生。
B组:胎鼠脑损伤较治疗组严重,与IR组损伤程度相似。
各组胎鼠宫内窘迫情况的评分见Fig 1。
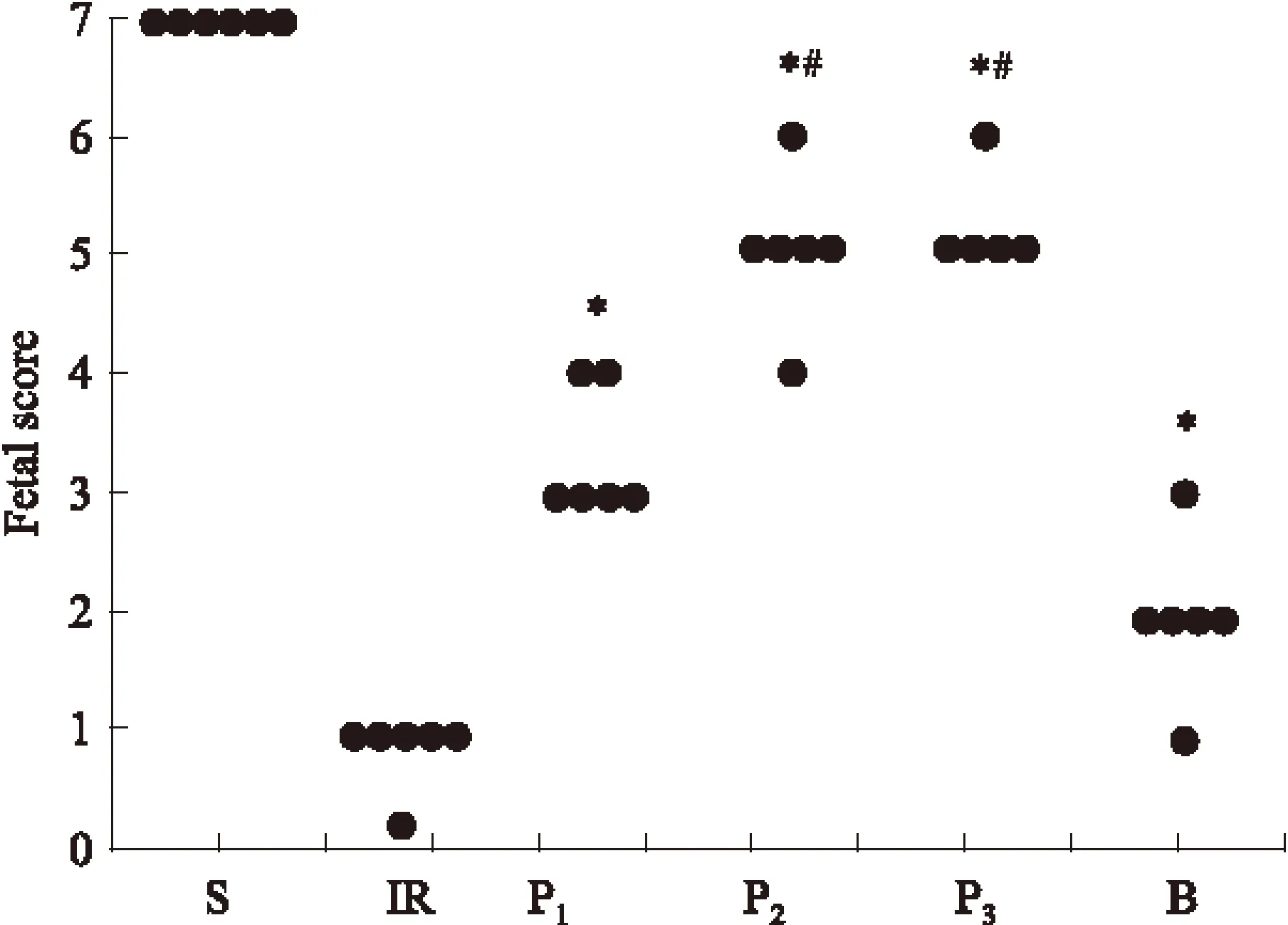
Fig 1 Score of new born fetal rats
One dot in the figure expressing one fetal rat. The following index was observed to estimate the fetal rat, including amniotic fluid, skin, respiration, activity, menigeal vessel, cerebral hemorrhage and cerebral edema. One index normal 1 score and one index un-normal 0 score.*P<0.05vsgroup IR;#P<0.05vsgroup P1
2.3 胎鼠脑病理切片的结果 S组:海马锥体神经元较成鼠密度大,约为8~12层,排列整齐,细胞核饱满,核仁清晰,核染色质均匀。神经元体积大、细胞质染色均一。
IR组:海马神经元排列紊乱,神经元肿胀或皱缩。核染色质凝集成块状或边集成新月形,核仁消失,细胞核固缩,基质模糊不清。
P组:从P1~P3组,可见光镜下海马区神经元与IR组相比损伤明显减轻:锥体神经元排列相对整齐,神经元胞体较大,仅个别细胞发生了核固缩深染或染色质凝集。
B组:光镜下海马神经元损伤程度比IR组略轻,但明显较各治疗组严重。
2.4 LI的统计结果 与S组(7.2±0.9)相比,IR组海马CA1区神经元发生明显的缺血/再灌注损伤,LI明显升高(71.9±2.8,P<0.01)。与IR组相比,异丙酚各治疗组海马CA1区神经元的LI明显降低(40.8±2.6,21.4±1.4,20.1±1.3,P<0.05)。P2、P3组与P1组相比海马CA1区神经元损伤指数明显降低(P<0.05),但P2、P3组之间差异无显著性(P>0.05)。与IR组相比,B组LI有明显降低(51.2±2.3,P<0.05),但明显高于各异丙酚治疗组(P<0.05)。各组胎鼠脑病理切片的结果见Fig 2,3。
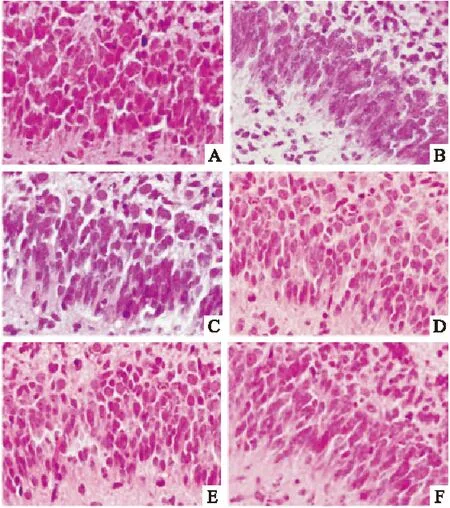
Fig 2 Profile of hippocampus CA1 of fetal rat(HE×400)
A:group S;B:group IR;C:group P1;D:group P2;E:group P3;F:group B
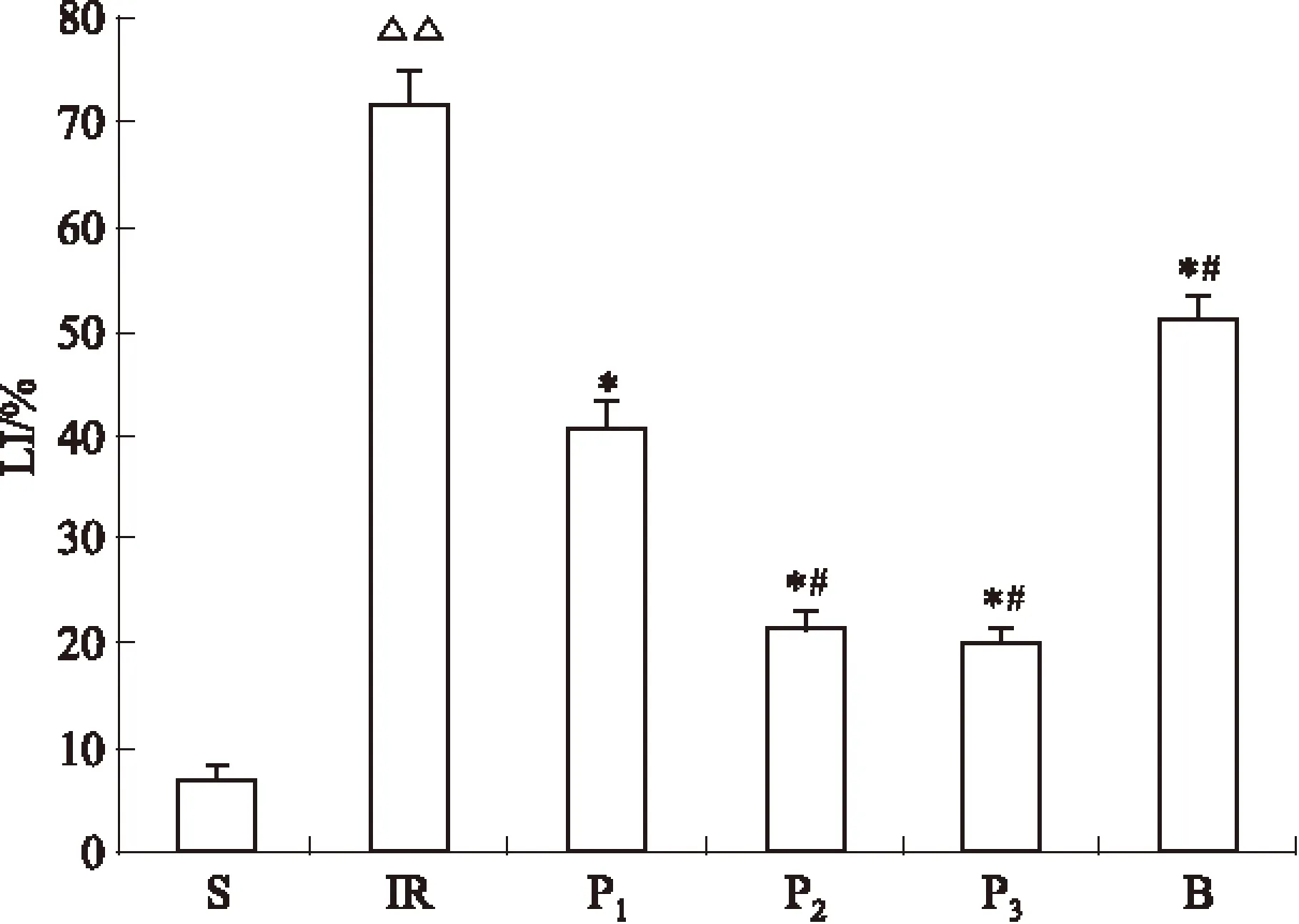
Fig 3 Neuronal Lesion-index of hippocampus CA1(LI)
*P<0.05vsgroup IR;#P<0.05vsgroup P1;△△P<0.01vsgroup S
2.5 异丙酚对宫内窘迫胎鼠脑组织MDA含量的影响 S组胎鼠脑组织的MDA为(3.86±0.20) μmol·g-1。IR组MDA的含量为(9.10±0.45) μmol·g-1,与S组相比明显升高,P<0.01。异丙酚各治疗组MDA的含量分别为(7.32±0.41)、(5.65±0.27)、(5.44±0.28) μmol·g-1,与IR组相比明显降低,P<0.05。其中P2、P3组与P1组相比,明显降低(P<0.05),P2、P3组间差异无显著性(P>0.05)。B组胎鼠脑组织MDA的含量为(7.54±0.31) μmol·mg-1,与缺血/再灌注组相比明显降低,P<0.05。各组宫内窘迫胎鼠脑组织MDA含量的结果见Fig 4。
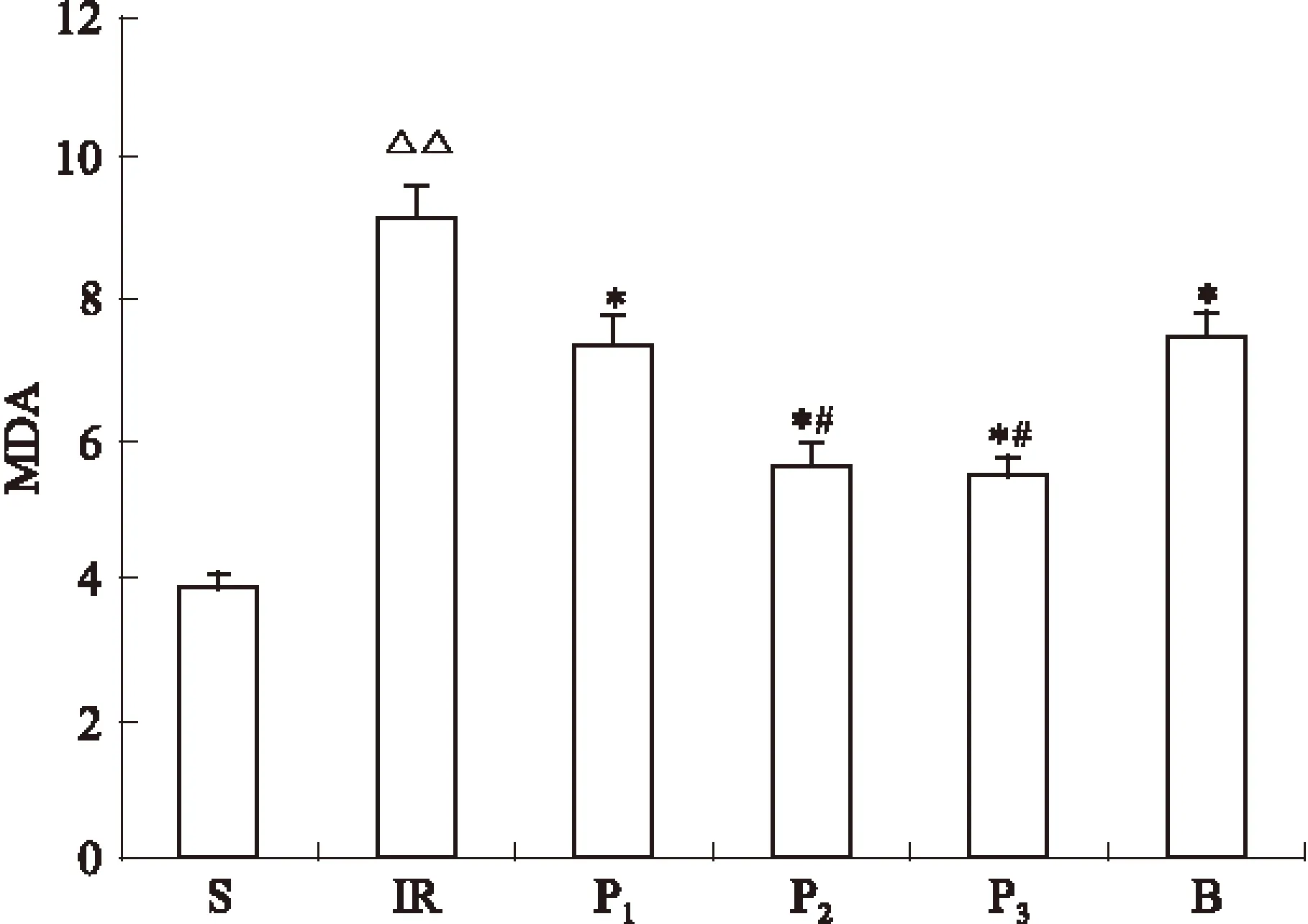
Fig 4 MDA content of fetal rat brain
*P<0.05vsgroup IR;#P<0.05vsgroup P1;△△P<0.01vsgroup S
3 讨论
胎儿宫内窘迫是临床上常见的一类产科疾患,造成新生儿神经系统损伤及后遗症。许多研究已证实,异丙酚对缺血/再灌注损伤的脑组织具有保护作用[3-5],但其对宫内窘迫胎儿是否具有神经保护作用仍待研究。
病理切片的结果表明,缺血前孕鼠静脉注射异丙酚对宫内窘迫的胎鼠具有神经保护作用。与缺血组相比,异丙酚各组中胎鼠海马CA1区锥体神经元的损伤明显减轻。随着异丙酚的剂量由10 mg·kg-1增加至30 mg·kg-1,其神经保护作用也增高了。但当异丙酚的剂量由30 mg·kg-1进一步增加到50 mg·kg-1时,其神经保护作用并没有进一步增加。这证明异丙酚对胎鼠的神经保护作用不仅具有剂量依赖性,还具有剂量封顶效应。
有研究表明异丙酚的作用位点是GABAA受体[6-7],而荷包牡丹碱是GABAA受体的拮抗剂。本研究对孕鼠静脉注射异丙酚的同时,腹腔注射荷包牡丹碱可部分逆转异丙酚对胎鼠的神经保护作用。这证明异丙酚对胎鼠的神经保护作用部分是通过激动GABAA受体实现的。
与成年鼠相比,胎鼠脑内不饱和脂肪酸的含量更高,而胎鼠的氧耗率高,氧自由基清除系统不完善,这使其更易受到缺血缺氧后脂质过氧化的攻击[8-9]。MDA是脂质过氧化物的降解产物,其含量直接反映了脑脂质过氧化的损伤程度。本研究发现与假手术组相比,缺血/再灌注组胎鼠脑组织MDA含量明显升高。与缺血/再灌注组相比,各异丙酚治疗组中胎鼠脑MDA含量均有不同程度的降低。与P1相比,P2、P3组胎鼠脑内MAD含量进一步降低,而P2、P3组之间MDA含量差异无显著性。这表明麻醉剂量的异丙酚就能够抑制宫内窘迫胎鼠脑组织的脂质过氧化程度,更大剂量的异丙酚并未显示出更强的抑制效应。这可能是由于异丙酚的苯环上连接有一个酚羟基,具有较强的还原性,类似于天然抗氧化剂α-tocopherol(vitamin E)的作用,因而异丙酚能降低脑缺血/再灌注后的脂质过氧化反应,吞噬自由基,维护细胞膜、线粒体及生物大分子结构的稳定性,从而起到脑保护的作用[10-14]。
与缺血/再灌注组相比,B组胎鼠脑MDA含量明显降低。这表明异丙酚的抑制脂质过氧化的作用可能与GABAA受体无关。
4 结论
异丙酚能明显减少宫内窘迫胎鼠海马区神经元损伤,并降低脑内MDA的含量,对宫内窘迫胎鼠具有神经保护作用,大剂量的异丙酚并未显示出更强的保护作用。
GABAA受体拮抗剂荷包牡丹碱能部分地逆转异丙酚的神经保护作用。表明异丙酚的神经保护作用部分是通过激动GABAA受体实现的。
(致谢:本实验于河北医科大学基础医学院病理生理实验室完成,在此深表感谢。)
[1] Van Schie P E, Schijns J, Becher J G, et al. Long-term motor and behavioral outcome after perinatal hypoxic-ischemic encephalopathy[J].EurJPaediatrNeurol, 2015, 19(3): 354-9.
[2] Pappas A, Shankaran S, McDonald S A, et al. Cognitive outcomes after neonatal encephalopathy[J].Pediatrics, 2015, 135(3): 624-34.
[3] Fan W, Zhu X, Wu L, et al. Propofol: an anesthetic possessing neuroprotective effects[J].EurRevMedPharmacolSci, 2015, 19(8): 1520-9.
[4] 刘红亮,戴体俊. P2X7受体介导异丙酚对缺氧海马突触前膜谷氨酸Ca2+依赖性释放的抑制作用[J].中国药理学通报,2010,26(09): 1169-73.
[4] Liu H L,Dai T J.Role of P2X7receptor in the inhibitory effect of propofol on glutamate Ca2+-dependent release from hypoxic hippocampal synaptosomes[J].ChinPharmacolBull, 2010, 26(09):1169-73.
[5] Gong H Y, Zheng F, Zhang C, et al. Propofol protects hippocampal neurons from apoptosis in ischemic brain injury by increasing GLT-1 expression and inhibiting the activation of NMDAR via the JNK/Akt signaling pathway[J].IntJMolMed, 2016, 38(3): 943-50.
[6] Woll K A, Murlidaran S, Pinch B J, et al. A aovel bifunctional alkylphenol anesthetic allows characterization of γ-aminobutyric acid, type A(GABAA), receptor subunit binding selectivity in synaptosomes[J].JBiolChem, 2016, 291(39): 20473-86.
[7] Eaton M M, Germann A L, Arora R, et al. Multiple non-equivalent interfaces mediate direct activation of GABAAreceptors by propofol[J].CurrNeuropharmacol, 2016, 14(7): 772-80.
[8] Pimentel V C, Bellé L P, Pinheiro F V, et al. Adenosine deaminase activity, lipid peroxidation and astrocyte responses in the cerebral cortex of rats after neonatal hypoxia ischemia[J].IntJDevNeurosci, 2009, 27(8): 857-62.
[9] Menku A(1), Ogden M, Saraymen R. The protective effects of propofol and citicoline combination in experimental head injury in rats[J].TurkNeurosurg, 2010, 20(1): 57-62.
[10]Wei X, Wan X, Zhao B, et al. Propofol inhibits inflammation and lipid peroxidation following cerebral ischemia/reperfusion in rabbits[J].NeuralRegenRes, 2012, 7(11): 837-41.
[11]Romuk E, Szczurek W, Nowak P, et al. Influence of propofol on oxidative antioxidative system parameters in peripheral organs of rats with Parkinson disease[J].BrJAnaesth, 2006, 97(6): 825-31.
[12]Hsiao H T, Wu H, Huang P C, et al. The effect of propofol and sevoflurane on antioxidants and proinflammatory cytokines in a porcine ischemia-reperfusion model[J].NeurosurgAnesthesiol, 2005, 17(3): 144-8.
[13]Shokrzadeh M, Zamani E, Mehrzad M, et al. Protective effects of propofol against methamphetamine-induced neurotoxicity[J].ToxicolInt, 2015, 22(1): 92-9.
[14]Celik M G, Saracoglu A, Saracoglu T, et al. Effects of propofol and midazolam on the inflammation of lungs after intravenous endotoxin administration in rats[J].CanJAnaesth, 2000, 47(10): 1025-30.
Neuroprotective effect of propofol on fetal rat brain in intrauterine ischemia/reperfusion injury
CAI Jin-song, FENG Shuai, QI Xiang, LIANG Zhi, XU Xue
(DeptofAnesthesiology,theSecondHospital,HebeiMedicalCollege,Shijiazhuang050000,China)
Aim To observe the neuroprotective effect of different doses of propofol on ischemic fetal rat brain.Methods Eighteen healthy pregnant SD rats were randomly allocated into the following six groups with three rats in each. Group S: sham operation group, Group IR: ischemia/reperfusion group, Group P1~P3: different doses of propofol groups, Group B: bicuculline group. In group S and group IR, 1 ml saline solution was administered via caudal vein. In group P1~P3, 10, 30, 50 mg·kg-1of propofol was administered via caudal vein respectively. In group B, when 50 mg·kg-1propfol was administered via caudal vein, 5 mg·kg-1bicuculline was injected intraperitoneally at the same time. Bilateral uterine ovarian arteries were clamped for 11 mins to make intrauterine distress model of the fetal rats. The brains of fetal rats were removed after 3 days of reperfusion.Brain sections(5 μm thick) were mounted and stained with Hematoxylin and eosin(HE). The profile of the hippocampus CA1 was evaluated under a light microscope and neuronal Lesion-index(LI) was calculated. MDA content of fetal rat brain was detected by thiobarbituric acid reaction method to determine the lipid peroxidation degree of brain.Results LI was (7.2±0.9) and MDA was (3.86±0.20) μmol·g-1in group S. LI was 71.9±2.8 and the content of MDA was (9.10±0.45) μmol·g-1in group IR, which increased significantly compared with those in group S(P<0.01). LI was (40.8±2.6), (21.4±1.4), (20.1±1.3) and the content of MDA was (7.32±0.41), (5.65±0.27), (5.44±0.28) μmol·g-1in propofol groups, which decreased significantly compared with those in group IR(P<0.05). LI and the content of MDA was (51.2±2.3), (7.54±0.31) μmol·g-1in group B,respectively, reversing partly the neuroprotevtive effect of propofl.Conclusion Propofol could protect the neurons in hippocampus CA1 region of fetal rat against intrauterine distress by reducing the concentration of MDA in the brain.
propofol;fetal rat intrauterine distress;ischemia/reperfusion injury;Lesion-index of neuron;MDA;bicuculline
时间:2017-5-25 17:44 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170525.1744.048.html
2017-01-05,
2017-02-17
河北省科技厅计划项目(No 132777129)
蔡劲松:(1966-),男,博士,主任医师,研究方向:神经保护,通讯作者,E-mail:caijs20081225@126.com
10.3969/j.issn.1001-1978.2017.06.024
A
1001-1978(2017)06-0869-05
R-332;R322.81;R364.4;R714.5;R742.89;R971.2摘要:目的 观察异丙酚对宫内窘迫胎鼠的神经保护作用。方法 SD大鼠♀18只,交配后获得孕鼠。将孕鼠随机分为6组(n=3):假手术组(S组)、缺血/再灌注组(IR组)、异丙酚低、中、高剂量组(P1~P3组)和荷包牡丹碱组(B组)。S组和IR组孕鼠经尾静脉注射生理盐水1 mL。P1~P3组孕鼠经尾静脉分别注射异丙酚10、30、50 mg·kg-1。B组在注射异丙酚50 mg·kg-1的同时,腹腔注射荷包牡丹碱5 mg·kg-1。夹闭子宫卵巢动脉11 min。再灌注3 d后取材,每只孕鼠各取2只胎鼠,每组6只。制作切片,计算海马CA1区神经元损伤指数(LI)。硫代巴比妥酸反应法检测胎鼠脑组织丙二醛(MDA)含量。结果 S组LI为7.2±0.9,MDA为(3.86±0.20) μmol·g-1,与之相比,IR组的LI为71.9±2.8,MDA为(9.10±0.45) μmol·g-1(P<0.01)。与IR相比,异丙酚各组的LI分别为40.8±2.6,21.4±1.4,20.1±1.3,MDA分别为(7.32±0.41),(5.65±0.27),(5.44±0.28) μmol·g-1(P<0.05)。B组的LI,MDA分别为(51.2±2.3),(7.54±0.31) μmol·g-1,翻转了异丙酚的保护作用。结论 异丙酚对宫内窘迫胎鼠具有神经保护作用。