自噬降低异常磷酸化tau蛋白所致的神经细胞毒性
丁 倩,张 瑾,马钰泱,沈玉君,沈玉先,冯利杰
(安徽医科大学1.基础医学院,2.药学院,3.生物药物研究所,安徽 合肥 230001)
◇论 著◇
自噬降低异常磷酸化tau蛋白所致的神经细胞毒性
丁 倩1,3,张 瑾2,3,马钰泱1,3,沈玉君1,3,沈玉先1,3,冯利杰1,3
(安徽医科大学1.基础医学院,2.药学院,3.生物药物研究所,安徽 合肥 230001)
目的 观察雷帕霉素和饥饿诱导的自噬对表达异常磷酸化tau蛋白的神经细胞形态、tau蛋白聚集和磷酸化tau降解的影响,探讨这两种经典的诱导自噬方式抑制磷酸化tau的细胞毒性,发挥细胞保护作用的可能机制。方法 体外培养小鼠神经瘤母细胞株N2a并转染tau真核表达质粒,蛋白磷酸酯酶抑制剂冈田酸(okadaic acid, OA)诱导tau蛋白异常磷酸化,雷帕霉素(rapamycin, Rapa)或Earle′s平衡盐溶液(Earle′s balanced salts, EBSS)诱导细胞自噬,巴佛洛霉素A1(Bafilomycin A1, Baf A1)抑制自噬,DAB染色观察表达tau细胞的形态变化;激光共聚焦显微镜观察细胞内tau聚集体;TUNEL染色和caspase-3活性检测细胞凋亡;免疫印迹(immunoblot,IB)检测磷酸化tau和细胞自噬水平。结果 过表达tau的细胞胞体变圆,突起减少;OA处理后细胞突起进一步减少甚至消失,胞质出现明显tau聚集体,凋亡细胞增加,剪切型caspase-3水平上调;Rapa和EBSS处理后的细胞形态均有一定程度改善,tau聚集体明显减少,细胞凋亡减少,剪切型caspase-3表达降低;而自噬抑制剂Baf A1处理的细胞变圆,皱缩,胞质大量tau聚集体,凋亡细胞明显增加。IB结果显示Rapa明显降低高分子量的磷酸化tau,而EBSS能明显减少低分子量磷酸化tau的水平。结论 Rapa和EBSS诱导的细胞自噬均能抑制磷酸化tau蛋白的细胞毒作用,但其发挥细胞保护作用的机制不同,Rapa诱导自噬倾向于降解磷酸化tau的寡聚体,而EBSS更易于降解低分子量的磷酸化tau蛋白。
tau;磷酸化;雷帕霉素;自噬;蛋白降解;细胞毒性
Tau蛋白是一种广泛存在于神经元内的微管相关蛋白(microtubule-associated proteins, MAPs)。正常脑中的tau蛋白能与微管蛋白单体结合并促进其聚合形成微管,对维持神经元正常形态结构,轴浆运输和突触传递起着重要作用[1]。Tau蛋白为含磷蛋白质,正常成熟脑中tau蛋白分子含2~3个磷酸基。在病理条件下,如阿尔茨海默病(Alzheimer’s disease,AD)患者脑内tau蛋白过度磷酸化,每分子tau蛋白可含5~9个磷酸基。Tau蛋白异常磷酸化后构象发生改变,丧失促进微管组装和维持微管稳定的功能,并自身聚集成成对螺旋丝(paired helical filaments, PHFs),PHFs进一步聚集沉积形成神经元纤维缠结(neurofibrillary tangles, NFTs),最终导致神经元功能紊乱和神经退行性病变[2]。 因此,减少神经细胞内异常磷酸化tau的聚集可能是降低tau细胞毒性和保护神经元的有效策略之一。
自噬是广泛存在于真核细胞内的一种高度保守的降解途径。在此过程中,胞内损伤的或被标记的蛋白质和细胞器被自噬体膜包裹后形成自噬体,接着自噬体与溶酶体膜融合并释放底物到溶酶体中,最终在一系列水解酶的作用下将其降解[3]。近来研究发现在AD病人脑神经元内自噬体明显增加[4];自噬关键基因Atg5/Atg7 敲除的大鼠出现典型的神经元退化[5-6]。体外实验证实自噬抑制能减少tau 降解,促进tau聚集体形成[7-8];以上实验均证实自噬参与了异常磷酸化tau的降解。目前关于tau自噬降解的研究中,Earle′s平衡盐溶液(Earle′s balanced salts, EBSS)和雷帕霉素(rapamycin,Rapa)是最常用的细胞自噬诱导剂,那么这两种方式诱导的自噬对磷酸化tau细胞毒作用的影响是否一致,目前仍不清楚。因此,我们建立表达异常磷酸化tau的细胞模型,分别采用EBSS和Rapa诱导细胞自噬,观察这两种方式诱导的自噬对磷酸化tau蛋白降解的影响以及对神经细胞的保护作用。
1 材料与方法
1.1 质粒、试剂和抗体 pEGFP-C1-tau真核表达质粒由本实验室构建[9]。自噬诱导剂Rapa购自Santa Cruz公司,自噬抑制剂巴佛洛霉素A1 (Bafilomycin A1, Baf A1)、蛋白磷酸酯酶抑制剂冈田酸(okadaic acid, OA)购自Sigma公司。DMEM 高糖培养基、Opti-MEM培养基和EBSS购自Gibco公司,小牛血清(fetal bovine serum, FBS)购自康源生物技术有限公司,lipofectamine 2000购自Invitrogen公司,PVDF膜购自Millipore公司,ECL化学发光底物检测试剂盒购自Pierce公司,TUNEL凋亡检测试剂盒购于Roche公司,DAB 显色试剂盒购自中杉金桥公司。tau-5单克隆抗体购于Biosourse公司,AT-8单克隆抗体购自Pierce公司,p62、LC3和α-tubulin多克隆抗体购自Sigma公司。剪切型caspase-3抗体购自Cell Signaling公司。
1.2 方法
1.2.1 细胞培养和质粒转染 小鼠神经瘤母细胞株N2a用含10%胎牛血清,100 mg·L-1链霉素和105U·L-1青霉素的DMEM培养液置37 ℃ 5% CO2培养箱中进行贴壁培养。取对数生长期的细胞用浓度为0.25%胰酶消化后,调整细胞密度为3~5×105个/孔,重新接种于6孔板中。细胞密度长至70%~80%汇合后,采用脂质体Lipofectamine 2000按说明书进行转染,转染后继续培养6 h更换培养液。
1.2.2 DAB 染色 N2a细胞接种于24孔板,转染tau表达质粒24 h后加OA(10 nmol·L-1)处理12 h诱导tau过度磷酸化,Rapa(10 mg·L-1)、EBSS和Baf A1(100 nmol·L-1)分别处理6 h后去除培养液,4%多聚甲醛4 ℃固定20 min,PBS洗5 min×3次。0.1% Triton X-100室温孵育15 min, PBS洗5 min×3次后再用3%的H2O2于37 ℃处理15 min。5% BSA常温封闭30 min。加入一抗37 ℃孵育2 h,PBS洗5 min×3次。依次加入SP试剂盒中的B液(生物素标记二抗)和C液(辣根过氧化物酶标记液),DAB显色,镜下观察判断,洗1~2次终止反应。用80%甘油封片,镜下观察拍照。
1.2.3 共聚焦显微镜观察tau聚集体形成 N2a细胞同上转染、加药处理,DAPI(5 mg·L-1) 孵育10 min衬染核,PBS洗5 min×3次,激光共聚焦显微镜下观察tau聚集体。
1.2.4 TUNEL染色 N2a细胞接种于24孔板后转染带His标签的tau质粒,加药处理后,去除培养液,4%多聚甲醛4 ℃固定25 min,PBS洗 5 min×3次,再用PBS稀释的0.1% Triton X-100室温孵育15 min,PBS洗5 min×3次。加入TUNEL孵育缓冲液37 ℃避光孵育1 h,PBS洗5 min×3次,DAPI孵育10 min衬染核,PBS洗5 min×3次,荧光显微镜采集图片。分别计数5张切片上5个不同视野中TUNEL阳性细胞和DAPI阳性细胞数的比例来判断细胞凋亡情况。
1.2.5 蛋白质免疫印迹 N2a细胞同上转染,加药处理后,弃去培养液,PBS清洗细胞后用含蛋白酶抑制剂的蛋白裂解液冰上裂解细胞30 min,100 ℃变性10 min。SDS-PAGE胶电泳后湿转至PVDF膜。用含5%脱脂奶粉和0.05%吐温20的PBS(PBST)封闭1 h后,加入适当稀释度的一抗室温孵育2 h,PBST洗10 min×3次,再加入适当稀释度的二抗,室温孵育1 h,PBST洗10 min×3次,ECL显影。Image J软件进行半定量分析。
2 结果
2.1 Rapa和EBSS诱导的自噬对表达异常磷酸化tau细胞形态的影响 为观察两种方式诱导的自噬对表达磷酸化tau细胞形态的影响,我们将GFP-tau质粒转染N2a细胞,OA(10 nmol·L-1)处理细胞12 h诱导tau异常磷酸化,分别用Rapa(10 mg·L-1)、EBSS和Baf A1(100 nmol·L-1)处理细胞6 h,IB检测p62和LC3表达水平,DAB法检测细胞形态和tau表达情况。IB结果显示,EBSS和Rapa能增加LC3Ⅱ/LC3Ⅰ比例,降低p62水平,有效增加细胞自噬水平;而Baf A1明显抑制LC3Ⅱ和p62的降解,抑制自噬(Fig 1B)。DAB结果显示,少量表达tau的细胞形态基本正常(Fig 1A1),而OA处理的细胞胞体变圆,突起减少甚至消失,胞质内tau表达增加(Fig 1A2);Rapa处理组细胞形态有所改善,胞体基本正常,有少量突起,tau表达量明显减少(Fig 1A3);EBSS处理后细胞形态基本恢复正常,胞体饱满,突起较多,tau表达量减少(Fig 1A4);而自噬抑制剂Baf A1处理后细胞胞体变小,皱缩,突起消失,胞质出现大量 tau聚集体(Fig 1A5)。同时我们对不同处理组的细胞进行细胞计数,结果发现,与单独OA处理组相比,Rapa和EBSS处理对细胞数目没有明显影响,而Baf A1组细胞数量明显减少(Fig 1C)。以上结果提示EBSS和Rapa均能改善表达磷酸化tau细胞的形态。
2.2 Rapa和EBSS诱导的自噬对细胞内tau聚集体的影响 为了进一步观察Rapa和EBSS对细胞内tau聚集体的影响,我们同上转染并处理细胞后,激光共聚焦显微镜观察细胞内tau聚集情况。结果显示,过表达tau细胞胞质中tau蛋白多以弥散形式存在,可见少量tau聚集;而OA处理细胞胞质中出现明显tau聚集体;Rapa和EBSS能在一定程度上减少tau聚集,尤其是Rapa处理组细胞tau聚集明显减少,tau多弥散分布在胞质中;反之,Baf A1明显增加tau聚集体(Fig 2)。提示Rapa和EBSS诱导的自噬能明显减少神经细胞中磷酸化tau聚集,其中Rapa作用更加明显。
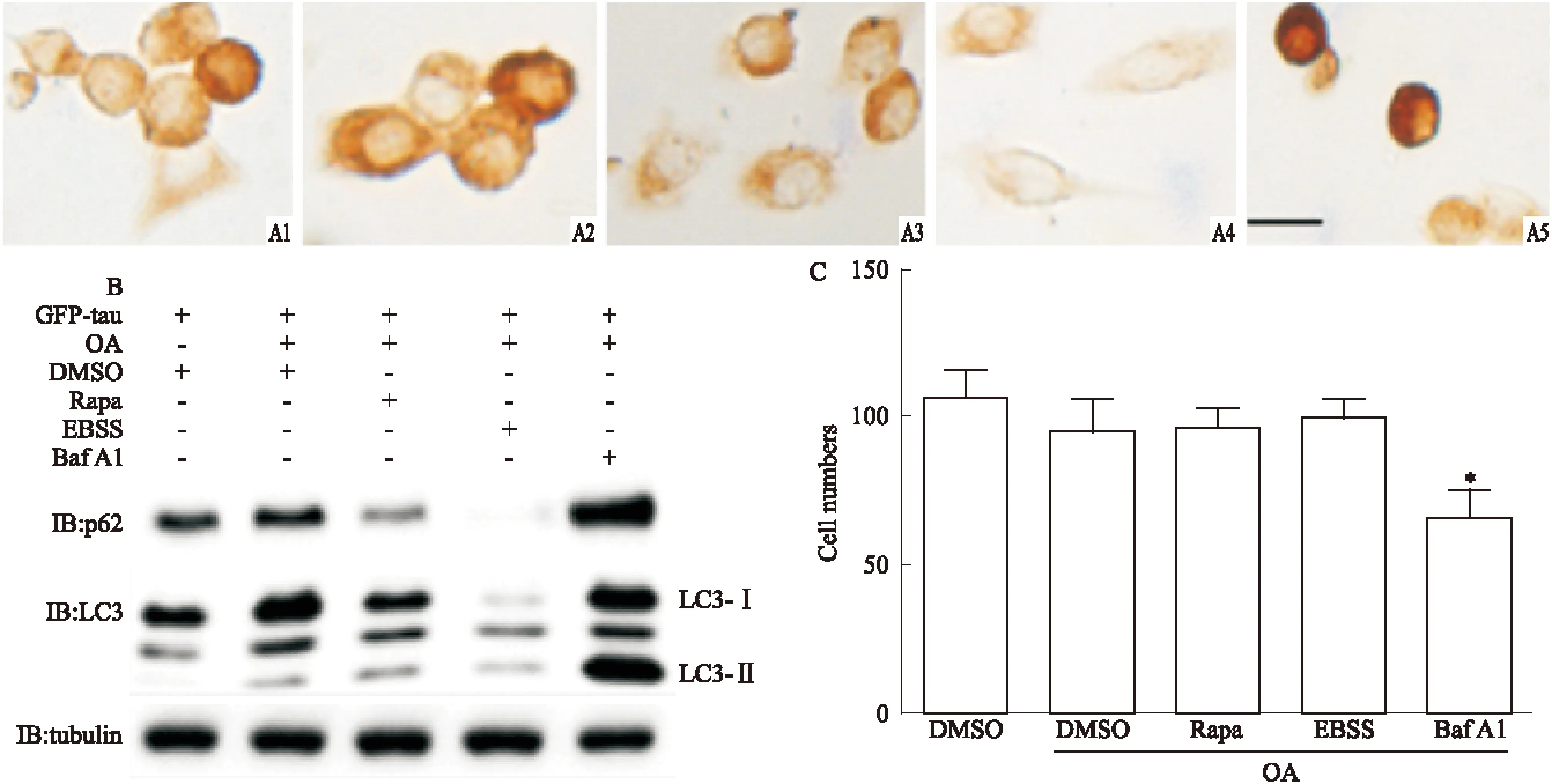
Fig 1 Effect of rapamycin (Rapa) and EBSS on cell morphology in hyperphosphorylated tau expressing cells


Fig 2 Effect of Rapa and EBSS on tau aggregation formation
N2a cells transfected with GFP-tau were incubated with or without OA for 12 h and then treated with DMSO, Rapa, EBSS, or Baf A1 for 6 h, tau aggregation was observed under confocal microscopy. Scale bar=20 μm
2.3 Rapa和EBSS诱导的自噬对表达磷酸化tau细胞凋亡的影响 为了观察EBSS和Rapa对表达磷酸化tau细胞凋亡的影响,我们同上转染并处理细胞,采用TUNEL染色观察细胞凋亡。结果发现,转染tau细胞中有少量TUNEL阳性细胞,OA处理后TUNEL阳性的凋亡细胞数增加;与单独OA处理组相比,EBSS或Rapa明显减少凋亡细胞数,而Baf A1抑制自噬后细胞凋亡明显增加(Fig 3 A~B)。IB结果同样显示,与DMSO处理组相比,OA单独处理的细胞中cleaved caspase-3水平增加,EBSS或Rapa处理能明显降低cleaved caspase-3水平;反之,Baf A1能上调cleaved caspase-3表达(Fig 3C),提示Rapa和EBSS诱导的自噬能明显抑制磷酸化tau诱导的细胞凋亡。
2.4 Rapa和EBSS诱导的自噬对磷酸化tau水平的影响 为了进一步观察Rapa和EBSS诱导的自噬对磷酸化tau水平的影响,我们同上处理细胞,采用AT-8抗体检测Ser202/Thr205位点磷酸化的tau。同Fig 1B,EBSS和Rapa增加LC3Ⅱ/LC3Ⅰ比例,降低p62水平,有效增加细胞自噬水平。结果发现,Rapa处理组中高分子量磷酸化tau明显减少,而低分子量磷酸化tau水平相对增加;EBSS处理的细胞中低分子量磷酸化tau蛋白明显减少,而高分子量磷酸化tau水平变化不明显(Fig 4)。提示Rapa诱导的自噬主要降解高分子量磷酸化tau寡聚体,而EBSS主要促进低分子量的磷酸化tau降解。
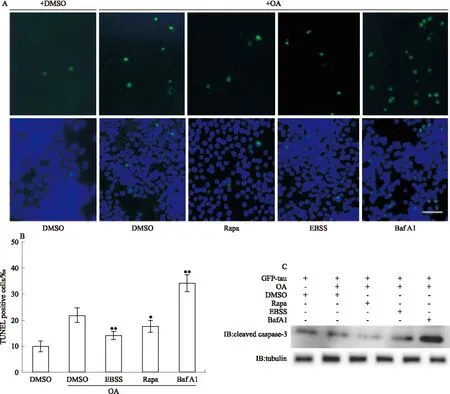
Fig 3 Rapa and EBSS significantly reduced neuronal apoptosis in hyperphosphorylated tau expressing cells

3 讨论
我们前期研究发现自噬参与过表达tau和异常磷酸化tau的降解,而对内源性tau水平无明显影响[10],提示自噬主要参与病理状态下tau蛋白降解。本研究中我们采用神经细胞株N2a瞬时转染GFP-tau质粒,并用选择性蛋白磷酸酯酶PP1和PP2A 抑制剂OA来诱导tau蛋白异常磷酸化,模拟AD病人脑中PP2A活性下降导致tau异常磷酸化的病理状态[11]。结果发现,EBSS和Rapa诱导的自噬均能改善异常磷酸化tau导致的细胞形态异常,减少细胞凋亡,提示EBSS和Rapa诱导的自噬对表达异常磷酸化tau的细胞均有保护作用。进一步观察发现,与EBSS相比,Rapa处理的细胞中tau聚集体减少更加明显;IB结果证实Rapa能明显降低高分子量的磷酸化tau,即tau寡聚体水平,而EBSS对低分子量磷酸化tau降解作用比较明显;提示这两种自噬诱导方式可能参与了不同毒性形式tau蛋白的降解过程。
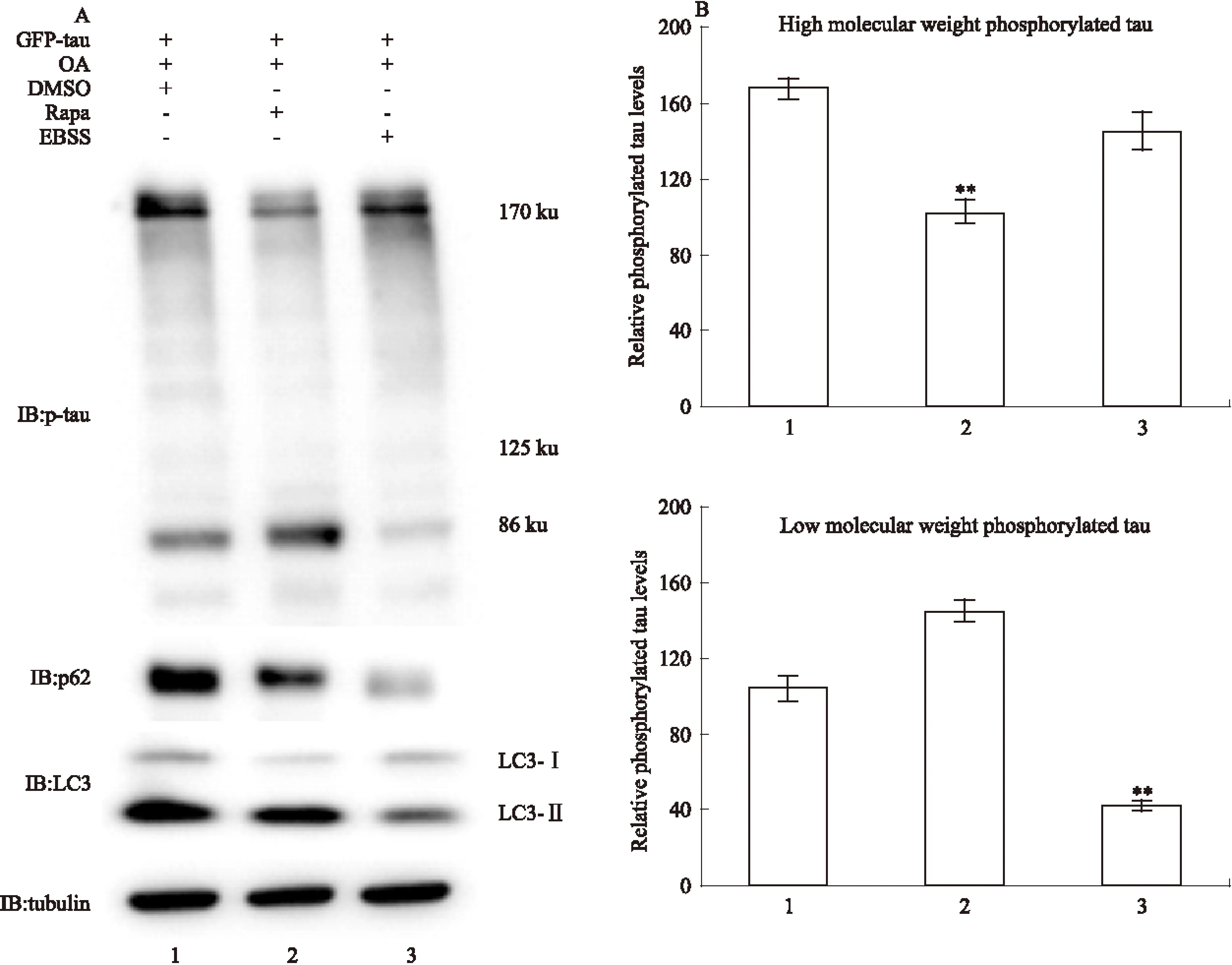
Fig 4 Effect of Rapa and EBSS on phosphorylated tau levels in N2a cells

目前关于异常磷酸化tau与神经元退化之间关系的研究很多,但对于tau的毒性形式还存在争议。过去研究普遍认为,NFTs与神经元退化有关。但目前研究发现,tau的不溶性聚集体的形成可能不是导致tau病理的原发机制,而可溶性的tau中间体在神经元变性中起着更重要的作用[12-13]。在本研究中,我们同样发现,EBSS主要降解低分子量磷酸化tau,Rapa更倾向降解高分子量的磷酸化tau寡聚体,但EBSS对磷酸化tau细胞毒性的抑制作用比Rapa更加明显。这也从另一个角度提示低分子量可溶性tau可能具有更强的细胞毒作用。
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamyin,mTOR)是雷帕霉素在哺乳动物细胞内的靶点。mTOR作为自噬启动阶段关键调节因子,抑制其活性可正向调节自噬的发生。细胞内的mTOR存在两种不同的复合体:对雷帕霉素敏感的mTORC1和对雷帕霉素不敏感的mTORC2。前者主要调节细胞生长、能量代谢和自噬,后者主要通过活化PKB/Akt激活自噬通路来调控细胞骨架和细胞存活[14-15]。近年国内外研究显示mTOR信号通路与AD密切相关。已有研究报道Rapa能作用于mTOR,抑制mTORC1,诱导自噬发生,促进神经细胞存活[16]。这也部分解释了Rapa降低异常磷酸化tau细胞毒性的作用机制。细胞对氨基酸的摄入水平主要通过RagA家族成员GTPases和Ste家族蛋白MAP4K3来影响mTORC1活性,在营养充足时抑制自噬;在营养匮乏时自噬得以激活[17]。因此在本研究中,EBSS模拟氨基酸饥饿能通过影响mTORC1活性上调自噬,促进磷酸化tau降解,从而发挥细胞保护作用。Rapa和EBSS虽然都能通过抑制mTOR通路诱导自噬,但具体机制上可能还存在着差异。Rapa除了能直接抑制mTORC1,激活自噬外,还可能通过激活mTORC2,抑制Akt磷酸化,而后者能促进tau异常磷酸化[18],因此Rapa除了增加tau聚集体降解外,还可能抑制tau过度磷酸化。这也部分解释了Rapa处理细胞中磷酸化tau寡聚体明显减少。 综上所述,Rapa和EBSS诱导的自噬均能不同程度的抑制异常磷酸化tau的细胞毒作用,减少细胞凋亡,促进磷酸化tau蛋白降解。但Rapa诱导的自噬明显减少磷酸化tau寡聚体,而饥饿诱导的自噬更倾向于降解低分子量的磷酸化tau,但这两种自噬诱导方式对不同形式tau蛋白的降解机制还有待于进一步研究。
(致谢:本文实验内容在安徽医科大学科教大楼生物药物研究所完成,感谢实验室同学老师的关心与帮助。)
[1] Weingarten M D, Lockwood A H, Hwo S Y, et al. A protein factor essential for microtubule assembly[J].ProcNatlAcadSciUSA, 1975, 72(5):1858-62.
[2] Cárdenas-Aguayo Mdel C, Gómez-Virgilio L, DeRosa S, et al. The role of tau oligomers in the onset of Alzheimer′s disease neuropathology[J].ACSChemNeurosci, 2014, 5(12): 1178-91.
[3] You L, Jin S, Zhu L, Qian W. Autophagy, autophagy-associated adaptive immune responses and its role in hematologic malignancies[J].Oncotarget, 2017,8(7):12374-88.
[4] Nixon R A, Wegiel J, Kumar A, et al. Extensive involvement of autophagy in Alzheimer disease: an immuno-electron microscopy study[J].JNeuropatholExpNeurol, 2005, 64(2): 113-22.
[5] Hara T, Nakamura K, Matsui M, et al. Suppression of basal autophagy in neural cells causes neurodegenerative disease in mice[J].Nature, 2006, 441(7095): 885-9.
[6] Komatsu M, Waguri S, Chiba T, et al. Loss of autophagy in the central nervous system causes neurodegeneration in mice[J].Nature, 2006, 441(7095): 880-4.
[7] Hamano T, Gendron T F, Causevic E, et al. Autophagic-lysosomal perturbation enhances tau aggregation in transfectants with induced wild-type tau expression[J].EurJNeurosci,2008,27(5):1119-30.
[8] Wang Y, Martinez-Vicente M, Kruger U, et al. Tau fragmentation, aggregation and clearance: the dual role of lysosomal processing[J].HumMolGenet,2009,18(21):4153-70.
[9] 冯利杰,李 琪,方 辉,等.非神经源性细胞中tau蛋白的稳定表达及磷酸化[J].安徽医科大学学报,2007,42(2):119-23.
[9] Feng L J, Li Q, Fang H, et al. Overexpression and hyperphosphorylation of tau protein in stably transfected 293T cells[J].ActaUnivMedAnhui, 2007, 42(2): 119-23.
[10]冯利杰,张 瑾,丁 倩,等. 自噬参与神经细胞中过表达tau 和异常磷酸化tau 蛋白的降解[J]. 中国药理学通报,2015,31(3):356-62.
[10]Feng L J, Zhang J, Ding Q, et al. Autophagy involved in overexpressed tau and okadaic acid-induced hyperphosphorylated tau degradation[J].ChinPharmacolBull, 2015, 31(3): 356-62.
[11]孙爱民, 王海萍,沈玉君,等. Ser202/Thr205位点磷酸化tau在神经元中的定位[J].中国药理学通报,2011,27(1):41-5.
[11]Sun A M, Wang H P, Shen Y J, et al. Differential induction of tau phosphorylation by OA treatment in primarily cultured neurons and SH-SY5Y cells[J].ChinPharmacolBull, 2011, 27(1): 41-5.
[12]Santacruz K, Lewis J, Spires T, et al. Tau suppression in a neurodegenerative mouse model improves memory function[J].Science, 2005, 309(5733):476-81.
[13]Kayed R, Jackson G R. Prefilament tau species as potential targets for immunotherapy for Alzheimer disease and related disorders[J].CurrOpinImmunol, 2009, 21(3):359-63.
[14]Kim L C, Cook R S, Chen J. mTORC1 and mTORC2 in cancer and the tumor microenvironment[J].Oncogene, 2016: 363.
[15]Dany M, Rimmani H H, Matar S A, et al. mTORC2-Akt signaling axis is implicated in myocardial compensation and fibrosis[J].JBiolRegulHomeostAgents,2015,29(4): 745-53.
[16]Goldshmit Y, Kanner S, Zacs M, et al. Rapamycin increases neuronal survival, reduces inflammation and astrocyte proliferation after spinal cord injury[J].MolCellNeurosci, 2015, 68:82-91.
[17]Duan Y, Li F, Tan K, et al. Key mediators of intracellular amino acids signaling to mTORC1 activation[J].AminoAcids, 2015, 47(5): 857-67.
[18]Meske V, Albert F, Ohm T G. Coupling of mammalian target of rapamycin with phosphoinositide 3-kinase signaling pathway regulates protein phosphatase 2A-and glycogen synthase kinase-3-dependent phosphorylation of Tau[J].JBiolChem,2008,283(1): 100-9.
Autophagy alleviates neuronal toxicity induced by abnormally phosphorylated tau protein
DING Qian1,3, ZHANG Jin2,3, MA Yu-yang1,3, SHEN Yu-jun3, SHEN Yu-xian3, FENG Li-jie1,3
(1.SchoolofBasicMedicalSciences,2.SchoolofPharmacy,3.InstituteofBiopharmaceuticalResearch,AnhuiMedicalUniversity,Hefei230001,China)
Aim To observe the effects of rapamycin (Rapa) and starvation-induced autophagy on the morphology of neuronal cells, tau protein aggregation and expression of phosphorylated tau protein, to explore the possible mechanism of cytoprotective effect of these two classical autophagy inducers on phosphorylated tau expressing cells.Methods N2a cells were transfected with GFP-tau plasmid, and equal amount of empty vector was used as control. Then cells were incubated with or without okadaic acid(OA) for 12 h, followed by treatment with autophagy inducers rapamycin(Rapa) and EBSS, autophagy inhibitor Bafilomycin A1(Baf A1) for 6 h. DAB was used to observe tau expression and cell morphology. Confocal microscopy was used to observe the intracellular tau aggregation. TUNEL assay and cleaved caspase-3 level were used to detect cell apoptosis. Immunoblot was used to detect the expression of phosphorylated tau and autophagy-related proteins.Results Our study showed that the N2a cells treated with OA exhibited small cell body, retracted processes and increased tau aggregation, compared with only tau-expressing cells.Rapa and EBSS treatment significantly improved cell morphology, decreased tau aggregation and reduced cell apoptosis. On the contrary, Baf A1 treatment induced aberrant cell shape and increased tau aggregation and cell apoptosis. In addition, Rapa significantly decreased the high molecular weight, phosphorylated tau whereas EBSS especially decreased the low molecular weight phosphorylated tau.Conclusions Rapa and EBSS is alleviate hyperphosphorylated tau-induced cytotoxicity through different mechanism. Rapamycin mainly decreases phosphorylated tau oligomers, while EBSS liable to decrease the soluble phosphorylated tau.
tau;phosphorylation; rapamycin; autophagy; protein degradation; cytotoxicity
时间:2017-5-25 17:44 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170525.1744.012.html
2017-01-13,
2017-02-10
国家自然科学基金资助项目(No 81302755)
丁 倩(1989-),女,硕士生,研究方向:神经药理学,E-mail:18356029206@163.com; 冯利杰(1980-),女,博士,副教授,硕士生导师,研究方向:神经药理学,通讯作者,E-mail: fenglijie1128@sina.com
10.3969/j.issn.1001-1978.2017.06.006
A
1001-1978(2017)06-0761-07
R329.24; R341; R745.7;R977.6
——雷帕霉素