新型化合物XN4抑制急性粒细胞白血病细胞增殖与其诱导氧化性的DNA损伤的关系
吴丽贤,黄立森,陈显凌,柯 方,郑 鸣,许建华
(1.福建医科大学药学院药理系,福建福州 350004;2.福建省天然药物药理学重点实验室,福建福州 350004;3.福建医科大学药学院药化系,福建福州 350108;4.福建医科大学人体解剖与组织胚胎学系,福建福州 350108;5.福建医科大学附属协和医院血液科,福建福州 350001;6.福建省血液病研究所,福建 福州 350001)
急性髓性白血病(acute myeloid leukemia,AML)[1]是源于造血干细胞的克隆性恶性疾病。以骨髓异常的原始细胞及幼稚细胞大量增殖,抑制正常造血,广泛浸润肝、脾、淋巴结等脏器为主要特征。其起病急、恶性程度高,如得不到及时诊治,生存期短。临床针对AML的治疗,以化疗为主,通过有效的化疗,不少患者病情得以缓解,但AML的复发和耐药问题比较突出[2],因此继续研发新的抗AML药物,可以提高AML的治愈率和解决AML的复发和耐药问题。
Nov(novobiocin)是香豆素类抗生素的代表药物,本课题组前期研究表明,Nov具有抑制急性粒细胞白血病细胞HL-60的增殖能力,但其活性较低,半数抑制率 IC50为 356.4μmol·L-1[3],为了提高 Nov的抑制急性粒细胞白血病的活性,本课题组合成了一系列Nov的衍生物,通过体外活性筛选,发现XN4具有明显的抑制AML细胞的增殖,但具体的作用机制不明。因此本课题组致力于通过研究XN4与DNA损伤的关系来探讨其抑制AML增殖的作用机制,为合成活性更强的Nov衍生物提供理论依据。
1 材料与方法
1.1 材料 HL-60细胞和KG1α细胞购置于中科院上海细胞库,按其细胞库参考要求进行培养。XN4由本课题合成和纯化,纯度为0.96,溶解于二甲基亚砜(DMSO)中,配成储存液 100 mmol·L-1于-20℃备用,使用前解冻,用培养液稀释成所需浓度。RPMI 1640培养基和胎牛血清均购于Hyclone公司。MTT购置于美国Sigma公司,用磷酸盐缓冲液(PBS)(0.01 mol·L-1,pH值 7.4)稀释成 5 g·L-1存储液,分装 ,-20℃避光储存;r-H2AX、p-ATM、Parp、cleaved Caspase-3、CDK2、Cyclin E1单克隆抗体均购置于Cell Signaling Technology公司 ,βactin单克隆抗体和羊抗鼠、羊抗兔IgG-HRP二抗购于凯基生物公司。ECL Western blot Detection System超强发光底物购置于Signalway Antibody公司。BCA蛋白定量试剂盒和流式凋亡检测试剂盒均购自瑞士Roche公司。RNA酶和碘化丙啶(PI)购于美国Sigma公司。NAC和ROS检测试剂盒购置于碧云天公司。Image station 4000MM成像系统购于柯达公司;BD FACSCantoⅡ流式细胞仪购于BD公司,电泳、转膜仪为BIORAD公司产品。
1.2 方法
1.2.1 细胞培养 AML细胞采用含10%的胎牛血清 RPMI 1640,青霉素(100 000 IU·L-1)和链霉素(50 mg·L-1),在 37℃、5%的 CO2孵育箱中培养,取对数生长期细胞用于实验。
1.2.2 XN4对AML细胞增殖的抑制作用 收集对数期生长的AML细胞,按每孔10 000个细胞体积为200μl种植于96孔培养板,不同浓度的XN4处理48 h,并设置对照组(不加药物),空白组(只加培养基,无细胞),每组设3个副孔,48 h后每孔加入5 g·L-1的MTT溶液20μl,继续培养4 h,800×g离心5 min,弃上清,加入150μl DMSO振荡10 min,用全自动酶标仪(Therm公司)检测570 nm处的吸光度(OD)值,结果采用GraphPad Prism 5软件分析,并绘制相应的抑制率-对数浓度曲线,计算药物的IC50。
1.2.3 XN4对AML细胞内ROS的影响 通过使用氧化敏感的荧光探针(DCFH-DA)检测细胞内ROS的水平[4]。不同浓度的XN4处理细胞24 h,5 mmol·L-1NAC预先处理AML细胞1 h再加上6 μmol·L-1XN4处理24 h。收集细胞,用 PBS洗涤两次,37℃下用10μmol·L-1的 DCFH-DA孵育细胞20 min(根据产品说明)。DCFH-DA被细胞内的非特异性酯酶脱去乙酰基,被ROS氧化成荧光性化合物DCF,流式细胞仪检测DCF荧光强度。
1.2.4 XN4对AML细胞内DNA损伤的影响 取对数生长期AML细胞,10μmol·L-1的 BrdU预处理30 min,不同浓度的XN4处理细胞24 h,5 mmol·L-1NAC预先处理AML细胞1 h再加上6μmol·L-1XN4处理24 h,收集细胞,以800×g离心5分钟,弃上清,破膜,DNase处理 1 h,anti-BrdU,anti-H2AX,anti-cleaved parp荧光探针室温孵育20 min,按试剂盒说明操作。转入到流式管中,上机检测。
1.2.5 XN4对AML细胞凋亡的影响 取对数生长期的AML细胞,不同浓度的XN4处理细胞24 h,5 mmol·L-1NAC预先处理AML细胞1 h再加上6 μmol·L-1XN4处理48 h,收集细胞,800×g离心 5 min,冷PBS重悬洗涤细胞两次,用500μl含有分别含有5μl Annxin V-FITC和5μl PI的Binding buffer重悬混匀细胞,室温避光孵育15 min,转移入流式管中,流式细胞仪上机检测。
1.2.6 XN4对AML细胞周期的影响 取对数生长期的AML细胞,不同浓度的XN4处理细胞,5 mmol·L-1NAC预先处理AML细胞1 h再加上6μmol·L-1XN4,37℃培养 48 h;收集细胞,800×g离心 5 min;用冷的PBS重悬洗涤细胞1次,再用0.5 ml冷PBS重悬细胞,并将其缓慢的滴加4.5ml预冷75%乙醇中,-20℃冰箱中放置过夜;800×g离心5 min,弃去乙醇,用PBS洗涤1次,用0.5 ml含有50 mg·L-1RNA酶和50 mg·L-1碘化丙啶的 PBS重悬细胞,室温避光孵育30 min,流式细胞仪上机检测。实验结果采用Modifit软件进行分析。
1.2.7 XN4对AML细胞内蛋白表达的影响 取对数生长期的AML细胞,不同浓度的XN4处理48 h,收集裂解细胞,蛋白定量,98℃蛋白变性,SDS聚丙烯酰胺凝胶电泳、转膜,封闭,相应一抗过夜孵育,TBST洗涤3次,每次10 min,室温下二抗孵育1 h,TBST洗涤3次,每次10 min,用 ECL Western blot Detection System超强发光底物在Image station 4000MM成像系统进行曝光显影。
1.2.8 统计学分析 实验数据采用¯x±s表示,实验独立重复3次,采用One-Way analysis of variance统计分析。
2 结果
2.1 XN4抑制AML细胞的增殖 不同浓度的XN4处理AML细胞48h后,MTT法检测,结果采用GraphPad Prism 5软件分析见(Fig 1),随着药物浓度的增加,XN4抑制HL-60和KG1α细胞增殖的能力逐渐增强,IC50分别为(2.79±0.15)μmol·L-1和(2.76±0.20)μmol·L-1,见 Fig 1。
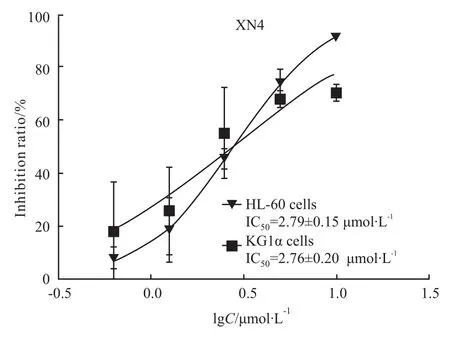
Fig 1 Proliferation inhibition of AML with XN4 treatments(¯x±s,n=3)
2.2 XN4明显增加AML细胞内ROS水平 ROS能够氧化DCFH-DA成荧光性化合物DCF,因此检测DCF的荧光强度可以间接反映ROS的水平[5]。不同浓度的XN4处理AML细胞24 h后,ROS检测表明XN4能明显增加AML细胞内ROS的水平,5 mmol·L-1NAC预先处理AML细胞1 h能逆转XN4诱导的ROS的增加(Fig 2)。
2.3 XN4诱导AML细胞DNA的损伤 r-H2AX是DNA损伤的一个灵敏性标志物,在DNA损伤时,其会聚集在 DNA损伤处形成焦点(Foci)[6],招募DNA损伤应答的相关蛋白。本实验的结果表明XN4能明显增加AML细胞中r-H2AX的表达,而5 mmol·L-1NAC预先处理1 h能逆转 XN4对 r-H2AX的改变(Fig 3)。
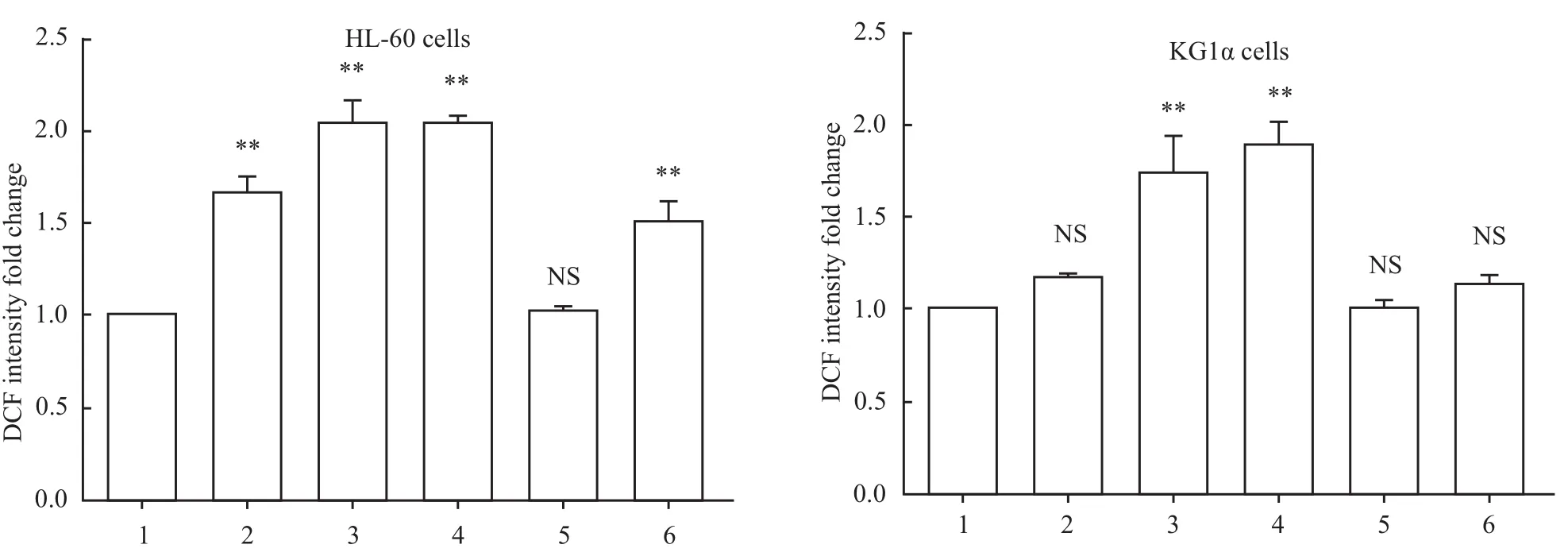
Fig 2 Effect of Nov on intracellular ROSwith XN4 treatments(x¯±s,n=3)1:Control;2:XN4 1.5μmol·L-1;3:XN4 3μmol·L-1;4:XN4 6μmol·L-1;5:NAC 5 mmol·L-1;6:NAC 5 mmol·L-1+XN4 6μmol·L-1Fig 2 Demonstrates that XN4 could significantly increase the level of intracellular ROS,5mmol·L-1NACpre-treating AML for 1h could reverse this effect.**P<0.01 vs control group.
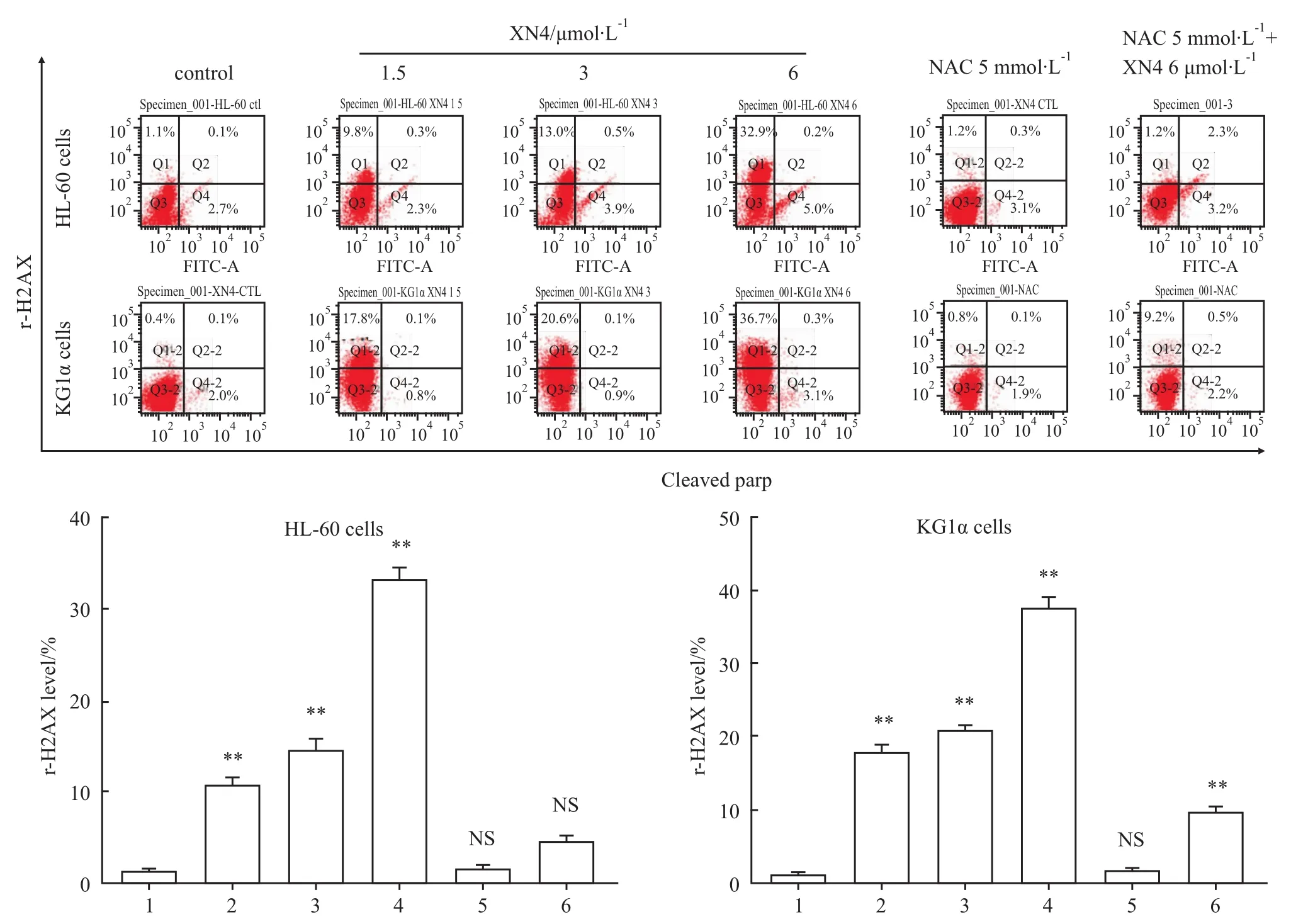
Fig 3 XN4 induced DNA damage to AML cells(¯x±s,n=3)1:Control;2:XN4 1.5μmol·L-1;3:XN4 3μmol·L-1;4:XN4 6μmol·L-1;5:NAC 5 mmol·L-1;6:NAC 5 mmol·L-1+XN4 6μmol·L-1Fig 3 obviously shows that XN4 could increase the level of r-H2AX,5mmol·L-1 NAC pre-treating AML for 1h could decrease this effect.**P<0.01 vs control group.
2.4 XN4增加AML细胞周期凋亡 不同浓度的XN4处理 AML细胞48 h,PI和 Annexin V-FITC双染[7]流式细胞术检测细胞凋亡结果表明,XN4能够明显增加细胞的凋亡率,当预先采用5 mmol·L-1NAC处理细胞1 h,XN4诱导细胞的凋亡作用明显减弱(Fig 4)。
2.5 XN4诱导AML细胞周期S期阻滞 不同浓度的XN4处理AML细胞24和48h,PI染色流式细胞术检测细胞周期,结果表明随着XN4药物浓度的增加,处于细胞周期S期细胞比例明显增加,细胞周期阻滞在S期(Fig 5)。
2.6 XN4对AML蛋白表达的影响 不同浓度的XN4处理AML细胞48 h,蛋白免疫印迹结果表明XN4能明显增加r-H2AX、ATM的表达以及Parp和Caspase-3的切割,而降低CDK2和Cyclin E1的表达(Fig 6)。
3 讨论
AML是白血病的主要类型,具有起病急、恶性程度高、好发于成人和儿童[8]。临床常用化学药物疗法如阿糖胞酐、环磷酰胺、长春新碱、柔红霉素等,这些药物虽然疗效尚可,但毒副作用大。
Nov作为一种抗生素也具有体外抗HL-60细胞及毒性低的优点,但活性低,IC50大。本课题组合成的新生霉素衍生物XN4在体外也表现出明显的抗AML细胞增殖的作用,并较其母药活性提高了近100多倍。本课题组通过前期对Nov的研究,表明Nov通过激活细胞内ROS,诱导DNA的损伤,从而发挥抑制慢性粒细胞白血病K562和K562/G01的增殖作用。
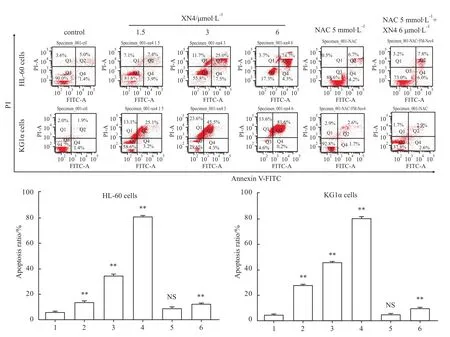
Fig 4 XN4 increases the apoptosis ratio of AML cells(¯x±s,n=3)1:Contol;2:XN4 1.5μmol·L-1;3:XN4 3μmol·L-1;4:XN4 6μmol·L-1;5:NAC 5 mmol·L-1;6:NAC 5 mmol·L-1+XN4 6μmol·L-1.PI and Annexin v-FITCdouble staining were used to examine the effect of XN4 on cell apoptosis.The data shows that XN4 could increase the apoptotic ratio of AML cells after XN4 treatment for 48h.5mmol·L-1NACpre-treating AML for 1h could decrease this effect.**P<0.01 vs control group.
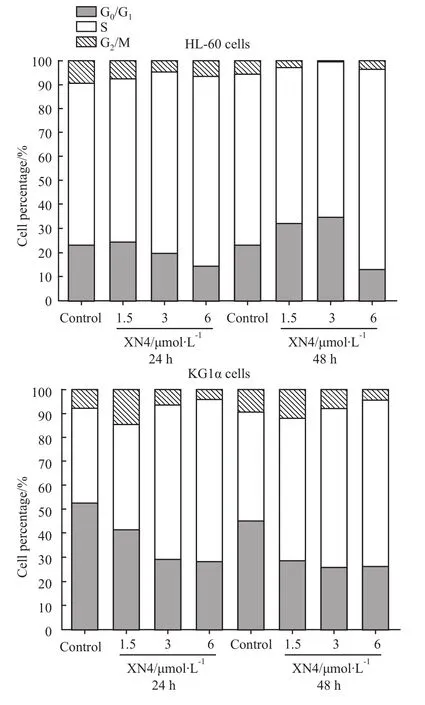
Fig 5 XN4 induced AML cell cycle S phase arrest
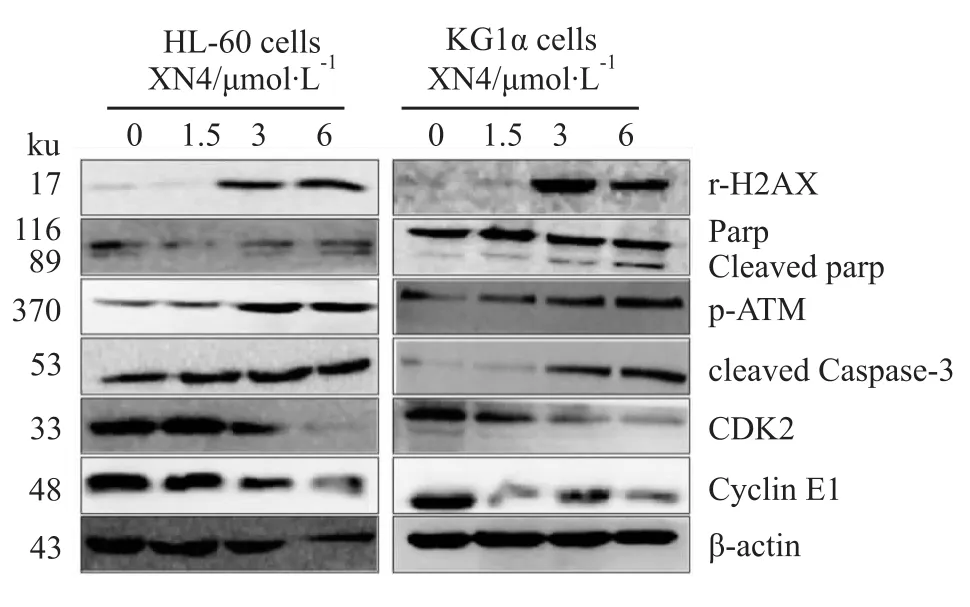
Fig 6 XN4 influences the intracellular proteins expression
ROS是细胞内反应性氧自由基,如超氧阴离子自由基、羟自由基、过氧化氢等[9],外环境的理化因素、化疗药物和细胞自身的代谢会导致ROS的激活,激活的ROS具有破坏生物体细胞膜和重要细胞器的结构和功能,如破坏线粒体,断绝细胞的能源;毁坏溶酶体,使细胞自溶;损伤DNA,导致基因突变和细胞凋亡[10]。H2AX是维持 DNA结构的组蛋白,在 DNA损伤时能够磷酸化成 r-H2AX,招募DNA损伤修复应答相关蛋白,在DNA断裂处形成焦点(Foci),因此r-H2AX成为检测DNA损伤的一个灵敏的标志物(biomarker)[11],Parp是执行 DNA损伤修复的一个重要功能蛋白,被切割成Cleaved Parp时失活。本实验结果表明XN4能够激活细胞内ROS,增加H2AX的磷酸化水平,诱导DNA的损伤;并且XN4能够促进Parp的切割,抑制DNA的损伤修复,而抗氧化剂NAC能够通过抑制ROS的激活,逆转XN4诱导DNA损伤。
众所周知,细胞本身具有应对DNA损伤修复的能力[12],当感知DNA损伤时,激活DNA损伤应答反应,诱导细胞周期阻滞,为DNA损伤修复提供时间;诱导细胞凋亡,清除损伤细胞。CDK2和Cyclin E1是维持细胞周期S期向 G2/M转换的重要分子[13],表达减少影响细胞周期进程,细胞阻滞于S期。Caspase-3是细胞凋亡级联反应的重要分子,被切割而活化,执行细胞程序化死亡功能。XN4通过抑制CDK2和Cyclin E1的表达水平,使细胞阻滞在S期,并且通过增加Caspase-3的切割,促进细胞的凋亡。
4 结论
XN4通过激活ROS,诱导HL-60及KG1α细胞DNA的损伤,抑制CDK2和Cyclin E1的表达诱导细胞S期阻滞期增殖,促进Parp和Caspase-3的切割,抑制DNA损伤修复功能和诱导细胞凋亡,从而抑制AML细胞增殖。
参考文献:
[1] Cooley S,Trachtenberg E,Bergemann T L,et al.Donors with group B KIR haplotypes improve relapse-free survival after unrelated hematopoietic cell transplantation for acute myelogenous leukemia[J].Blood,2009,113(3):726-32.
[2] Thomas D,Powell J A,Vergez F,et al.Targeting acute myeloid leukemia by dual inhibition of PI3K signaling and Cdk9-mediated Mcl-1 transcription[J].Blood,2013 122(5):738-48.
[3] 吴丽贤,许建华,张昆仲,等.新生霉素抑制HL-60/Bcr-Abl细胞增殖与阻断Hsp90伴侣功能的关系[J].中国药理学通报,2007,23(11):1419-24.
[3] Wu L X,Xu JH,Zhang K Z,et al.The mechanisms of apoptosis in HL-60 cells induced by Hsp90 inhibitor novobiocin[J].Chin Pharmacol Bull,2007,23(11):1419-24.
[4] Hollomon M G,Gordon N,Santiago-O Farrill JM,Kleinerman E S.Knockdown of autophagy-related protein 5,ATG5,decreases oxidative stress and has an opposing effect on camptothecin-induced cytotoxicity in osteosarcoma cells[J].BMC Cancer,2013,13(1):500.
[5] Trachootham D,Zhang H,Zhang W,et al.Effective elimination of fludarabine-resistant CLL cells by PEITC through a redox-mediated mechanism[J].Blood,2008,112(5):1912-22.
[6] Wu L,Shao L,An N,et al.IKKβRegulates the repair of DNA double-strand breaks induced by lonizing radiation in MCF-7 breast cancer cells[J].PLoSOne,2011,6(4):e18447.
[7] Bejarano I,Espino J,González-Flores D,et al.Role of calcium signals on hydrogen peroxide-induced apoptosis in human myeloid HL-60 cells[J].Int J Biomed Sci,2009,5(3):246-56.
[8] Lawrie A,Stevenson D A,Doig T N,et al.Acute myeloid leukemia presenting in a mother and daughter pair with the identical acquired karyotypic abnormality consisting of inversion 3q21q26 and monosomy 7:a review of possible mechanisms[J].Cancer Genet,2012,205(11):599-602.
[9] Gavella M,Lipovac V.Protective effects of exogenous gangliosides on ROS-induced changes in human spermatozoa[J].Asian J Androl,2013,15(3):375-81.
[10]Labunskyy V M,Gladyshev V N.Role of reactive oxygen species-mediated signaling in aging[J].Antioxid Redox Signal,2013,19(12):1362-72.
[11]Shah K,Cornelissen B,Kiltie A E,Vallis K A.CanγH2AX be used to personalise cancer treatment[J]?.Curr Mol Med,2013,13(10):1591-602.
[12]Caron P,Aymard F,Iacovoni JS,et al.Cohesin protects genes againstγH2AX Induced by DNA double-strand breaks[J].PLoS Genet,2012,8(1):e1002460
[13]Markkanen E,van Loon B,Ferrari E,et al.Regulation of oxidative DNA damage repair by DNA polymeraseλand MutYH by cross-talk of phosphorylation and ubiquitination[J].Proc Natl Acad Sci USA,2012,109(2):437-42.

