桑氏链霉菌产几丁质酶特性及对杨树紫纹病的生防作用1)
李姝江 朱天辉 彭 艳 雷美艳 韩 珊
(四川农业大学,雅安,625014)
杨树紫纹羽病为世界性的一种杨树病害,从苗到大树均能受害。杨树发生紫纹羽病后,轻者影响树体正常生长,降低木材质量,重者引起个体或林木成片死亡,造成严重的经济损失,影响杨树种植业的发展[1]。目前对杨树紫纹羽病的防治措施主要有,对苗木严格检疫,避免栽植带病苗木;加强栽培管理,增强树势;采用波尔多液、硫酸铜、硫酸亚铁、代森铵、福尔马林、福美砷药液进行灌根。化学农药是毒性较高、环境释放率较大、影响面广的物质,会破坏农业生态甚至危害人体健康[2]。因此,开发替代化学杀菌剂的新型生物杀菌剂已成为必然[3]。国内外对杨树紫纹羽病生物防治的研究报道较少,有研究表明绛红褐链霉菌(Streptomyces purpeofuscus YSSPG3)发酵液对杨树紫纹羽病菌会产生抑菌带[4],分离自石榴果实中的1 株枯草芽孢杆菌(Bacillus subtilis)所产生的挥发性物质能使杨树紫纹羽病菌的菌丝变粗[5]。链霉菌是革兰氏阳性放线菌,具有复杂的次级代谢调控网络并产生大量具有重要价值的天然代谢物,包括抗生素[6]、杀虫剂[7]以及胞外水解酶,如纤维素酶[8]、几丁质酶[9]、果胶酶[10]、淀粉[11]等,广泛应用于医疗、农业、食品等领域。谢晨昭等[12]分离得到的拮抗放线菌B1 菌株—淡紫灰链霉菌(Streptomyces lavendulae),对番茄灰霉病菌(Botrytis cinerea)等10 种植物病原真菌和甘蓝黑腐病菌(Xanthomonas campestris)等3 种植物病原细菌均有抑制作用,有较广的抑菌谱,其抗菌活性物质对番茄灰霉病有良好的防治效果。拮抗球胞链霉菌AM6 的代谢产物可用于烟草赤星病的田间防治,且田间防效可达80.3%[13]。国内外关于桑氏链霉菌的抗真菌活性已有少许报道,例如从菜园土壤样品中分离得到的S.sampsonii GS1322 抗真菌活性的研究[14]、利用大孔吸附树脂对S.sampsonii HP-47 抗真菌活性物质的吸附工艺的研究[15]等。笔者从健康的杨树根际土壤中分离筛选到1 株对杨树紫纹羽病菌有较好拮抗效果的产几丁质酶的菌株,并对其产几丁质酶特性进行研究,优化其产酶条件,并将优化培养的发酵滤液用于田间防治试验,以期为其在生防中的实际应用奠定理论基础。
1 材料与方法
1.1 供试菌株
紫丝核菌(Rhizoctonia violacea),由四川农业大学林学院森林保护学实验室提供。菌株112903:从健康的杨树根际土壤中分离得到。
1.2 胶体几丁质的制备
参照文献[16]的方法进行操作。
1.3 主要培养基
高氏一号培养基、牛肉膏蛋白胨培养基、PDA培养基、几丁质平板培养基(胶体几丁质200 mL,MgSO4·7H2O 0.5 g,K2HPO40.7 g,KH2PO40.3 g,FeSO4·7H2O 0.01 g,ZnSO40.001 g,琼脂20 g,蒸馏水1 L,pH=7.0 ~7.2)、产酶基础培养基(胶体几丁质200 mL,K2HPO40.7 g,KH2PO40.3 g,MgSO4·7H2O 0.5 g,FeSO4·7H2O 0.01 g,ZnSO40.001 g,蒸馏水1 L,pH=7.0),其余培养基参照《链霉菌鉴定手册》。所用试剂均为国产AR 级试剂。
1.4 土壤放线菌的分离
利用稀释涂布平板法[17]分离单菌落,并分别保存备用。
1.5 拮抗放线菌的筛选
以紫丝核菌为靶标,采用平板对峙法[18]进行初筛。经初筛得到的菌株,用划线法经分离纯化出菌落。然后再接种于几丁质平板上,置于生化培养箱内(28 ℃),培养时间同初筛,观察单菌落周围透明圈的产生情况,筛选出对杨树紫纹羽病具有较好拮抗活性的放线菌,保存备用。
1.6 菌株112903 的鉴定
形态特征观察:在高氏一号和PDA 培养基采用平皿插片法[19]进行形态观察,分别于5 ~10 d 取出插片置载玻片上在光学显微镜下观察气生菌丝、基内菌丝和孢子丝的形态。参照《植物病原真菌的超微结构》[20]进行扫描电子显微镜观察。
培养特征观察和生理生化特征分析:参照文献[21]中推荐的部分培养基和方法对菌株112903 进行培养特征观察和生理生化鉴定,28 ℃恒温培养7 ~14 d 后观察记录特征。
16 S rDNA 序列分析:菌株112903 的基因组DNA 的提取采用购于天根公司的DNA 试剂盒,以提取的DNA 为模板,用16 S rDNA 的通用引物对其进行扩增。通用引物为1492R 5'-AGAGTTTGATCCTGGCTCAG- 3' 和 27F 5'- GGTTACCTTGTTACGACTT-3'。16 S rDNA 片段的扩增条件为94℃预变性5 min;再以94 ℃变性30 s,55 ℃退火1 min,72 ℃延伸2 min,30 次循环;72 ℃后延伸5 min;4 ℃保存。PCR 产物在1.0%琼脂糖凝胶(含EB 0.5 mg/L)上电泳观察,1×TAE 电泳缓冲液,80 V,40~50 min,在紫外灯下观察结果,PCR 产物应在大约1.5 kb 位置有一明显的电泳带。获得的PCR 产物送上海生工纯化测序。将测序得到的序列与NCBI 数据库中已经注册的菌株进行BLAST 分析,利用NAMAN 对序列进行同源性比对,选取同源性高的菌株,采用Neighbor-joining(Clustrax1.8 和MAGE4.0软件)构建系统发育树,依据Nucleotide:Kimura 2-Paramter 推测遗传距离Bootstrap(500replicates;seed=64238),具体参照文献[22]方法进行。
1.7 菌株112903 产几丁质酶发酵条件的优化
菌株112903 孢子悬液制备:将菌株112903 接种于几丁质平板,25 ℃培养4 d,进行活化。将平板表面的孢子刮落下来,用无菌水制备量浓度为107菌落/mL 的孢子悬液。
酶活力的测定:制备菌株112903 发酵滤液,以产酶培养基为初始培养基,将配置好的培养基分装至100 mL 三角瓶中,每瓶20 mL,121 ℃灭菌30 min,冷却后每瓶接入1 mL 量浓度为107菌落/mL的孢子悬液,每个平行样品设3 次重复,然后置于恒温摇床上,25 ℃,140 r/min,培养一定时间后,5 000 r/min,4 ℃离心15 min,65 ℃下浓缩至50 mL,离心,留上清液,用0.22 μm 孔径无菌过滤器过滤除菌,获得制备好的发酵滤液。
几丁质酶活力测定方法:在0.5 mL 胶体几丁质和1 mL 磷酸盐缓冲液(pH =7.0)体系中加入1 mL发酵滤液,50 ℃准确水浴1 h,以DNS 法[23]测定反应产生的还原糖。冷却离心后,取上清液在波长540 nm 下测吸光度(OD),并与已知浓度的N-乙酰氨基葡萄糖(NAG)的OD 值做标准对照。根据DNS 法作N-乙酰氨基葡萄糖(NAG)标准曲线计算出酶活力[24]。以50 ℃下,每分钟酶催化胶体几丁质释放出1 μg NAG 所需的酶量为一个酶活单位。
培养时间与产几丁质酶的关系:以产酶基础培养基为初始培养基。每培养24 h 测定一次几丁质酶活力。并绘制生防链霉菌的产酶曲线,得出最佳产酶时间,作为下步试验酶活力测定时间。
培养基的初始pH 值对链霉菌产几丁质酶的影响:用HCl 和NaOH 溶液将后产酶培养基起始pH值调成3 ~12,按1 递增,10 个梯度,以中间值为对照。第6 天测定几丁质酶活力,测定方法同几丁质酶活力测定。
不同培养温度对桑氏链霉菌产几丁质酶的影响:分别将产酶培养基放入到恒温箱中24、26、28、30、32 ℃培养,第6 天测定几丁质酶活力,测定方法同几丁质酶活力测定。
碳氮源对链霉菌产几丁质酶的影响:在产酶基础培养基中添加1%的各种碳源,以基础培养基为对照,碳源有以下几种:葡萄糖、NAG、麦芽糖、蔗糖、乳糖、甘油、淀粉、研究各种碳源对产酶的影响。在产酶基本培养基中添加0.2%的各种氮源,以基本培养基为对照,无机氮源有(NH4)2SO4、NH4NO3、KNO3;有机氮源有蛋白胨、牛肉膏,研究不同氮源对产酶的影响。第6 天测定几丁质酶活力,得出最佳碳氮源。
产酶培养基配方的优化:在确定最佳碳源、氮源的基础上,设置胶体几丁质(100、200、300 mL/L)、蛋白 胨(0.10%、0.25%、0.40%)、无 机 盐——K2HPO4(0.4、0.7、1.0 g/L)、KH2PO4(0.15、0.30、0.60 g/L)4 因素3 水平的正交试验,第6 天测定几丁质酶活力。
1.8 发酵滤液对杨树紫纹羽病的田间防效测定
选择历年发病中等林地,移栽健康杨树苗木。将于产酶基础培养基与发酵优化培养基中发酵后所得的滤液按体积比分别稀释10、50、100、200、400、600、800 倍后,加上原液分别沿杨树苗木根系幅面灌根,以无菌水为对照。每株100 mL,每处理30株,6 重复。每年春、夏季各施用一次,秋季统计发病率,发病率为发病株数占总株数的比例。
1.9 数据处理
利用SPSS19.0 对数据进行单因素ANOVA 分析,采用LSD 法进行多组样本间差异显著性分析。
2 结果与分析
2.1 拮抗菌的筛选结果
以R.violacea 为指示菌,通过初筛、复筛得到具有明显拮抗效果的3 株放线菌,编号分别为JK1-3、JK2-1、112903,经过计算各菌株的抑制率分别是51.6%、53.3%、61.3%。可见,放线菌112903 抑菌活性强,抑菌性稳定,因此确定菌株112903 为下一步的试验菌株,用于进一步研究分析。
2.2 菌株112903 的分类地位
2.2.1 形态特征
菌株112903 在高氏一号培养基上生长良好,菌落表面呈粉绒状凸起,菌落乳脂色,在PDA 培养基上带有明显褶皱,培养7 ~10 d 后,显微镜下可以看见菌株112903 基内基内菌丝丰富,菌丝无横隔,多分支,不断裂;电镜扫描结果显示,孢子丝长而直,柔曲,偶见2 ~3 圈螺旋形。孢子卵圆形至短圆柱形,表面光滑(图1)。

图1 菌株112903 扫描电镜观察结果[左为菌丝(1500 ×)];右为孢子(2000 ×)]
2.2.2 培养特性及生理生化特性
利用不同的培养基培养,菌株112903 在瓦氏肉汁琼脂、牛肉膏蛋白胨、PDA、马铃薯块培养基上气生菌丝和基内菌丝都生长良好,气生菌丝蚌肉白至浅鹤灰,基生菌丝尘灰至棕叶绿。而在高氏一号琼脂、葡萄糖天门冬素琼脂、无机盐淀粉琼脂培养基上气生菌丝不发达;在PDA 培养基上可产生金褐色的可溶性色素,所产的气生菌丝与基内菌丝的颜色有差别(表1)。该菌可在15 ~45 ℃环境下生长,环境温度为45 ℃时基内菌丝生长,但不产生孢子。其存活pH 值为3 ~12;能水解淀粉,能液化明胶,不能使牛奶凝固,不能还原硝酸盐,不能产生黑色素和H2S,不能在纤维素上生长。利用葡萄糖、麦芽糖、甘油、甘露醇、山梨醇,不利用木糖、果糖、酒石酸钠和肌醇。
2.2.3 16 S rDNA 分析与系统发育树
以菌株112903 的基因组DNA 为模板,利用16 S rDNA 基因引物进行PCR 扩增,得到1.4 kb 的PCR 扩增产物。经测序,得到的16 S rDNA 全序列经过校对后,与GeneBank 序列数据库中的已有序列进行比对,根据序列同源性从高到低的次序选取模式菌株的序列用于序列分析,利用ClustalX 程序进行列阵分析,并用Mega4 构建系统发育树(图2)。研究发现就16 S rDNA 序列而言,菌株112903 与Streptomyces sampsonii 同源性达到了99.31%。
2.3 菌株112903 产几丁质酶发酵条件优化
2.3.1 初始pH、培养时间和培养温度对桑氏链霉菌产几丁质酶的影响
几丁质酶活性在pH 为7.0 时达到最大。此后,随着pH 值增大,酶活力持续下降。该菌株的最佳产酶pH 为中性,pH 过高或过低对产酶的影响较大(图3A)。几丁质酶活力在第6 天达到最大值,此后随着培养时间的延长,培养液中的几丁质酶活性开始下降。因此在后续的试验中,选择第6 天作为最佳酶活力的测定时间(图3B)。该菌株最佳产酶培养温度为26 ℃(图3C)。总体来说,在试验测定范围内,培养温度对几丁质酶产酶的影响较小。

表1 菌株112903 的培养特征

图2 基于16 S rDNA 的菌株112903 与相关菌株的系统发育树
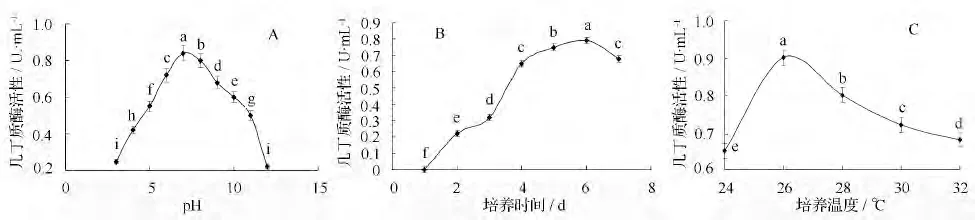
图3 初始pH、培养时间、培养温度对菌株112903 产酶活性的影响
2.3.2 不同碳源、氮源对菌株112903 产几丁质酶的影响
在产酶基础培养基中,以100 mL/L 的胶体几丁质与0.1%的其它碳源作为复合碳源进行发酵对比试验,以葡萄糖、淀粉、麦芽糖、乳糖、NAG、作为添加碳源时,吸光度达到仪器的极限值,无法估算其中的几丁质酶含量。添加蔗糖和甘油的培养基发酵液的酶活力低于以胶体几丁质作为唯一碳源的酶活力,蔗糖和甘油对产酶有一定的抑制作用,以胶体几丁质作为唯一碳源时产酶效果最好,结果如表2所示。

表2 不同碳源对菌株112903 产酶活性的影响
在产酶基础培养基中分别添加几种单一有机或无机氮源,结果表明,以蛋白胨为氮源时酶活力最高,其次是牛肉膏;采用单一无机氮源时产酶都较低(表3)。

表3 不同氮源对菌株112903 产酶活性的影响
2.3.3 碳源、氮源和无机盐对产酶影响的正交试验结果
根据单因素试验的结果,以胶体几丁质、蛋白胨、K2HPO4、KH2PO4为产酶因素,按L9(34)设计试验,分别取发酵滤液进行几丁质酶活力测定,9 组试验结果分别为0.320 0、0.256 7、0.926 7、0.366 7、0.223 3、0.650 0、0.426 7、0.283 3、0.826 7 U/mL。确定较优产酶培养基配方。根据正交试验结果,菌株在4 因素的影响下产酶的最佳配比是:胶体几丁质300 mL/L,蛋 白 胨0.4%,K2HPO41.0 g/L,KH2PO40.6 g/L。各因素均达到极显著水平,其中对产酶影响最大的是氮源含量,其次为胶体几丁质、K2HPO4,相比之下底物浓度和KH2PO4对产酶的影响较小(表4、表5)。
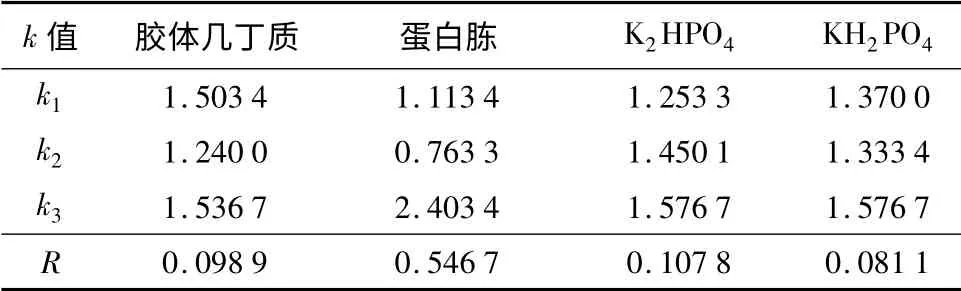
表4 不同碳氮源、无机盐对菌株112903 产酶影响的正交试验极差分析结果

表5 不同碳氮源、无机盐对菌株112903 产酶影响的正交试验方差分析结果
2.4 发酵滤液对杨树紫纹羽病的田间防治效果
通过观察并统计杨树紫纹羽病的发生率(图4),结果显示,对S.sampsonii 112903 产几丁质酶条件优化后,可显著降低杨树紫纹羽病的发生率,特别是使用优化后的发酵原液及稀释10、50 倍的发酵滤液处理时,无发病现象,从而显著提高防治效果。
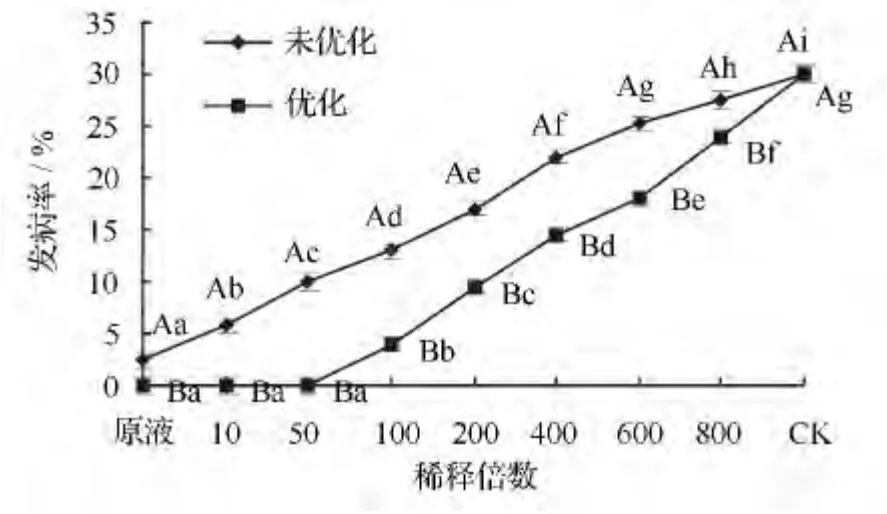
图4 发酵滤液对杨树紫纹羽病田间防治效果
3 结论与讨论
链霉菌广泛地存在自然界中。有关桑氏链霉菌S.sampsonii 的报道,R E 布坎南在《伯杰氏细菌鉴定手册》第8 版中记载该菌是从普通马铃薯的疮痂病中分离到的[25];而贺春玲[26]、吴浩瑄等[15]分别从长木蜂蜂粮和海绵中分离得到;本试验分离出S.sampsonii 112903 是从健康的杨树根际土壤中筛选得到。另一方面,微生物几丁质酶不仅在生物降解几丁质方面起着重要作用,而且可通过水解病原真菌的细胞壁而有效地抑制其生长[27]。本试验利用平板对峙法筛选到对杨树紫纹羽病有拮抗作用的3株菌株,进而用胶体几丁质平板检查产几丁质酶性能,结合形态、生理生化特性及16 S rDNA 分析获得S.sampsonii 112903。微生物产几丁质酶能力不仅取决于生产菌种本身的性能,而且需要合适的环境,才能使其性能充分表现出来。目前对几丁质酶的发酵研究较多的是木霉属真菌[28]和芽孢杆菌属细菌[29],对桑氏链霉菌几丁质酶发酵鲜有报道。本试验通过摇瓶发酵试验,以发酵几丁质酶活性为指标,采用单因素和正交试验对S.sampsonii 112903 的培养基组成和发酵条件进行了优化。其中,培养基初始pH 值对菌株产几丁质酶影响较大,这与Leger等[30]等的结论相同,他们还通过RNA Northern 印迹分析证明,pH 值在几丁质酶基因的表达中起着重要作用,这一结果有助于对几丁质酶基因的进一步研究。众所周知,碳、氮源是影响微生物发酵的最主要因素,本研究中仅使用胶体几丁质是诱导该菌产几丁质酶的最佳碳源,这一结果与大多数研究相同[31-32];胶体几丁质比细粉几丁质分散均匀,诱导产酶能力更强,但与邓红梅等[33]结论不同,可能由于不同种类微生物对其利用有所不同。以甘油和蔗糖作为添加碳源时的酶活力比几丁质作为唯一碳源时的酶活力低,出现这种现象可能是S.sampsonii 112903 对碳源的利用有一个诱导的过程,并且各种碳源的诱导途径不一样,使几丁质酶的表达滞后。本试验中蛋白胨为最佳氮源,证实有机氮比无机氮诱导产酶更佳,但杨绍青等[32]认为2 种氮源的复配提供的营养更为全面,S.sampsonii 112903 是否存在同样结果有待进一步的研究。再者,K2HPO4与KH2PO4是一对缓冲体系,维持发酵环境的稳态,同时又为S.sampsonii 112903 提供磷元素,因此在发酵组分中起重要作用。
在田间防治试验中,优化培养后的发酵滤液对杨树紫纹羽病有较好的防治效果,10 倍和50 倍发酵液的处理均无发病现象,说明优化后S.sampsonii 112903 产几丁质酶大大增加,从而使杨树根部形成有益的小生境,阻碍病原菌的侵染、抑制病原菌的繁殖和扩展,因此起到较好的预防与治疗作用。本研究结果中S.sampsonii 112903 表现出了较好的应用前景,为将其开发用于生物防治奠定了一定的基础。
[1] 赵桂华,王海明,牛迎福,等.杨树紫纹羽病发生与防治[J].西部林业科学,2010,39(1):86-89.
[2] 华小梅,江希流.我国农药环境污染与危害的特点及控制对策[J].环境科学研究,2000,13(3):40-43.
[3] Philip Jarvis,关爱莹,刘长令.生物农药的现状与发展趋势[J].农药科学与管理,2002,23(3):29-30,34.
[4] 张丽娜,朱天辉,李芳莲.绛红褐链霉菌YSSPG3 的鉴定及其抗菌蛋白纯化[J].植物病理学报,2012,42(3):242-251.
[5] 周翠,乔鲁芹,金静,等.一株枯草芽孢杆菌挥发性物质的抑菌作用初步研究[J].农药学学报,2011,13(2):201-204.
[6] 陈祈磊,赵子翰,王辂,等.黄灰链霉菌SIIA-A02191 产生的多环口山酮类新抗生素Bromoxantholipin[J].中国抗生素杂志,2011,36(8):566-570.
[7] Bentley S D,Chater K F,Cerdeno-Tarraga,et al.Complete genome sequence of the model actinomycete Streptomyces coelicolor A3 (2)[J].Nature,2002,417:141-147.
[8] 徐杰,杨谦.一株高活力纤维素酶产生菌-链霉菌C-5 产酶研究[J].太阳能学报,2009,30(5):682-685.
[9] 邱立友,王明道,戚元成,等.链霉菌A048 产几丁质酶最佳发酵工艺研究[J].微生物学通报,2006,33(2):58-62.
[10] Kuhad R C,Kapoor M,Rustagi R.Enhanced production of an alkaline pectinase from Streptomyces sp.RCK-SC by whole-cell immobilization and solid-state cultivation[J].World Journal of Microbiology and Biotechnology,2004,20(3):257-263.
[11] Chakraborty S,Khopade A,Kokare C,et al.Isolation and characterization of novel α-amylase from marine Streptomyces sp.D1[J].Journal of Molecular Catalysis B:Enzymatic,2009,58(1/4):17-23.
[12] 谢晨昭,杨毅玲,李磊,等.拮抗放线菌B1 菌株鉴定及其防治番茄灰霉病的初步研究[J].植物保护学报,2008,35(4):300-306.
[13] 储慧清,方敦煌,孔光辉,等.拮抗球胞链霉菌AM6 代谢产物防治烟草赤星病的田间效果测定[J].云南农业大学学报,2004,19(1):4-6,23.
[14] Jain P K,Jain P C.Isolation,characterization and antifungal activity of Streptomyces sampsonii GS 1322[J].Indian Journal of Experimental Biology,2007,45(2):203-206.
[15] 吴浩瑄,任大明,陈红漫,等.大孔吸附树脂对桑氏链霉菌HP-47 抗真菌活性物质的吸附工艺[J].江苏农业科学,2011,39(4):117-120.
[16] Chen Chunti,Huang Chienjui,Wang Yihuei,et al.Two-step purification of Bacillus thuringiensis chitinase A1 expressed in Escherichia coli periplasm[J].Protein Expression and Purification,2004,37(1):27-31.
[17] 沈萍,陈向东.微生物学实验[M].4 版.北京:高等教育出版社,2007:29-31.
[18] Cao L,Qiu Z,You J,et al.Isolation and characterization of endophytic Streptomyces strains from surface-sterilized tomato (Lycopersicon esculentum)roots[J].Letters in Applied Microbiology,2004,39(5):425-430.
[19] 姜云,黄丽丽,陈长卿,等.一株拮抗番茄叶霉病菌的放线菌筛选、鉴定及发酵条件研究[J].微生物学报,2007,47(4):622-627.
[20] 康振生.植物病原真菌的超微结构[M].北京:中国科学技术出版社,1996:1-29.
[21] 中国科学院微生物研究所放线菌分类组.链霉菌鉴定手册[M].北京:科学出版社,1975:13-15.
[22] 徐丽华,李文均,刘志恒,等.放线菌系统学:原理、方法及实践[M].北京:科学出版社,2007:59-62.
[23] 查岭生,胡鹏,吴晓敏,等.DNS 法测定植物组织中还原糖含量实验的改进[J].安徽农学通报,2013,19(11):16,26.
[24] 张海涛,王婷,田囡,等.几丁质酶产生菌筛选鉴定及产酶性能研究[J].中国生物工程杂志,2010,30(8):82-87.
[25] 布坎南R E,吉本斯N E.伯杰氏细菌鉴定手册[M].8 版.中国科学院微生物研究所《伯杰细菌鉴定手册》翻译组,译.北京:科学出版社,1984.
[26] 贺春玲.长木蜂蜂粮防腐机理研究[D].南京:南京林业大学,2009.
[27] 王治伟,刘志敏.微生物几丁质酶研究进展[J].生物技术通讯,2006,17(3):439-442.
[28] 杨春林,席亚东,谢华蓉,等.哈茨木霉Th-30 几丁质酶的生产条件及对灰霉病菌的拮抗作用[J].植物保护学报,2009,36 (4):295-300.
[29] 孙慎侠,付昌斌,伦永志,等.芽孢杆菌菌株产几丁质酶发酵条件的研究[J].中国微生态学杂志,2003,15(3):144-146.
[30] St Leger R J,Joshi L,Roberts D.Ambient pH is a major determinant in the expression of cuticle-degrading enzymes and hydrophobin by Metarhizium anisopliae[J].Applied and Environmental Microbiology,1998,64(2):709-713.
[31] 张灿,黄德智,李丰硕,等.海洋产几丁质酶菌株的筛选及发酵条件优化[J].吉林农业大学学报,2012,34(2):141-146.
[32] 杨绍青,张舒平,闫巧娟,等.高产几丁质酶高温紫链霉菌的筛选和发酵条件优化[J].中国农业大学学报,2013,18(2):167-173.
[33] 邓红梅,毕方铖,叶炬斌,等.几丁质酶高产菌的筛选及其产酶条件的优化研究[J].化学与生物工程,2010,27(5):62-65.

