唑来膦酸与紫杉醇体外协同抗肺腺癌细胞增殖及诱导凋亡的分子机制研究
刘 霞 张会来 周世勇 钱正子 王先火 王华庆
双膦酸盐是治疗肿瘤骨转移常用的药物。特别是ZOL治疗骨转移取得了极大成功。随着对ZOL的研究,不少学者发现ZOL在体外能够诱导肺癌、乳腺癌等多种肿瘤细胞的凋亡[1];并且ZOL联合细胞毒药物具有协同抗肿瘤作用[2]。本实验拟研究ZOL对人肺腺癌A-549细胞体外生长增殖的作用及潜在机制。
1 材料与方法
1.1 材料
A-549细胞由天津医科大学肿瘤医院免疫室提供;ZOL由瑞士诺华公司赠送;合成基因所需引物及测序由大连宝生物工程公司完成;核酸提取试剂Trizol,实时定量荧光试剂盒购自日本TaKaRa公司;兔抗人ERK多克隆抗体、兔抗人P-ERK多克隆抗体、兔抗人AKT多克隆抗体、兔抗人P-AKT多克隆抗体、兔抗人P-Bcl-2多克隆抗体均购自美国Cell Signaling Technology公司;辣根过氧化物酶(HRP)标记的山羊抗兔IgG抗体购自北京中杉金桥生物公司。
1.2 方法
1.2.1 A-549细胞培养 应用24孔培养板培养A-549,每天计数3个孔细胞数,绘制1周的生长曲线。
1.2.2 细胞杀伤实验 MTT方法测定不同浓度ZOL单药(10、20、30、40、50、60、70、80、90、100 μM)与联合PTX(2 nM)用药后A-549生长情况。联合用药组根据给药顺序的不同分为先PTX后ZOL组、PTX+ZOL同时组、先ZOL后PTX组。MTT处理后,检测吸光度值(OD)。计算各组抑制率,抑制率(%)=1-(实验组OD/对照组OD)×100%。
1.2.3 细胞凋亡分析 A-549接种于75 cm2培养瓶中,分组加药,包括对照组、ZOL组(100 μM)、PTX组、先PTX后ZOL组、PTX+ZOL同时组、先ZOL后PTX组。药物作用后,收集各组细胞,流式细胞仪检测凋亡率。判断标准:正常细胞AnnexinⅤ(-),PI(-);凋亡细胞AnnexinⅤ(+),PI(-);坏死细胞AnnexinⅤ(+),PI(+)。重复3次,计算各组平均凋亡率,以±s表示。
1.2.4 RT-PCR检测mRNA表达 A-549接种于75 cm2培养瓶中,分组加药,包括对照组、ZOL组(100 μM)、PTX组、先PTX后ZOL组。GenBank检索ERK、AKT、β-actin的mRNA序列,采用PCR PRIMER计算机软件辅助设计,最大程度保证扩增特异性。扩增ERK、AKT、β-actin。RT-PCR定量检测mRNA表达。基因表达量计算方法:CT(cycle threshold)值代表扩增产物达到设定阈值经历的循环数。按公式计算样本中mRNA相对表达量。ΔCT(目的基因)=CT(目的基因)-CT(β内参);ΔΔCT=ΔCT(目的基因)-ΔCT(标准值),目的基因相对表达量为 2-ΔΔCT。
1.2.5 Western blot检测蛋白表达 A-549接种于75 cm2培养瓶中,分组加药,包括对照组、ZOL组(100 μM)、PTX组、先PTX后ZOL组。药物作用后提取蛋白,进行蛋白电泳,并行电转移,PVDF膜取出,蛋白免疫检测并显影。采用Bio-Rad凝胶成像系统照相记录。Western blot显示的蛋白条带扫描后采用凝胶图像处理系统分析目标带的分子量和吸光度值,采用两组吸光度值/内参吸光度值进行统计学分析。
1.3 统计学处理
采用SPSS 16.0统计软件进行数据处理。数据符合正态分布且方差齐性选用单因素方差分析;不符合正态分布或方差不齐采用非参数检验。结果以±s表示。P<0.05为差异有统计学意义。
2 结果
2.1 A-549细胞生长特点
通过绘制1周的生长曲线,A-549细胞孵育1 d后进入对数生长期,此时细胞用于实验。
2.2 不同浓度ZOL对A-549细胞生长抑制作用
ZOL为10~100 μM对A-549均有抑制作用,并随着ZOL浓度增加而增强。结合国内外实验用药浓度[3]及临床血药浓度分布特点,选择100μM为ZOL联合用药浓度。
2.3 不同给药组对A-549细胞生长抑制作用
ZOL+PTX同时组细胞抑制率较单药组增高(表1)。ZOL与PTX具有协同增效作用。在3个联合用药组中,先PTX后ZOL组抑制率最大,其次为ZOL与PTX同时组,而先ZOL后PTX组抑制率最小。不同顺序联合用药组抑制率差异有统计学意义(F=16.07,P<0.01),3组抑制率两两比较差异有统计学意义(P<0.05)。
2.4 不同给药组对A-549细胞诱导凋亡作用
单药组细胞凋亡率较对照组高(表2),差异有统计学意义(F=1 545,P<0.01);用药组两两比较时,各组间差异有统计学意义(P<0.05);联合用药组间比较时,差异有统计学意义(P<0.01)。联合用药组细胞凋亡率大小与给药顺序有关。
2.5 RT-PCR结果
先PTX后ZOL组的AKT基因表达量低于PTX、ZOL和空白对照组(表3),且先PTX后ZOL组与其他3个组比较,差异有统计学意义(F=568,P<0.05)。
先PTX后ZOL组的ERK基因表达量低于PTX、ZOL和空白对照组(表4),且先PTX后ZOL组与其他3个组比较,差异亦有统计学意义(F=532,P<0.05)。
表1 ZOL、PTX单药,ZOL与PTX联合用药对A-549抑制率(±s)Table1 Inhibition rate of ZOL alone,PTX alone,or combined treatment with ZOL and PTX in A-549 cells (±s)

表1 ZOL、PTX单药,ZOL与PTX联合用药对A-549抑制率(±s)Table1 Inhibition rate of ZOL alone,PTX alone,or combined treatment with ZOL and PTX in A-549 cells (±s)
Experimental group PTX(2 nM)ZOL(100 μM)ZOL and PTX together PTX then ZOL ZOL then PTX Inhibition rate(%)12.07±0.70 27.81±1.38 41.96±3.29 46.57±3.30 37.66±0.36
表2 ZOL、PTX单药,ZOL与PTX联合用药对A-549凋亡率(±s)Table2 Apoptotic rate of ZOL alone,PTX alone,or combined treatment in A-549 cells (±s)

表2 ZOL、PTX单药,ZOL与PTX联合用药对A-549凋亡率(±s)Table2 Apoptotic rate of ZOL alone,PTX alone,or combined treatment in A-549 cells (±s)
Experimental group Control PTX (2 nM)ZOL(100 μM)ZOL and PTX together PTX then ZOL ZOL then PTX Apoptotic rate(%)5.80±0.36 7.30±0.44 12.23±0.60 33.13±0.55 37.97±0.60 31.60±0.70

表3 A-549细胞实验组中AKT基因mRNA表达量Table3 mRNA expression of AKT after different treatments for A-549 cells

表4 A-549细胞实验组中ERK基因mRNA表达量Table4 mRNA expression of ERK after different treatments for A-549 cells
2.6 Western blot检测各组细胞ERK、P-ERK、AKT、P-AKT、Bcl-2蛋白表达
Western blot结果示:空白组、ZOL组、PTX组、先PTX后ZOL组细胞ERK、AKT蛋白表达水平均无差异,但ERK和AKT磷酸化水平为空白组最高,ZOL组次之,再次为PTX组,先PTX后ZOL组最低(图1、2)。Bcl-2蛋白表达为空白组最高,ZOL组次之,再次为PTX组,先PTX后ZOL组最低(图3)。

图1 A-549细胞中AKT和P-AKT蛋白表达Figure1 AKT and P-AKT protein levels in A-549 cells
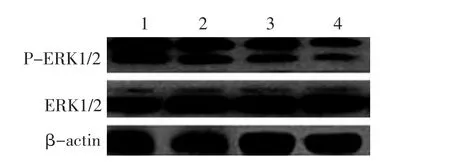
图2 A-549细胞中ERK和P-ERK蛋白表达Figure2 ERK and P-ERK protein levels in A-549 cells

图3 A-549细胞中Bcl-2蛋白表达Figure3 Bcl-2 protein level in A-549 cells
3 讨论
ZOL系第3代含氮杂环双膦酸盐,对多种实体瘤引起的骨转移均有效,与前2代双膦酸盐相比,具有起效更快、缓解率更高、缓解时间更长等特点[4]。当前药物临床前研究提示ZOL除了对骨吸收有抑制作用外,还有直接的体内外抗肿瘤作用[5],并且与数种细胞毒药物联合具有协同增效的作用[6-7]。为此本研究设计了ZOL与PTX体外协同抗肺腺癌细胞增殖及诱导凋亡的分子机制研究。
本实验MTT结果显示10~100 μM不同浓度ZOL及2 nM PTX对A-549均有抑制作用,ZOL抑制作用具有浓度依赖性。ZOL与PTX联合应用时抑制作用优于ZOL或PTX单药。两药联合使用时,抑制作用大小与给药顺序有关。由大到小对应组为:先PTX后ZOL>PTX+ZOL同时>先ZOL后PTX。
流式细胞仪检测凋亡发现,联合用药组凋亡率亦同PTX、ZOL给药顺序有关,说明ZOL与PTX联合应用抑制细胞生长作用机制之一为诱导细胞凋亡。
PI3K/AKT信号通路与细胞生长、凋亡密切相关[8]。细胞内促生存蛋白AKT的磷酸化(phosphorylated AKT,P-AKT)在癌细胞发生中起重要作用[9]。AKT活性形式的表达能阻止凋亡的发生,促进细胞增殖、侵袭转移[10]。AKT磷酸化激活后,对下游蛋白进行调节,最终抑制细胞凋亡,其抗凋亡作用可能与调节Bcl-2家族成员活性有关。Bcl-2家族成员分为凋亡抑制蛋白和促凋亡蛋白2类,Bcl-2、Bcl-xL等属于凋亡抑制蛋白,Bax、Bad等属于促凋亡蛋白。AKT的激活使Bad的Ser136/Ser112残基磷酸化,磷酸化的Bad与Bcl-2或Bcl-xL解聚,游离的Bcl-2发挥抗凋亡作用[11]。AKT作为蛋白激酶,磷酸化后才发挥生物活性,因此,P-AKT是代表此蛋白激酶活性的指标。
RAS/RAF/MEK/ERK信号通路的激活首先是RAS活化,活化的RAS与丝/苏氨酸蛋白激酶(RAF-1)结合,激活RAF-1,进而激活MEK,最终导致ERK1/2的激活。活化的ERK1/2可磷酸化其他胞浆蛋白或从胞浆转移至胞核促进多种核内转录因子磷酸化,如c-Jun、c-Fos和ELK-1等,从而调控基因表达,促进细胞增殖与分化[12]。
本实验RT-PCR结果显示:A-549细胞中ERK和AKT的mRNA表达均为空白组最高,ZOL组次之,再次为PTX组,先PTX后ZOL组最低。在本实验条件下,ZOL联合PTX可能通过下调RAF/MEK/ERK和PI3K/AKT信号通路中ERK和AKT基因mRNA的表达,从而抑制A-549细胞的生长增殖,并诱导其凋亡。
Western blot显示:各实验组ERK和AKT蛋白表达水平均无差异,但AKT和ERK磷酸化水平为空白组最高,ZOL组次之,再次为PTX组,先PTX后ZOL组最低。Bcl-2蛋白表达亦是如此。这进一步证实ZOL联合PTX可能通过抑制RAF/MEK/ERK信号通路中ERK磷酸化水平,降低ERK活性,进而抑制A-549细胞生长和增殖,同时也通过抑制PI3K/AKT信号通路中的AKT磷酸化水平,进一步降低Bcl-2水平,起到促凋亡作用。ERK和AKT是ZOL联合PTX抑制A-549细胞增殖并促进其凋亡的两个重要靶点。
综上所述,ZOL、PTX对A-549细胞均有抑制作用,且ZOL抑制作用随浓度的增加而增强。ZOL与PTX联合应用具有协同增效作用,该作用具有给药顺序依赖性,抑制率最大的给药顺序为先PTX后ZOL。根据分子水平实验结果,ZOL联合PTX可能通过下调RAF/MEK/ERK中ERK基因的mRNA表达,降低ERK磷酸化水平,抑制ERK激酶的活性,进而抑制A-549细胞生长增殖。此外,还可能通过下调PI3K/AKT中AKT基因的mRNA表达,降低AKT磷酸化水平,进而减弱AKT活性,进一步降低抗凋亡蛋白Bcl-2水平,起到促凋亡作用。本实验得出的结论仅限于细胞水平,尚需在动物模型上进一步研究。此外,研究显示ZOL还可抑制肿瘤细胞的黏附、侵袭及血管的生成[13],通过调节免疫系统间接的发挥抗肿瘤作用,其具体的作用机制尚需进一步的探讨。
1 Almubarak H,Jones A,Chaisuparat R,et al.Zoledronic acid directly suppresses cell proliferation and induces apoptosis in highly tumorigenic prostate and breast cancers[J].J Carcinog,2011,10:2.
2 Atmaca H,Gorumlu G,Karaca B,et al.Combined gossypol and zoledronic acid treatment results in synergistic induction of cell death and regulates angiogenic molecules in ovarian cancer cells[J].Eur Cytokine Netw,2009,20(3):121-130.
3 Neville-Webbe HL,Evans CA,Coleman RE,et al.Mechanisms of the synergistic interaction between the bisphosphonate zoledronic acid and the chemotherapy agent paclitaxel in breast cancer cells in vitro[J].Tumour Biol,2006,27(2):92-103.
4 Talreja DB.Importance of antiresorptive therapies for patients with bone metastases from solid tumors[J].Cancer Manag Res,2012,4:287-297.
5 Clézardin P.Antitumor properties of the bisphosphonate zoledronate and potential therapeutic implications in the clinic[J].Bull Cancer,2010,97(8):937-949.
6 Huang WL,Li XY,Wang HB,et al.Study of sequence-dependent in vitro effects of zoledronic acid and paclitaxel upon human nasopharyngeal carcinoma cell line HNE1[J].Zhonghua Yi Xue Za Zhi,2012,92(16):1133-1137.
7 Pandya KJ,Gajra A,Warsi GM,et al.Multicenter,randomized,phase 2 study of zoledronic acid in combination with docetaxel and carboplatin in patients with unresectable stageⅢB or stageⅣnon-small cell lung cancer[J].Lung Cancer,2010,67(3):330-338.
8 Garrett JT,Chakrabarty A,Arteaga CL.Will PI3K pathway inhibitors be effective as single agents in patients with cancer[J]?Oncotarget,2011,2(12):1314-1321.
9 Foster K,Wang Y,Zhou D,et al.Dependence on PI3K/Akt signaling for malignant rhabdoid tumor cell survival[J].Cancer Chemother Pharmacol,2009,63(5):783-791.
10 McAuliffe PF,Meric-Bernstam F,Mills GB,et al.Deciphering the role of PI3K/Akt/mTOR pathway in breast cancer biology and pathogenesis[J].Clin Breast Cancer,2010,10(Suppl3):S59-65.
11 Henshall DC,Araki T,Schindler CK,et al.Activation of Bcl-2-assosiated death protein and counter-response of Akt within cell populations during seizure-induced neuronal death[J].J Neurosci,2002,22(19):8458-8465.
12 Kim EK,Choi EJ.Pathological roles of MAPK signaling pathways in human disease[J].Biochim Biophys Acta,2010,1802(4):396-405.13 Denoyelle C,Hong L,Vannier JP,et al.New insights into the actions of bisphosphonate zoledronic acid in breast cancer cells by dual RhoA-dependent and-independent effects[J].Br J Cancer,2003,88(10):1631-1640.

