光子晶体编码液相芯片技术与肿瘤筛查*
杨子学 陈宝安 顾忠泽
恶性肿瘤已成为发展中国家的首位死因及发达国家的第二死因,早期筛查、早期诊断和早期治疗是提高治愈率的关键。肿瘤标志物检测是恶性肿瘤早期筛查的重要组成部分,尤其是多个肿瘤标志物的联合检测可提高诊断率。然而,目前临床上此类检测大多采用单指标方法,若应用于肿瘤筛查,不仅成本高,且费时费力,不易推广[1]。
液相芯片技术是20世纪末发展起来的一种多元分析技术,具有高通量、高灵敏度、高特异性等优点,有望成为新一代的肿瘤筛查方法[2]。液相芯片由编码微球、探针分子、目标分子和报告分子四部分组成。商用的编码微球主要通过荧光进行编码,但该编码方式存在荧光易淬灭而导致的编码丢失或误编码等问题。2002年Cunin等[3]开发了多孔硅光子晶体薄膜编码载体;2006年Zhao等[4-5]制备出了自组装光子晶体微球。这些研究工作使光子晶体成为一种新的编码方式。该编码方式不仅解决了液相芯片中载体编码的稳定性问题,而且由于其荧光背景低,提升了检测灵敏度。光子晶体编码液相芯片已逐渐在肿瘤标志物分析中崭露头角。
1 基于光子晶体编码微球的液相芯片技术
液相芯片的四个组成部分中,编码微球是核心技术。目前常见的编码方式有光学编码、图形编码、物理编码、化学编码等[6]。其中光学编码最受关注,包含荧光编码、量子点编码、光子晶体编码等。本文介绍的光子晶体是一种由单分散纳米粒子自组装所形成的具有周期结构的材料。这类材料的光学反射特性可以通过纳米结构进行调制[7]。光子晶体编码可以通过两种方式进行解码,分别是依靠裸眼的颜色识别以及利用光谱仪的反射峰检测。前者不需仪器即可进行多元分析,简单方便,而后者则可实现高通量检测。
探针分子在微球表面的连接数量及稳定性直接关系到检测方法的灵敏度与重复性。光子晶体微球表面连接探针分子的方法包括硅烷偶联法(GPTMS法、APTES-戊二醛法)和碳二亚胺缩合法,这些方法具有稳定性好,对探针分子活性影响小等优点[8-12]。
1.1 蛋白肿瘤标志物分析
血清肿瘤标志物的检测是目前最常用的肿瘤筛查方法,临床多采用数种标志物联合检测的策略以提高检出率。甲胎蛋白(AFP)、癌胚抗原(CEA)以及多种糖类抗原都是我国高发恶性肿瘤的血清标志物,其检测方法的确立也是光子晶体编码液相芯片的研究重点。
1.1.1 基于二氧化硅胶体晶体微球的标记检测 二氧化硅胶体晶体微球(Silica Colloidal Crystal Beads,SCCBs)是一种由单分散二氧化硅纳米粒子自组装而成的光子晶体微球(图1)。目前,SCCBs主要采用玻璃微流体芯片进行制作,该方法快速便捷,产量大,得到的微球尺寸均一,有益于提高检测的重复性[13]。扫描电镜(SEM)图片显示,微球的表面粗糙,故其比表面积比同尺寸的普通微球大,有利于提高检测灵敏度[14]。目前,十数种特征峰位置均匀分布于可见光区的光子晶体微球已经可以被制备,而且在保证良好球形度的前提下,微球的直径可以控制在约40~300 μm(图2)。实验中采用的微球直径通常在180~250 μm。

图1 A.SCCBs的SEM图片;B.SCCBs表面细节的放大SEM图片Table1 A.The SEM image of SCCBs;B.The enlarged image of surface details of SCCBs
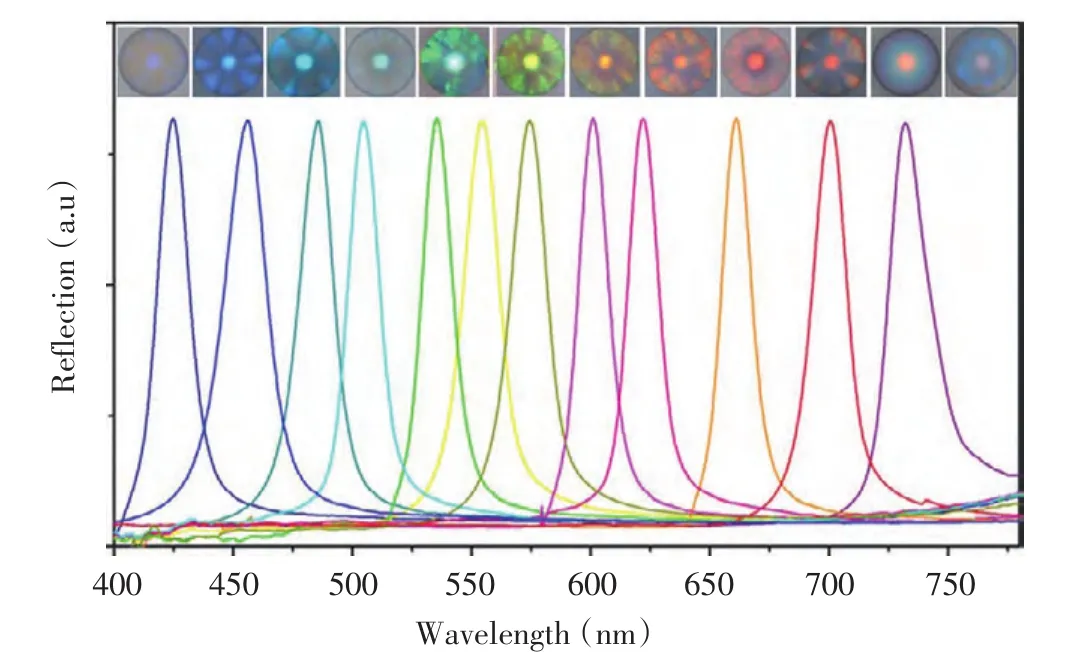
图2 SCCBs的光镜照片和特征性反射峰[15]Table2 Light micrograph of the SCCBs and distinct reflection peak
标记检测是一种常规检测方法,它利用不同的报告分子产生差异性检测信号,实现定量分析目标分子的目的。基于SCCBs的标记检测主要采用荧光染料和酶辣根过氧化物酶(HRP)作为标记物[8,11-12];前者操作简便,使用的仪器也比较简单,但荧光易猝灭,需要避光操作;后者是化学发光方法的催化剂,可获得比荧光方法更高的灵敏度,但对检测仪器的要求较高。
采用基于SCCBs的荧光分析方法,AFP和CEA的检测灵敏度可分别达到0.68 ng/mL和0.95 ng/mL[8]。然而,随着荧光染料的更新换代,其强度及稳定性都不断提高,荧光分析法的检测灵敏度也将会进一步提升。
Pei等[11]建立了基于SCCBs的化学发光分析方法,相比于荧光分析方法,该方法具有更高的灵敏度,AFP和CEA的检测限可分别达到0.16 ng/mL和0.12 ng/mL,同时完成了25例临床血清样本的检测,将所得结果与电化学发光参考方法的结果进行了比较。数据显示两种方法的结果没有明显差异,验证了基于SCCBs化学发光分析方法的准确性。
1.1.2 基于硅水凝胶复合材料光子晶体微球的标记检测 SCCBs可以通过微流控技术量产,是产业化光子晶体编码液相芯片的首选载体。但在高灵敏度蛋白检测中,随着反应时间的延长,SCCBs的孔隙结构使得非特异性吸附明显增多,需要增加洗涤强度和时间以去除,使实验过程繁琐。Yang等[9]采用聚乙二醇双丙烯酸酯(PEG-DA)水凝胶填充SCCBs孔隙结构的方法降低非特异性吸附,同时引入羧基功能基团连接蛋白抗体,缩短了微球前处理时间,并避免了接触芳香族试剂,明显提高了实验的可操作性,同时检测灵敏度也能够满足AFP和CEA的检测要求。
1.1.3 基于反蛋白石结构光子晶体微球的非标记检测 反蛋白石结构光子晶体微球是以SCCBs为模版,在二氧化硅纳米粒子间隙填充高折射率的水凝胶材料后,除去模版所得到的光子晶体微球,结构如图3所示[7]。光子晶体微球的特征性反射峰位置与其微球体系内部物质的平均折射率相关,当其内部成分发生改变时,特征性反射峰位置也随之变化。利用这一特性可实现基于反蛋白石结构光子晶体微球的非标记检测。Zhao等[16]将生物分子分散在水凝胶中,填充SCCBs后将模版去除,留下特殊结构的空隙(图4)。这些空隙只接受相同或具有类似空间结构的生物分子进入,使微球的反射峰发生红移,根据波峰的移动量即可确定目标分子的含量(图5)。这种分子印迹方法在肿瘤标志物多元检测中具有稳定性好、载体易于保存的优点。

图3 A.反蛋白石结构水凝胶光子晶体微球的SEM照片;B.反蛋白石结构水凝胶光子晶体微球表面细节的放大SEM照片[17]Table3 A.SEM micrograph of the inverse opal structure photonic crystal microspheres in hydrogel;B.Magnified image of the surface details of the inverse opal structure photonic crystal microspheres in hydrogel
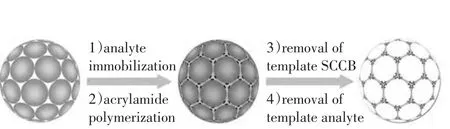
图4 可用于非标记分析的反蛋白石结构水凝胶微球的制作方法[16]Table4 Preparation of inverse opal structure photonic crystal microspheres in hydrogel used in the unlabeled analysis

图5 随着目标物浓度的增大,水凝胶微球的反射峰逐渐红移[16]Table5 Gradual red shifting of the reflection peak of hydrogel microspheres with increasing target object concentrations
除分子印迹法外,在水凝胶微球内部连接抗体以捕捉目标分子,也可改变平均折射率和反射峰位置,从而实现非标记检测。Zhao等[17]利用这一方法实现了CA-199和CA-125两种糖类抗原的多元分析,CA-199的最低检出限为50 U/mL。
1.2 基因肿瘤标志物的检测
随着基因组学的发展,越来越多的肿瘤相关基因标志物被发现和应用。基于光子晶体编码微球的液相芯片技术不仅可用于蛋白质标志物多元分析,也可用于基因标志物的多元分析。
1.2.1 基于SCCBs的标记检测 肿瘤耐药性的产生是导致化疗失败的主要原因之一,多药耐药基因1(MDR1)和多药耐药相关蛋白1(MRP1)是与肿瘤多药耐药性的产生密切相关的两个基因。Yang等[10]筛选确定了这两个基因的特征性扩增片段。这两个片段具有相同的扩增条件,可以在同一个反应体系中完成PCR扩增,有利于同时分析两个基因的表达情况。经过扩增的反应液通过基于SCCBs的双探针杂交实验可明确扩增前的片段浓度。同时,K562和K562/A02细胞株的分析以及与荧光定量PCR方法的比对被用于验证该检测方法的可行性及准确性。结果显示,耐药株细胞的MDR1的表达高于非耐药株大约1 000倍,且两种方法的结果较为一致。
1.2.2 基于反蛋白石结构光子晶体微球的标记检测 相比于SCCBs,反蛋白石结构水凝胶光子晶体微球具有更大的比表面积和更加疏松的内部结构,有利于提高检测灵敏度,去除非特异性吸附(图3)。Zhao等[20]以反蛋白石结构水凝胶光子晶体微球为载体,进行DNA片段的标记检测。片段不经扩增,检测限可以达到IE-12 M。然而,该方法在实际操作中不能独立存在,须依赖于PCR扩增技术。
2 光子晶体编码技术的改进
为了方便检测,光子晶体的特征性反射峰一般落在可见光区域(350~770 nm)。所以在保证分辨率的情况下,编码数量会受到限制,只能实现中低通量的生物分子检测。如果要开展高通量的生物分子筛查,必须与其他的编码方式结合,构建联合编码,其中一种策略是将光子晶体编码和量子点编码进行结合[21]。联合编码可极大地增加编码数量,实现更高通量筛查。
3 展望
光子晶体编码微球为液相芯片技术提供了稳定的编码,简易的解码方式,为肿瘤筛查提供了灵活多变的多元分析技术,在肿瘤预防诊断工作中具有广阔的应用前景。作为一种新兴检测技术,提高检测的重复性,简化及规范化实验流程,是光子晶体编码液相芯片亟待解决的问题。同时,针对一个具体问题,系统开展光子晶体编码液相芯片的研制、应用和验证工作,将有助于进一步加快研究进程,推动这一新技术的临床转化。
1 Siegel R,Naishadham D,Jemal A.Cancer statistics,2012[J].CA Cancer J Clin,2012,62(1):10-29.
2 Nolan JP,Sklar LA.Suspension array technology:evolution of the flat-array paradigm[J].Trends Biotechnol,2002,20(1):9-12.
3 Cunin F,Schmedake TA,Link JR,et al.Biomolecular screening with encoded porous-silicon photonic crystals[J].Nat Mater,2002,1(1):39-41.
4 Zhao XW,Cao Y,Ito F,et al.Colloidal crystal beads as supports for biomolecular screening[J].Angew Chem Int Edit,2006,45(41):6835-6838.
5 Zhao XW,Liu ZB,Yang H,et al.Uniformly colorized beads for multiplex immunoassay[J].Chem Mater,2006,18(9):2443-2449.
6 Wilson R,Cossins AR,Spiller DG.Encoded microcarriers for high-throughput multiplexed detection[J].Angew Chem Int Edit,2006,45(37):6104-6117.
7 Wang ZL,Lin J.Opal and inverse opal structure photonic crystal[J].Chin J Chem,2004,12:876-882.[王振领,林 君.蛋白石及反蛋白石结构光子晶体[J].化学通报,2004,12:876-882.]
8 Zhao YJ,Zhao XW,Pei XP,et al.Multiplex detection of tumor markers with photonic suspension array[J].Anal Chim Acta,2009,633(1):103-108.
9 Yang ZX,Chen BA,Wang H,et al.Handy,rapid and multiplex detection of tumor markers based on encoded silica-hydrogel hybrid beads array chip[J].Biosens Bioelectron,2013,48:153-157.
10 Yang ZX,Chen BA,Pei XP,et al.Multiplex analysis of tumor multidrug-resistance genes expression with photonic suspension array[J].Analyst,2012,137(14):3343-3348.
11 Pei XP,Chen BA,Li L,et al.Multiplex tumor marker detection with new chemiluminescent immunoassay based on silica colloidal crystal beads[J].Analyst,2010,135(1):177-181.
12 Lu WB,Fu C,Chen Y,et al.Multiplex detection of B-Type Natriuretic peptide,cardiac troponin I and C-reactive protein with photonic suspension array[J].PLoS One,2012,7(7).
13 Zhao YJ,Gu HC,Xie ZY,et al.Bioinspired Multifunctional Janus Particles for Droplet Manipulation[J].J Am Chem Soc,2013,135(1):54-57.
14 Zhao YJ,Zhao XW,Sun C,et al.Encoded silica colloidal crystal beads as supports for potential multiplex immunoassay[J].Anal Chem,2008,80(5):1598-1605.
15 Zhao XW,Zhao YJ,Gu ZZ.Advances of multiplex and high throughput biomolecular detection technologies based on encoding microparticles[J].Sci China Chem,2011,54(8):1185-1201.
16 Zhao YJ,Zhao XW,Hu J,et al.Multiplex Label-Free Detection of Biomolecules with an Imprinted Suspension Array[J].Angew Chem Int Edit,2009,48(40):7350-7352.
17 Zhao YJ,Zhao XW,Hu J,et al.Encoded Porous Beads for Label-Free Multiplex Detection of Tumor Markers[J].Adv Mater,2009,21(5):569-572.
18 Seal S,Thompson D,Renwick A,et al.Truncating mutations in the Fanconi anemia J gene BRIP1 are low-penetrance breast cancer susceptibility alleles[J].Nat Genet,2006,38(11):1239-1241.
19 Kmietowicz Z.Preventive surgery can cut risk of breast cancer by 90%[J].Brit Med J,2002,325(7367):735-735.
20 Zhao YJ,Zhao XW,Tang BC,et al.Rapid and Sensitive Biomolecular Screening with Encoded Macroporous Hydrogel Photonic Beads[J].Langmuir,2010,26(9):6111-6114.
21 Li J,Zhao XW,Zhao YJ,et al.Quantum-dot-coated encoded silica colloidal crystals beads for multiplex coding[J].Chem Commun,2009(17):2329-2331.

