荧光上转换纳米材料在光动力学治疗癌症中的应用*
郑晓鹏 田 甘 谷战军
1 引言
光动力治疗癌症是现代癌症治疗的一种重要手段,具有微创性、不良反应小、靶向性高等优点[1-4]。光动力学治疗中将光敏剂,一类本身稳定无毒性,但可以在特定波长光束照射下生成强氧化性物质单线态氧的有机分子,预先注入机体,由于肿瘤组织高吸收、低代谢,经一段时间特异性沉积在肿瘤组织。再以特定波长的光辐射激活药物,产生单线态氧和自由基等杀死肿瘤细胞,达到治疗目的。光动力学疗法机理示意图如图1所示[5-6]。
然而,目前光动力治疗癌症仍然存在一些不足,主要包括以下几个方面:
1)目前常用的光敏剂主要是卟啉衍生物,这些分子对肿瘤组织缺乏靶向性,在病灶难以富集达到有效浓度,影响治疗效果。2)光敏剂分子多为疏水性分子,易团聚,在体内不易传输到病灶。3)理论上光动力疗法适用于所有肿瘤的治疗,但目前主要用于体表恶性肿瘤、食管癌、胃肠道肿瘤、口腔肿瘤、膀胱癌等的治疗。这主要因为是光敏剂需要吸收可见光,而可见光在人体组织的穿透能力较差,治疗不能深入到组织内部,多局限于表皮或浅组织区域的肿瘤部位。
以上这些缺点极大地限制了癌症光动力治疗的临床应用,而纳米技术的飞速发展为解决上述难题提供了新思路。近年来,越来越多的研究表明利用荧光上转换纳米材料最有可能解决上述难题。采用荧光上转换纳米粒子作为光敏剂载体进行癌症光动力治疗具有以下优势:1)由于实体瘤的高通透性和滞留效应(enhanced permeability and retention effect,EPR),上转换纳米粒子可以在肿瘤部位富集,并且可以在上转换纳米粒子表面修饰靶向分子,从而从被动靶向效应和主动靶向效应两个方面克服传统光动力学治疗靶向性不强的问题。2)经过表面修饰,可以得到亲水性的上转换纳米粒子。因而上转换纳米粒子可以作为载体负载疏水性的光敏剂分子,解决光敏剂易团聚及难以输运的问题。3)近红外光(波长通常在700~1 000 nm的范围)穿透深度比可见光的穿透深度大一个数量级,而且对正常组织和细胞具有较低的光毒性,因此是理想的光动力学治疗的光源。荧光上转换纳米粒子可以被近红外光激光激发(980 nm),然后转换为可见光,再由可见光激发其负载的光敏剂,近红外光在体内的穿透能力强,可以克服光动力治疗难以深入组织内部的难题。4)通过改变掺杂稀土离子,荧光上转换纳米粒子的发光从紫光到近红外都可调控(如Yb,Er:650 nm,550 nm;Yb,Tm:365,480,800 nm),这样可以匹配不同吸收波长的光敏剂,充分利用现有光敏剂资源。5)近红外连续激光器小巧紧凑,能量高,价格便宜,为这种荧光上转换纳米粒子的在光动力治疗实际应用提供了良好条件。由此可见,将以荧光上转换纳米粒子为基础的复合多功能光敏纳米粒子引入光动力疗法,最有可能克服目前制约光动力治疗的诸多难题,推动光动力治疗癌症的发展。
2 上转换纳米材料在癌症光动力学治疗中的应用
Zhang等[7]第一次阐述了利用荧光上转换纳米粒子在癌症光动力学治疗中应用的机理。他们制备了掺有光敏剂Merocyanine-540(M-540)的二氧化硅薄层包覆的上转换纳米材料(NaYF4:Yb/Er@SiO2),然后用靶向癌细胞的抗体修饰,再与膀胱癌细胞共孵育来衡量其光动力学治疗的效果。但是,因为致密的二氧化硅阻碍了周围氧分子的进入,从而减少了与光敏剂作用的氧分子的量,并且致密的二氧化硅也阻碍了生成的活性氧的扩散,所以致密二氧化硅层包覆的上转换纳米材料体系(NaYF4:Yb/Er@SiO2)的光动力学治疗的效率较低[8-9]。为了克服以上缺点,有研究运用介孔二氧化硅包覆的上转换纳米材料负载光敏剂酞菁锌(zinc phthalocyanine,ZnPc)[10-11]。他们发现装载在介孔硅中的光敏剂ZnPC不仅不会从介孔二氧化硅中游离出来,并且能够不断的与上转换纳米材料发出光发生相互作用产生单线态氧,因此提高了对癌症细胞的杀伤效果;为了增加光敏剂在纳米载体上的稳定性,有学者利用共价接枝的方法把孟加拉红(Rose Bengal,RB)光敏剂分子修饰到上转换纳米材料上,并且在材料上修饰了叶酸靶向分子[12]。细胞实验表明,叶酸受体阳性的细胞活性明显降低,而叶酸受体阴性的细胞没有明显的变化。共价接枝的方法可以增加光敏剂的装载量,并且减小了光敏剂分子与上转换纳米材料之间的距离,有利于上转换纳米材料与光敏剂之间的能量转移,从而从“质与量”上增加了光敏剂与上转换纳米材料之间的相互作用,提高活性氧产生的量。
目前和光敏剂结合应用于光动力治疗领域的稀土掺杂氟化物(NaYF4:Yb/Er)上转换材料均为绿光发射峰占主导,而现在商用的第二代高效光敏剂的有效吸收峰大多分布在红光区(650~670 nm),光谱上的不吻合大大降低了体系的能量共振转移效率,进而影响单线态氧生成的能力。因此,为达到高效的光动力治疗效果,制备红光发射占主导的上转换材料是目前这类材料面临应用的瓶颈,也是制备新材料面临的挑战。本课题组采用一种巧妙的掺杂路线,将二价锰离子(Mn2+)引入至NaYF4:Yb/Er体系中,Mn2+的掺入大大提升了红光产生的几率,随着Mn2+掺杂量的增加,能够得到发射单色红光的上转换纳米材料。此外,Mn2+的掺入能够同时影响NaYF4:Yb/Er上转换纳米晶的尺寸和相态,得到尺寸在20 nm左右的红光上转换纳米晶材料。本课题组以红光上转换纳米颗粒为载体,通过物理吸附将三种常用的第二代光敏剂分子,酞菁锌(ZnPc)、二氢卟吩(Ce6)以及亚甲基蓝(MB)分别进行负载,得到多种负载有光敏剂的上转换纳米材料复合物。在980 nm近红外光的照射下,这些复合物能有效地产生单线态氧并杀死癌细胞。此外,在癌症的治疗中,药物协同治疗是很重要的一种提高疗效降低副作用的方法。我们首次将化疗药物阿霉素(DOX)和光敏剂(Ce6)共同负载于荧光上转换纳米颗粒上用于对癌细胞的杀伤,结果表明药物共运输体系的癌细胞杀伤效果明显提高,协同效应显著,为光动力治疗癌症提供了新思路(图2)[13-15]。此外,本课题也制备了发射蓝光的上转换纳米材料(Tween20-NaGdF4@NaYbF4),并与竹红菌素相结合,作为新型纳米复合光敏剂。在此之前,蓝光激发的光敏剂受到蓝光穿透性不强的限制阻碍了其临床治疗肿瘤的应用也发展了蓝光上转换纳米材料用来拓展蓝光激发光敏剂在癌症光动力学治疗中的应用。用Tween 20来修饰上转换纳米材料不仅可以使上转换纳米材料具有更好的水溶性,而且可以通过疏水相互作用来装载疏水的光敏剂以及其他药物。装载有竹红菌素的Tween 20-NaGdF4@NaYbF4不仅具有良好的光动力学治疗的效果,而且具有良好的磁共振成像(MRI)及计算机层析成像(CT)的性能[16]。
Liu等[17]发展了第一个应用于小鼠活体实验的上转换纳米材料基的光动力学治疗体系,通过非共价修饰的方法把Ce6装载到聚乙二醇修饰的上转换纳米材料上,形成光动力学治疗纳米复合物。动物实验中,UCNPs-Ce6复合物注射到接种有乳腺癌的小鼠体内,结果发现70%的肿瘤被完全消融,2个月内未重新生长。与对照组小鼠相比,经过UCNPs-Ce6光动力学治疗的小鼠的存活时间显著延长。在体外与体内实验中,都证明了近红外光可以到达更深的组织。为了增加光动力学治疗的效果,Idris等[11]制备了与两种不同光敏剂吸收波长相匹配的上转换纳米材料,从而实现利用单一波长光源同时激发两种光敏剂(图3)。通过两个光敏剂的组合(相对于以前的单一光敏剂的方法)来增加光动力治疗的效果,而不需要复杂的多波长激发。其使用了发射绿光和红光的上转换纳米粒子,在980 nm激光光源的激发下,同时激发两种光敏剂MC540和ZnPC增强PDT的效果。为了提高药物靶向能力,将具有靶向作用的叶酸(FA)连接到聚乙二醇(PEG)修饰的上转换纳米颗粒(FA-PEG-UCNPs),通过尾静脉注射,这些具有特异性识别能力的粒子能够到达病灶,进行靶向性光动力治疗。细胞实验表明,与负载单一的光敏剂相比,装载两种光敏剂的上转换纳米颗粒可以产生更多的单线态氧,具有更高的癌细胞杀伤的效率。活体实验表明,不管是肿瘤原位给药还是静脉注射,FA-PEG-UCNPs对接种有黑色素瘤的小鼠的肿瘤均有很大的抑制。Hyeon等[18]制备了Ce6和PEG修饰的上转换纳米材料作为诊疗一体化的体系。在这个多功能的材料体系中,多模式成像为疾病的诊断提供了基础,光动力学治疗为高效的治疗疾病提供了保障。
3 展望
上转换纳米材料的出现为深层肿瘤的光动力学治疗提供了可能。利用荧光上转换纳米材料作为光敏剂的载体可以有效提升光动力治疗的穿透深度,改善光敏剂的靶向性及调控单线态氧的释放。通过调节掺杂元素及改变上转换纳米材料的结构,来调节上转换纳米材料的发光光谱与光敏剂的吸收相匹配,从而激发一种甚至多种光敏剂。此外,光动力学治疗还可以与癌症的其它治疗方法结合,达到了光动力学治疗与其它疗法互补协同治疗的效果,有重要的应用前景。


图2 基于红色荧光上转换纳米粒子光动力学治疗癌症的研究Figure2 Red-emitting UCNPs-based PDT study
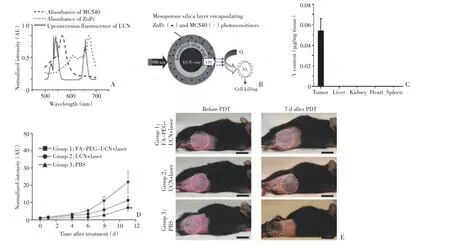
图3 叶酸修饰的介孔二氧化硅包覆的上转换纳米粒子(FA-PEG UCNs)活体光动力学靶向治疗皮下瘤小鼠模型Figure3 Targetedin vivoPDT of a subcutaneous tumor model injected with FA-PEG-UCNPs
1 Wilson BC,Patterson MS.The physics,biophysics and technology of photodynamic therapy[J].Phys Med Biol,2008,53(9):R61.
2 Lovell JF,Liu TWB,Chen J,et al.Activatable photosensitizers for imaging and therapy[J].Chem Rev,2010,110(5):2839-2857.
3 Castano AP,Mroz P,Hamblin MR.Photodynamic therapy and anti-tumour immunity[J].Nat Rev Cancer,2006,6(7):535-545.
4 Dolmans DE,Fukumura D,Jain RK.Photodynamic therapy for cancer[J].Nat Rev Cancer,2003,3(5):380-387.
5 Shibu ES,Hamada M,Murase N,et al.Nanomaterials formulations for photothermal and photodynamic therapy of cancer[J].J Photochem Photobiol C:Photochem Rev,2013,15(9):53-72.
6 Wang Y,Liu K,Liu X,et al.Critical shell thickness of core/shell upconversion luminescence nanoplatform for FRET application[J].J Physi Chem Lett,2011,2(17):2083-2088.
7 Zhang P,Steelant W,Kumar M,et al.Versatile photosensitizers for photodynamic therapy at infrared excitation[J].J Am Chem Soc,2007,129(15):4526-4527.
8 Guo Y,Kumar M,Zhang P.Nanoparticle-based photosensitizers under CW infrared excitation[J].Chem Materials,2007,19(25):6071-6072.
9 Chen F,Zhang S,Bu W,et al.A uniform sub-50 nm-sized magnetic/upconversion fluorescent bimodal imaging agent capable of generating singlet oxygen by using a 980 nm laser[J].Chem-A Euro J,2012,18(23):7082-7090.
10 Qian HS,Guo HC,Ho PCL,et al.Mesoporous-Silica-coated up-conversion fluorescent nanoparticles for photodynamic therapy[J].Small,2009,5(20):2285-2290.
11 Idris NM,Gnanasammandhan MK,Zhang J,et al.In vivophotodynamic therapy using upconversion nanoparticles as remote-controlled nanotransducers[J].Nat Medi,2012,18(10):1580-1585.
12 Liu K,Liu X,Zeng Q,et al.Covalently assembled NIR nanoplatform for simultaneous fluorescence imaging and photodynamic therapy of cancer cells[J].ACS Nano,2012,6(5):4054-4062.
13 Tian G,Gu Z,Zhou L,et al.Mn2+dopant-controlled synthesis of NaYF4:Yb/Er upconversion nanoparticles forin vivoimaging and drug delivery[J].Adv Materials,2012,24(9):1226-1231.
14 Tian G,Ren W,Yan L,et al.Red-emitting upconverting nanoparticles for photodynamic therapy in cancer cells under near-infrared excitation[J].Small,2013,9(11):1929-1938
15 Gu Z,Yan L,Tian G,et al.Recent advances in design and fabrication of upconversion nanoparticles and their safe theranostic applications[J].Adv Materials,2013,25(28):3758-3779.
16 Jin S,Zhou L,Gu Z,et al.A new near infrared photosensitizing nanoplatform containing blue-emitting up-conversion nanoparticles and hypocrellin for photodynamic therapy of cancer cell[J].Nanoscale,2013,5(23):11910-11918.
17 Wang C,Tao H,Cheng L,et al.Near-infrared light induced in vivophotodynamictherapyofcancerbased on upconversion nanoparticles[J].Biomaterials,2011,32(26):6145-6154.
18 Park YI,Kim HM,Kim JH,et al.Theranostic probe based on lanthanide-doped nanoparticles for simultaneousin vivodual-modal imaging and photodynamic therapy[J].Adv Materials,2012,24(42):5755-5761.

