基于金纳米结构材料的肿瘤诊疗一体化研究进展*
寇 玉 王 静 陈春英
癌症是危害人类健康的重大疾病。传统的癌症化疗方法缺乏针对肿瘤的靶向性,故有很大的副作用。由于其独特的理化性质,纳米材料有可能解决目前癌症治疗面临的一些问题[1-2]。纳米载药体系不仅可利用增强的渗透和滞留(enhanced permeability and retention,EPR)效应实现被动靶向,还能通过修饰靶向分子实现主动靶向,从而提高纳米药物在肿瘤组织的富集。此外,纳米载药系统的独特优势还在于其能将多种功能(包括各种诊断和治疗方法)整合到一个体系中,实现诊疗一体化及成像介导的治疗[3]。
近年来,金纳米材料表现出令人瞩目的性质和优势[4]。由于其良好的生物相容性以及在可见或近红外光区可调的表面等离子体共振(surface plasmon resonance,SPR)性质,金纳米粒不仅可用于生物成像,还可通过光热效应在激光照射时成为局域化热源。产生的热量一方面可用于癌症热疗,另一方面当纳米粒载带药物时,可触发药物释放,实现化疗。因此,金纳米粒子有可能在一个载体中同时实现成像、化疗和热疗一体化。本文介绍了金纳米粒用于肿瘤诊疗一体化的研究进展。
1 金纳米材料用作肿瘤诊疗一体化的药物载体
由于SPR性质,金纳米材料显示出独特的尺寸和形状依赖的光学和光热性质。通过近红外激光激发金纳米材料的SPR效应,光子-电子和电子-电子之间相互作用产热,可以用于光热治疗、促进药物释放和光声造影等。利用金纳米材料对近红外光的散射,可进行暗场成像和光学相干断层扫描。此外,金纳米材料还能进行非线性的光学成像,比如双光子成像。文献中已经报道了很多尺寸和形貌可控的金纳米材料,特别是金纳米壳(Gold Nanoshells,AuNSs)、金纳米棒(Gold nanorods,AuNRs)、中空金纳米球(Hollow Gold Nanospheres,HAuNSs)、金纳米笼(Gold Nanocages,AuNCs)和 金 纳 米 星(Gold Nanostars)(图1),它们的SPR吸收峰从可见区到近红外区可以任意调控,在肿瘤诊疗一体化中显示出很好的应用前景[6-7]。

图1 典型金纳米材料的透射电子显微镜图片Figure1 Transmission electron microscopy images of typical gold nanomaterials
1.1 金纳米壳
以二氧化硅为内核表面覆有金壳的AuNSs,是首先用于光热治疗的金纳米粒子,目前已经进入到头颈肿瘤治疗的一期临床试验阶段[8]。Barhoumi等[9]将荧光标记的双链DNA通过Au-S键连接到AuNSs表面,在近红外光照射下,DNA双链中的一条单链释放,并进入细胞核,结合到细胞内源性DNA上,为光控的基因治疗提供了参考。
Liu等[10]制备了中空介孔结构的夹心二氧化硅为内核的AuNSs,其中空介孔结构包载多西紫杉醇的载药率达52%。这种新型的复合纳米结构在体外和体内实验中都表现出热疗和化疗的协同效应。中空介孔结构还可包载荧光染料-罗丹明B,用于观察材料在细胞内的定位。可见,这种诊疗载体可以同时在肿瘤细胞中实现成像、热疗和化疗。Liu等[11]还在金纳米壳表面修饰了靶向分子-转铁蛋白,并在小鼠乳腺癌模型中实现了肿瘤的完全消退,该复合纳米结构主要通过粪便和尿液从小鼠体内清除。
1.2 金纳米棒
AuNRs具有横向和纵向两个SPR吸收峰,其中纵向SPR峰的位置取决于其长轴与短轴之比(长径比),因此制备不同长径比的金纳米棒,可以得到从可见光区到近红外区可调的纵向SPR吸收峰。文献已有很多关于金纳米棒用于诊断检测、基因/药物运输以及肿瘤治疗方面的报道[3,12-15]。
Xiao等[13]在AuNRs表面修饰了DNA双链结构,并利用其CG碱基序列载带了抗肿瘤药物阿霉素(Doxorubicin,Dox)。应用人口腔表皮样癌肿瘤动物模型,瘤内注射结果表明,这种多功能的诊疗载体在近红外激光照射下能有效抑制肿瘤生长,肿瘤相对体积在热化疗作用下(1.82+0.25)比空白组(5.21+0.42)减少了65%。
Ren等[14]在AuNRs表面修饰了一端是11-巯基十一酸的聚乙二醇,利用其疏水部分载带疏水性的抗肿瘤药物-紫杉醇(paclitaxel,PTX)。AuNR-PTX复合物在体外实验中,通过热疗和化疗作用对头颈癌细胞和肺癌细胞都显示出了高效的杀伤作用。
由于金纳米棒自身的表面积较小,载带的药物有限,我们课题组[3]制备了金纳米棒核/介孔二氧化硅壳的杂化纳米结构(mesoporous silica-coated gold nanorods,Au@SiO2),并利用介孔二氧化硅的高比表面积实现了化疗药物阿霉素的高效载带。通过双光子成像技术可明确Au@SiO2在细胞内的定位。通过近红外激光照射,Au@SiO2包载阿霉素实现了两种癌症治疗模式:低功率激光诱导阿霉素释放而产生化疗模式,高功率激光通过光热效应而直接实现的化疗和热疗双重模式,可通过改变激光功率而远程精确调控这两种治疗模式。新型Au@SiO2载体不仅保留了介孔二氧化硅纳米粒子和金纳米棒各自的独特性能,而且还创生出了激光控制药物释放这个新功能(图2)。最近,Shen等[15]进行了Au@SiO2载带Dox后的体内研究,结果表明在近红外激光照射下,Au@SiO2-Dox产生了热疗和化疗的协同作用,热化疗联用对小鼠肿瘤的抑制率明显高于单独的热疗或者化疗。
1.3 中空金纳米球
HAuNSs也可以作为多功能的肿瘤诊疗一体化载体。与AuNSs(直径>120 nm)相比,更小尺寸的HAuNSs(直径≈40 nm)能更多地从肿瘤血管中渗出进入到肿瘤组织,更容易被肿瘤细胞摄取[16]。
Li课题组在HAuNSs用于肿瘤成像及靶向治疗方面做了一系列工作[16-19]。Melancon等[17]制备了表皮生长因子受体的抗体修饰的HAuNSs,以poly(L-glutamic acid)-Gd-NIR813作为模式药物,结合磁共振成像、超声和光学成像的方法研究了热疗对肿瘤血管渗透性及药物摄取的影响。结果表明激光介导的基于金纳米材料的热疗能同时提高血管渗透性,进而提高药物在肿瘤的积累。You等[18]在HAuNSs表面修饰了一种环状靶向肽并包载了Dox(T-DOX@HAuNS),体外和体内实验都证实了载体的靶向效果,在治疗实验中T-DOX@HAuNS+激光组的8只小鼠中有6只小鼠的肿瘤完全消失。
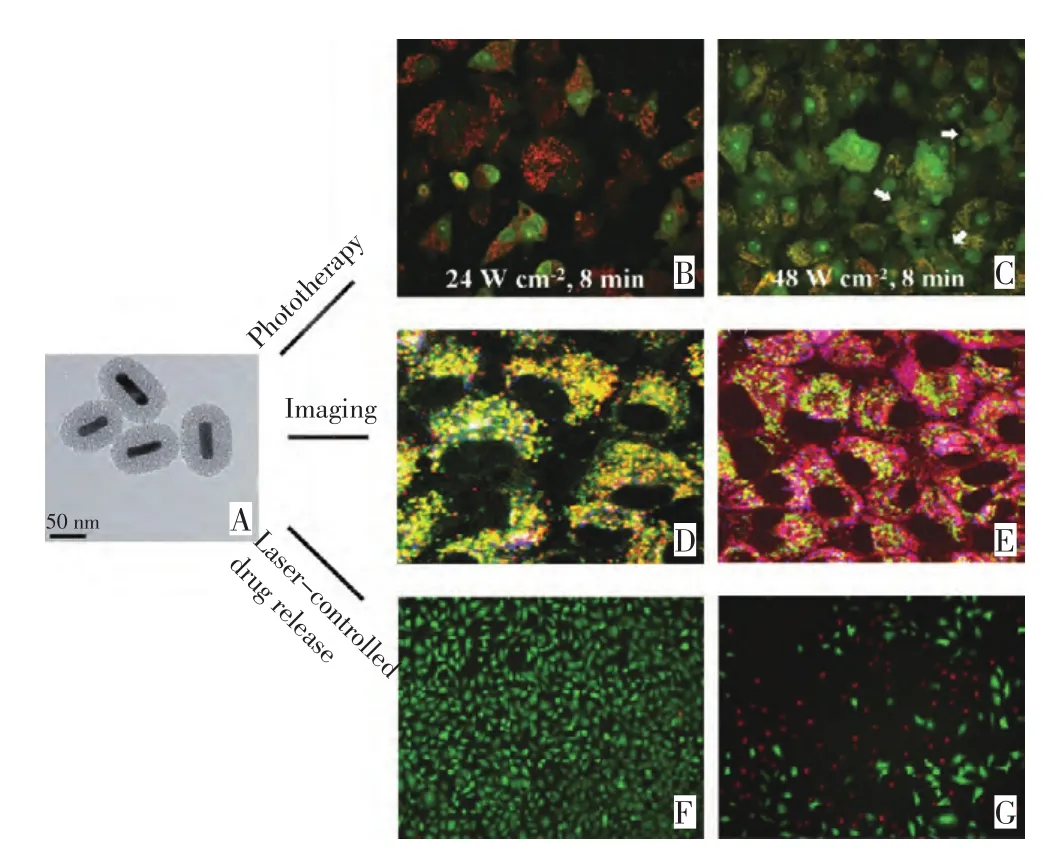
图2 金纳米棒的透射电镜图Figure2 Transmission electron microscopy image of gold nanorods and their application in cancer theranostics
1.4 金纳米笼
AuNCs是一种空心立方的金纳米结构,有着薄而多孔的壁和截断的角。改变AuNCs的尺寸及壁的厚度,可以调节AuNCs的SPR吸收峰位于600~1 200 nm内的任意波长。SPR吸收峰在800 nm处的AuNCs的边宽大约在45~50 nm。
夏幼南课题组首先报道了AuNCs的制备方法[20],并研究AuNCs在生物成像、光热治疗和药物输运方面的应用。其中最具影响力的工作是Yavuz等[21]制备了温度敏感的聚合物包被的AuNCs,在近红外激光照射下,AuNCs的光热效应使使聚合物构象改变而发生崩解,暴露出AuNCs的孔洞,实现近红外激光控制的药物释放。
最近,Shi等[22]也研究了AuNCs在热化疗中的应用,他们在AuNCs的孔洞上修饰了CaP包被的磁纳米粒子Fe3O4作为孔堵塞物,阻止包载的Dox过早释放。这种药物输送系统同时结合了磁靶向、热疗和化疗。此外,这种纳米复合材料中的磁性部分还可用作磁共振成像的造影剂,实现诊断和监测的功能。
1.5 金纳米星
由于粒子的多分散性,金纳米星溶液的吸收峰通常是一个很宽的峰。通过理论计算和实验技术绘制金纳米星的SPR空间分布,发现电子会在金纳米星的尖端聚集,因而可能产生更高的温度。近年来,金纳米星在肿瘤诊疗中的应用也成为一个研究热点[23-25]。
Yuan等[23]在金纳米星表面修饰了一种反式激活转录肽(trans-activator of transcription peptide,TAT peptide),发现其比裸露的和PEG修饰的金纳米星被细胞摄入的量更多。TAT-AuNP孵育BT549乳腺癌细胞后,用功率密度是0.2W/cm2的脉冲激光照射肿瘤细胞即可实现热疗,比文献中报道的功率密度都要低。可见,这种TAT修饰的金纳米星结构不仅能提高肿瘤治疗疗效,还有助于提高肿瘤治疗的安全性。
光动力治疗(photodynamic therapy,PDT)也是近年迅速发展的一种肿瘤选择性治疗技术。Wang等[24]在金纳米星的表面共价修饰了光敏剂二氢卟吩E6(Chlorin e6,Ce6),用一种连续波长的近红外激光照射同时实现了PDT和光热治疗。这种方法极大地简化了处理过程,并且与以前报道的光敏剂修饰的纳米材料相比明显地提高了抗癌效果。
最近,Chen等[25]在金纳米星表面修饰了靶向分子精氨酸-甘氨酸-天冬氨酸(arginine-glycine-aspartic acid,RGD)、近红外荧光探针和抗肿瘤药物Dox,实现了肿瘤靶向、成像、热疗和化疗多种诊疗功能。
2 结语
综上所述,基于金纳米材料的药物输运体系,能在一个载体上同时实现多种诊疗功能,这种集多种功能、协同增效的诊疗一体化纳米载体,是纳米药物的一个重要发展方向。
尽管上述研究结果鼓舞人心,这些金纳米粒子在高功率激光照射下会发生形变,导致近红外区域SPR吸收的损耗。虽然刚性介孔二氧化硅包覆的AuNRs已经克服了这一问题对光热应用的阻碍,但对于其他金纳米颗粒而言,仍需要新方法来解决这个问题。尺寸、形状、表面修饰和表面电荷都是决定材料生物相容性的关键因素[26-28]。此外,合理设计纳米载药体系,使其能提高纳米材料和药物在肿瘤部位的积累,对于提高成像质量和治疗效果都有重要的意义[29]。在对癌症患者进行临床试验之前,这些纳米材料在体内的行为包括药效、稳定性、毒性、分布、代谢等问题仍然需要系统研究。
1 Tang QC,Wnag XS.Research progress in the application of nano drug in the treatment of tumor[J].J Pract Oncol,2006,20(5):441-443.[汤庆超,王锡山.纳米药物应用于肿瘤治疗的研究进展[J].实用肿瘤学杂志,2006,20(5):441-443.]
2 Chen JN,Shen Q,Li SS.Development in the drug delivery systerm of reversing the multidrug resistance of nanoparticles[J].Pharmaceut J,2009,44(4):333-337.[陈家念,沈 琦,李绍顺.纳米粒给药系统逆转肿瘤多药耐药性的研究进展[J].药学学报,2009,44(4):333-337.]
3 Zhang ZJ,Wang LM,Wang J,et al.Mesoporous silica-coated gold nanorods as a light-mediated multifunctional theranostic platform for cancer treatment[J].Adv Mater,2012,24(11):1418-1423.
4 Dreaden EC,Alkilany AM,Huang X,et al.The golden age:gold nanoparticles for biomedicine[J].Chem Soc Rev,2012,41(7):2740-2779.
5 Rai P,Mallidi S,Zheng X,et al.Development and applications of photo-triggered theranostic agents[J].Adv Drug Deliv Rev,2010,62(11):1094-1124.
6 Cobley CM,Chen J,Cho EC,et al.Gold nanostructures:a class of multifunctional materials for biomedical applications[J].Chem Soc Rev,2011,40(1):44-56.
7 Qu XC,Liang JM,Yao CP.Optical properties of gold nanoparticle and ifs application in biological imaging photothermal therapy[J].Chin Laser,2007,34(11):1459-1465.[屈晓超,梁佳明,姚翠萍.金纳米微粒的光学性质及其在生物成像和光热疗法中的应用[J].中国激光,2007,34(11):1459-1465.]
8 Grossman JH,McNeil SE.Nanotechnology in Cancer Medicine[J].Phys Today,2012,65(8):18-42.
9 Barhoumi A,Huschka R,Bardhan R,et al.Light-induced release of DNA from plasmon-resonant nanoparticles:Towards light-controlled gene therapy[J].Chem Phys Lett,2009,482(4-6):171-179.
10 Liu HY,Liu TL,Wu XL,et al.Multifunctional gold nanoshells on silica nanorattles:a platform for the combination of photothermal therapy and chemotherapy with low systemic toxicity[J].Angew Chem Int Ed Engl,2011,50(4):891-895.
11 Liu HY,Chen D,Li LL,et al.Targeting gold nanoshells on silica nanorattles:a drug cocktail to fight breast tumors via a single irradiation with near-infrared laser light[J].Adv Mater,2012,24(6):755-761.
12 Zhang ZJ,Wang J,Chen CY.Gold nanorods based platforms for light-mediated theranostics[J].Theranostics,2013,3(3):223-238.
13 Xiao ZY,Ji CW,Shi JJ,et al.DNA self-assembly of targeted near-infrared-responsive gold nanoparticles for cancer thermo-chemotherapy[J].Angew Chem Int Ed Engl,2012,51(47):11853-11857.
14 Ren F,Bhana S,Derek DN,et al.Gold nanorods carrying paclitaxel for photothermal-chemotherapy of cancer[J].Bioconjug Chem,2013,24(3):376-386.
15 Shen S,Tang HY,Zhang XT,et al.Targeting mesoporous silica-encapsulated gold nanorods for chemo-photothermal therapy with near-infrared radiation[J].Biomaterials,2013,34(12):3150-3158.
16 Melancon MP,Zhou M,Li C.Cancer theranostics with near-infrared light-activatable multimodal nanoparticles[J].Acc Chem Res,2011,44(10):947-956.
17 Melancon MP,Elliott AM,Shetty A,et al.Near-infrared light modulated photothermal effect increases vascular perfusion and enhances polymeric drug delivery[J].J Control Release,2011,156(2):265-272.
18 You J,Zhang R,Zhang GD,et al.Photothermal-chemotherapy with doxorubicin-loaded hollow gold nanospheres:A platform for near-infrared light-trigged drug release[J].J Control Release,2012,158(2):319-328.
19 You J,Shao RP,Wei X,et al.Near-infrared light triggers release of Paclitaxel from biodegradable microspheres:photothermal effect and enhanced antitumor activity[J].Small,6(9):1022-1031.
20 Sun YG,Mayers BT,Xia YN,et al.Template-Engaged Replacement Reaction:A One-Step Approach to the Large-Scale Synthesis of Metal Nanostructures with Hollow Interiors[J].Nano Lett,2002,2(5):481-485.
21 Yavuz MS,Cheng YY,Chen JY,et al.Gold nanocages covered by smart polymers for controlled release with near-infrared light[J].Nat Mater,2009,8(12):935-939.
22 Shi P,Qu KG,Wang JS,et al.pH-responsive NIR enhanced drug release from gold nanocages possesses high potency against cancer cells[J].Chem Commun(Camb),2012,48(61):7640-7642.
23 Yuan HK,Fales AM,Vo-Dinh T,et al.TAT peptide-functionalized gold nanostars:enhanced intracellular delivery and efficient NIR photothermal therapy using ultralow irradiance[J].J Am Chem Soc,2012,134(28):11358-11361.
24 Wang SJ,Huang P,Nie LM.Single Continuous Wave Laser Induced Photodynamic/Plasmonic Photothermal Therapy Using Photosensitizer-Functionalized Gold Nanostars[J].Adv Mater,2013,25(22):3009-3015.
25 Chen HY,Zhang X,Dai SH.Multifunctional Gold Nanostar Conjugates for Tumor Imaging and Combined Photothermal and Chemo-therapy[J].Theranostics,2013,3(9):633-649.
26 Ma ZF,Tian L,Di J,et al.Biological detection,Cell imaging and photothemal therapy of cancer based on gold nanorods[J].Progress in Chem,2009,21(1):134-142.[马占芳,田 乐,邸 静,等.基于金纳米棒的生物检测、细胞成像和癌症的光热治疗[J].化学进展,2009,21(1):134-142.]
27 Xu YY,Lin XY,Chen CY.The key factors affecting the toxicity of nanomaterids[J].Chin Sci Bulletin,2013,58(24):2466-2478.[徐莺莺,林晓影,陈春英.影响纳米材料毒性的关键因素[J].科学通报,2013,58(24):2466-2478.]
28 Li YF,Chen CY.Fate and Toxicity of Metallic and Metal-containing Nanoparticles for Biomedical Applications[J].Small,2011,7(21):2965-2980.
29 Zhang ZJ,Wang J,Chen CY.Near-Infrared Light-Mediated Nanoplatforms for Cancer Thermo-Chemotherapy and Optical Imaging[J].Adv Mater,2013,25(28):3869-3880.

