苏云金芽胞杆菌高效电转化方法的建立
李宇晟,张 旭,胡晓凤,丁学知,夏立秋,胡胜标
(湖南师范大学生命科学学院,湖南省微生物分子生物学国家重点实验室培育基地,中国长沙 410081)
苏云金芽胞杆菌(Bacillus thuringiensis,简称Bt)是一种革兰阳性细菌,广泛分布于土壤中.由于Bt在芽胞形成期能产生具有杀虫活性的晶体蛋白,现已被应用于农林害虫的生物防治[1].为了提高Bt的杀虫毒力、拓宽杀虫谱、延缓昆虫抗性产生,利用外源基因导入Bt野生型菌株中以构建具有更高杀虫活力、杀虫谱更广的工程菌已成为国内外微生物农药发展的重要方向[2].外源基因导入Bt野生型菌株中常用的方法有原生质体融合、接合转移、电穿孔等.其中,原生质体融合和接合转移存在操作繁锁、难度较大、稳定性差、转化率低等缺点[3-4],而电穿孔转化所需设备简单、方法简便、转化效率相对较高,被广泛运用于Bt工程菌的构建工作中[5-6].
由于Bt属于革兰氏阳性菌,在生理状态和细胞结构上与革兰阴性菌,如大肠杆菌(Escherich coli,简称E.coli),存在很大差异,电转化方法在Bt中的使用并不十分完善,其电转化效率和重复性都还有待进一步提高[7].在以往相关Bt电转化方法的报道,多集中在质粒盐离子浓度、电转化缓冲液、电转化参数等方面,不同实验组、不同Bt菌株间的电转化方法和效率存在较大的差异.本课题组在前期研究中发现,质粒加入Bt感受态细胞中很容易被降解,低浓度的质粒直接影响了电转化效率,而经蛋白酶K处理后的Bt感受态细胞对质粒的降解作用大大下降,显著提高了转化效率.研究还对电转化相关因素进行了优化,包括培养基成分及渗透压、培养时间、电转化缓冲液、电场压、质粒DNA的浓度等.利用该方法,在Bt中建立了一种稳定高效的电转化方法.
1 材料与方法
1.1 材料
1.1.1 菌株与质粒 Bt 4.0718(CCTCC No.M200016)为本研究室选育的野生型Bt菌株.Bt菌株培养温度为30℃.质粒pHT315为E.coli-Bt穿梭载体,含有氨苄青霉素(Ampicillin)抗性基因(E.coli中的筛选基因)和红霉素(Erythromycin)抗性基因(Bt中的筛选基因).
1.1.2 培养基、缓冲液和试剂 BHI培养基:脑心浸液(Brian Heart Infusion,BHI)20 g/mL;BHIS培养基:BHI培养基中加入0.5 mol/L山梨醇;电转化缓冲液A:0.5 mol/L山梨醇,0.5 mol/L甘露醇,体积分数为10%的甘油(下同);电转化缓冲液B:275 mmol/L蔗糖,10%甘油;电转化缓冲液C:272 mmol/L蔗糖,0.5 mmol/L MgCl2;蛋白酶K:10 g/L;红霉素:25 mg/L.
1.2 方法
1.2.1 引物 根据pHT315质粒上红霉素抗性基因(erm)序列,设计引物对:Erm-S:ATGCCCTTAGAAGCAAACTTAAG;Erm-A:CCGATACAAATTCCCCGTAGG.
1.2.2 Bt感受态细胞的制备 接种Bt菌株于10 mL培养基中(BHI培养基和BHIS培养基),30℃震荡过夜培养.按体积2%的接种量转接入50 mL新鲜BHIS培养基中,30℃震荡培养,定时取样并在分光光度计(Bio-Rad SmartSpec plus,美国)上测定OD600值.将菌体在冰上放置10 min,收集菌体.用500 μL电转化缓冲液悬浮细胞,加入5 μL 10 g/L蛋白酶K(终浓度1 g/L),37℃孵育20 min.4℃,6 000 r/min离心5 min收集菌体,用预冷电转化缓冲液洗涤细胞2次,用500 μL预冷的电转化缓冲液重悬细胞并分装到无菌Ep管中(100 μL/管),-80 ℃冷冻保存待用.
1.2.3 电转化 取Bt感受态细胞1管(100 μL),手温溶化,取100 ng pHT315质粒与之重发混匀,转入电转化杯中,设置电击转化仪(Eppendorf 2510,德国)的电压值,将转化杯置于电击槽中电击一次.电击完毕后立即冰上放置5 min,向杯中加入900 μL BHIS培养基,30℃ 1000 r/min培养2 h,涂布含有红霉素(25 mg/L)的BHIS平板,培养12~24 h.实验重复3次,计算转化子平均数目.
2 结果与分析
2.1 细胞生长时期对转化效率的影响
Bt 4.0718菌株30℃震荡培养,定时取样并测定细胞量(OD600值),分别制备感受态细胞、电转化pHT315质粒,挑选转化子用引物对(Erm-S/Erm-A)进行菌落PCR鉴定,所获得转化子均为阳性(图1).当Bt 4.0718 菌株细胞生长到 OD600值0.2、0.4、0.6、0.8、1.0 时,在红霉素平板分别获得 35、107、294、321、126个转化子(图2).这说明,当Bt 4.0718菌株细胞OD600值达0.6~0.8时,最适合进行感受态细胞的制备,此时电转化效率最高.
图1 菌落PCR检测Bt转化子Fig.1 Identification of Bt transformants by Colony PCR

图2 Bt细胞生长量对电转化效率的影响Fig.2 Effect of Bt cell growth phase on transformation efficiency
2.2 蛋白酶K对Bt转化效率的影响
将pHT315质粒分别与未经蛋白酶K处理和经蛋白酶K处理的Bt感受态细胞孵育一段时间,观察质粒DNA量的变化.未处理的Bt感受态细胞与1 μg pHT315混合后孵育1 min,有将近50%(500 ng)的pHT315被降解;随着孵育时间延长,这种降解作用越来越大,当孵育时间达到10 min,剩下的pHT315质粒大约只有原来的20%(200 ng).而Bt感受态细胞经蛋白酶K(终浓度为1 g/L)处理20 min后再与pHT315质粒孵育,这种降解作用大大减弱:即使孵育10 min后,剩余的质粒还有原来的80%(800 ng)左右(图3).因为Bt感受态细胞经1 g/L的蛋白酶K处理后对质粒DNA的降解作用减弱,最终获得的转化子数量增加了近30倍.

图3 Bt感受态细胞对质粒pHT315的降解作用Fig.3 The degration effect of Bt competent cells to pHT315
2.3 培养基中加入山梨醇对电转化率的影响
传统电转化方法中多使用BHI作为培养基,而电转化缓冲液多为高渗环境,这样细胞容易迅速死亡,从而影响电转化效率.利用BHI培养Bt 4.0718菌株制备的感受态细胞,进行pHT315质粒的转化,最后获得83个转化子.当在BHI中添加了0.5 mol/L山梨醇(BHIS培养基),相同条件下进行电转化,获得的转化子数目达到327个,转化率提高了近4倍.
2.4 电转缓冲液对电转化率的影响
为了获得最佳Bt电转缓冲液,对3种电转缓冲液进行了比较.在相同的条件下,电转化缓冲液A(0.5 mol/L山梨醇,0.5 mol/L甘露醇,10%甘油);电转化缓冲液B(275 mmol/L蔗糖,10% 甘油);电转化缓冲液C(272 mmol/L蔗糖,0.5 mmol/L MgCl2)分别获得转化子数目分别为297、314、308个,表明3种电转缓冲液对Bt电转化效率影响差别不大.
2.5 电转化参数对电转化率的影响
电转化参数中,电压对电转化效率的影响最大.在1.5~2.5 kV的电压范围内进行电转化.当电压为1 500、1 800、2 000、2 300、2 500 V 时,分别获得204、329、281、203、183 个转化子(图4).电压从1 500 V增加到1 800 V,转化子数目增加了125个,当电压继续增加时电击常数下降,2 500 V时的电击常数只有3.6 ms.电压增加导致电击常数下降,令转化子数量反而减少.因此,对Bt 4.071 8菌株进行电转时电压为1 800 V为最佳.
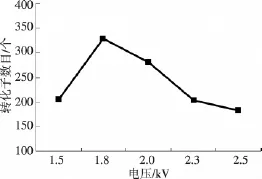
图4 电压对Bt电转化效率的关系Fig.4 The effect of voltage on Bt electroporation efficiency
3 讨论
文献报道,许多细菌能合成核酸酶[8],这些核酸酶大多分泌到胞外,能迅速降解环境中的DNA.在电转化过程中,这些胞外核酸酶对质粒DNA的降解作用大大降低电转化效率.本研究发现,将Bt感受态细胞与质粒DNA孵育后,短时间内大量的DNA被降解,而经过终浓度为1 g/L的蛋白酶K处理后的Bt感受态细胞对质粒的降解作用就变得很小.由此推测:Bt细胞能表达分泌核酸酶,它们对质粒的降解作用对电转化效率具有负面影响.蛋白酶K处理Bt细胞时间以20 min为最佳,时间太短则核酸酶不能充分消化,时间太长可能导致Bt细胞死亡.
Bt细胞的培养是影响电转化效率的一个关键因素.当OD600在0.6~0.8时,Bt细胞处于对数生长中期,细胞生长旺盛,细胞壁结构较稳定期细胞相对疏松,有利于孔洞的形成和外源DNA通过孔洞进入细胞[9],从而提高电转化效率.而培养基的成分也将影响到Bt电转化效率.以往在制备Bt感受态细胞过程中,直接将菌体转移到高渗电转化缓冲液当中,而渗透压的突然改变会对细胞产生有害作用,导致细胞大量死亡,获得的转化子数目非常少.当在BHI培养基中加入0.5 mol/L山梨醇后,细胞有了适应高渗电转化缓冲液的能力,细胞存活率大大提高,而且复苏培养基中山梨醇的加入,使得Bt感受态细胞电击以后,细胞得到了高渗溶液的有效保护,细胞死亡率大大降低,也有利于提高电转效率[10-11].
影响电转效率的另一个因素是电击参数中的电压值.电穿孔转化的主要原理是利用瞬时的高强度电场使细胞膜的渗透性发生改变,从而使DNA顺利进入细胞内.电击过程中,电压过低,细胞难以极化产生孔洞,DNA不能进入;电压过高,则会因细胞膜损伤过大而死亡,从而导致转化效率的降低[12].对于不同的细菌细胞,电压值存在较大差异.作者的研究表明,在1 800 V时,Bt 4.071 8菌株能获得最多的转化子.
此外,还存在其他一些影响Bt电转化效率的因素:不同Bt菌株转化效率存在差异;大分子量质粒的转化效率要低于小分子量质粒;同一质粒的超螺旋型电转化效率要高于开环状和线性质粒;使用低浓度抗生素筛选转化子比高浓度抗生素能获得更多转化子.
本研究通过优化电转化过程中的关键因素,获得了适用Bt的高效电转化条件:Bt生长在含有0.5 mol/L山梨醇的BHI培养基中,30℃振荡培养OD600至0.6~0.8,感受态细胞经1 g/L蛋白酶K处理20 min,电压为1 800 V时,可以获得最高转化效率.
[1]HU S B,LIU P,DING X Z,et al.Efficient constitutive expression of chitinase in the mother cell of Bacillus thuringiensis and its potential to enhance the toxicity of Cry1Ac protoxin [J].Appl Microbiol Biotechnol,2009,82(6):1157-1167.
[2]GUAN P,AI P,DAI X,et al.Complete genome sequence of Bacillus thuringiensis serovar sichuansis strain MC28[J].J Bacteriol,2012,194(24):6975.
[3]XIAO M H,BJARNE M H,JORGEN E.Conjugative transfer,stability and expression of a plasmid encoding a cry1Ac gene in Bacillus cereus group strains[J].FEMS Microbiol Lett,2004,231(4):45-52.
[4]YU J,PANG Y,TANG M,et al.Highly toxic and broad-spectrum insecticidal Bacillus thuringiensis engineered by using the transposon Tn917 and protoplast fusion [J].Curr Microbiol,2001,43(6):112-119.
[5]PENG D,LUO Y,GUO S,et al.Elaboration of an electroporation protocol for large plasmids and wild-type strains of Bacillus thuringiensis[J].J Appl Microbiol,2009,106(6):1849-1858.
[6]MONTHES H C,RUIZ M R,MAGANA P I.Efficient transformation of Cellulomonas flavigena by electroporation and conjugation with Bacillus thuringiensis[J].Curr Microbiol,2004,49(8):428-432.
[7]MESRATI L A,KARRAY M D,TOUNSI S,et al.Construction of a new high-copy number shuttle vector of Bacillus thuringiensis[J].Lett Appl Microbiol,2005,41(4):361-366.
[8]PEDIADITAKIS M,KAUFENSTEIN M,GRAUMANN P L.Bacillus subtilis hlpB encodes a conserved stand-alone HNH nuclease-like protein that is essential for viability unless the hlpB deletion is accompanied by the deletion of genes encoding the Add-AB DNA repair complex[J].J Bacteriol,2012,194(22):6184-6194.
[9]TROND E V A,FINN L A.Methodologies to increase the transformation efficiencies and the range of bacteria that can be transformed [J].Appl Microbiol Biotechnol,2010,85(5):1301-1313.
[10]FATMA M M,CARLOS D,MARC B.High transformation efficiency of Bacillus subtilis with integrative DNA using glycine betaine as osmoprotectant[J].Anal Biochem,2012,424(2):127-129.
[11]ZHANG H L,LI Y T,CHEN X M,et al.Optimization of electroporation conditions for Arthrobacter with plasmid PART2[J].J Microbiol Meth,2011,84(1):114-120.
[12]LANCKRIET A,TIIMBERMONT L,HAPPONEN L J,et al.Generation of single-copy transposon insertions in clostridium perfringens by electroporation of phage Mu DNA transposition complexes[J].Appl Environ Microbiol,2009,75(9):2638-2642.

