枯草芽孢杆菌SCK6超级感受态的制备和转化条件优化
李信志,卢争辉,周玉玲,李世宇,张桂敏
枯草芽孢杆菌SCK6超级感受态的制备和转化条件优化
李信志,卢争辉,周玉玲,李世宇,张桂敏
湖北大学生命科学学院生物资源绿色转化湖北省协同创新中心,湖北武汉 430062
枯草芽孢杆菌是一种革兰氏阳性好氧细菌,因其安全性和高分泌特性,已被广泛用作异源蛋白的表达宿主。然而,相比大肠杆菌,枯草芽孢杆菌的转化效率低,限制了其作为宿主的异源蛋白的定向进化。本文通过改变培养基、诱导剂浓度、质粒类型等参数优化感受态制备的条件,利用常规质粒进行转化,结果表明,用营养丰富的YN培养基替代常规LB培养基制备感受态,可以使转化效率提高4倍左右;加入1.5%的木糖诱导2 h,感受态的转化效率又提高2倍左右;用大肠杆菌GM272来源的质粒又可进一步提高转化效率3倍左右。综合最优条件制备SCK6的感受态,转化整合型质粒pDG1730,效率可以达到106CFU/µg,相对未优化的条件提高了2个数量级,为基于枯草芽孢杆菌的酶的定向进化和代谢工程奠定了基础。
枯草芽孢杆菌,基因,木糖,感受态,pDG1730
枯草芽孢杆菌是一种广泛分布嗜温、好氧并产芽孢的革兰氏阳性杆状细菌,已被美国食品药品管理局(FDA) 认定为GRAS (Generally recognized as safe) 菌株。枯草芽孢杆菌具有很强的抗逆性,并能分泌大量酶类和产生抗菌物质,因此,一方面作为活菌剂被广泛应用在饲料、生防、环保等领域,另一方面作为表达系统在外源蛋白和代谢产物的生产中发挥重要作用[1]。
与我们常用的大肠杆菌表达系统相比,枯草芽孢杆菌表达系统具有以下的优势:1) 它具有很强的分泌表达能力,能将表达的外源蛋白直接分泌到细胞外,避免了破菌的程序,简化了蛋白纯化的步骤,有利于下游操作;2) 属于GRAS菌株,可安全用于生产食品、医药蛋白;3) 没有明显的密码子偏爱性,避免了密码子优化[2-4]。然而,枯草芽孢杆菌作为表达系统,其转化效率远远低于大肠杆菌,一方面限制了其在蛋白质工程 (如定向进化、蛋白质突变体库等) 的应用;另一方面限制了枯草芽孢杆菌的代谢工程改造 (如多基因同时编辑,多基因协同表达等)。
因此很多科学家致力于提高枯草芽孢杆菌的转化效率,以便于在枯草芽孢杆菌中进行酶定向进化和代谢工程改造。目前报道的提高枯草芽孢杆菌转化效率的方法主要有3种:一是利用多聚体质粒进行转化,该方法需要构建多聚体的质粒[5];二是电穿孔法,该方法需要用高浓度的甘露醇和山梨醇去创造细胞高渗透压的环境[6];三是原生质法,由于原生质体脆弱,使得制备枯草芽孢杆菌原生质体困难且十分繁琐,同时还需要用聚乙二醇去促进DNA进入[7]。这3种方法虽然可以提高枯草芽孢杆菌的转化效率,但这些方法工作量大、复杂、耗时且不易掌握。因此需要发展一种简单、易于操作的高效转化普通质粒的方法。早在1958年,Spizizen等发现枯草芽孢杆菌168菌株具有形成自然感受态的能力[8],王树香等研究发现枯草芽孢杆菌感受态的形成是生长后期高度有序的遗传调控的结果[9]。因此许多研究者从枯草芽孢杆菌后期生长的遗传调控网络出发,分析细胞感受态形成与芽孢形成的遗传通路,及细胞在感受态形成与芽孢形成中的遗传决定机制,发现ComK是枯草芽孢杆菌中调控感受态形成的关键转录因子,其浓度的改变会调控细胞形态变化、外源DNA吸收等相关的感受态发育后期基因的表达,并容易使细胞进入感受态状态[10-13]。因此,张晓舟等[14]在枯草芽孢杆菌1A751基因组中整合了基因获得菌株SCK6,通过木糖诱导的启动子诱导ComK的表达,从而制备出SCK6的高效感受态,通过转化多聚体质粒,其转化效率可以达到107CFU/μg,同时其感受态制备过程也十分简单、易于操作。然而,该研究并没有对SCK6的感受态制备和转化条件进行优化,也没有研究该方法对转化普通质粒的效果。
本研究在此基础上,通过改变培养基、诱导剂浓度和质粒类型等参数优化了感受态制备和转化的条件,最终使优化后SCK6感受态转化普通质粒的效率整体提高了2个数量级,其中最高达到106CFU/µg。
1 材料与方法
1.1 材料与配方
菌株:SCK6[14]由俄亥俄州Genetic Stock Center (BGSC) 馈赠。GM272 (−,−,−)[15]菌株(后面简称GM272) 由美国佛罗里达大学Shanmugam教授馈赠。大肠杆菌甲基化宿主Trans5α菌株购于Transgen公司。
质粒:质粒pDG1730由华中农业大学孙明教授馈赠。质粒pBS1C、pBE980b和pHY300plk由中国科学院天津工业生物技术研究所王钦宏研究员馈赠。游离型质粒pHT01由美国佛罗里达大学Shanmugam教授馈赠。
试剂:木糖购自国药集团化学试剂有限公司;细菌RNA抽取试剂盒购自
培养基:LB:10 g/L氯化钠,5 g/L酵母抽提物,10 g/L蛋白胨。YN:7 g/L酵母抽提物,18 g/L营养肉汤。MD:7.5 g/L酵母抽提物,8 g/L营养肉汤。
CDM(MOPS-based chemically defined medium)[16](100 mL):10×MOPS溶液10 mL,色氨酸 (5 mg/mL) 1 mL,柠檬酸铁铵(2.2 mg/mL) 1 mL,III’-salts 1 mL,谷氨酸钾(40%) 2 mL,琥珀酸钠(30%) 2 mL,果糖(20%) 1 mL;
10×MOPS溶液:83.72 g/L MOPS,33 g/L硫酸铵,3.85 mL/L磷酸二氢钾(1 mol/L),6.15 mL/L磷酸氢二钾(1 mol/L);III’-salts:0.232 g/L硫酸锰,12.3 g/L 硫酸镁。
1.2SCK6超级感受态的常规制备方法
将–80 ℃保存的枯草芽孢杆菌SCK6在LB平板上划线活化,取划线得到的单菌落接种于LB新鲜培养基中,在37 ℃、220 r/min过夜培养12 h,转接过夜培养物到含有1%木糖的LB新鲜培养基中,起始600=1.0,继续放在37 ℃、220 r/min中培养2 h,所得菌液即为感受态细胞,将制备好的感受态分装后加10%甘油保存在–80 ℃[14]。
1.3 枯草芽孢杆菌感受态效率检测方法
取1 µL已知浓度的质粒,加入100 µL枯草芽孢杆菌感受态中混合均匀,37 ℃、220 r/min孵育90 min,稀释一定倍数后将其涂布在抗性平板上,37 ℃倒置过夜培养,计数转化子,计算出感受态转化效率 (CFU/µg)。
1.4 优化SCK6感受态制备方法
1.4.1 不同培养基对感受态效率的影响
不同培养基含有不同的营养物质,所以对菌体生长的影响也不一样。选用了4种常见的芽孢杆菌培养基来制备感受态,这4种培养基分别为LB、YN、MD和CDM (合成培养基),在其他条件与步骤不改变的情况下,进行感受态制备,比较转化效率,寻找最适培养基。
1.4.2 不同木糖浓度对感受态效率的影响
SCK6中含有木糖诱导表达的感受态形成关键转录因子基因,它的浓度会调控相关的感受态发育后期基因的表达。在获得最优培养基的基础上,分别加入0.5%、1.0%、1.5%、2.0%的木糖[17]去诱导SCK6感受态的形成,诱导2 h后获得感受态,通过转化质粒pDG1730检测感受态效率,观察不同木糖浓度对感受态制备的影响,找到最适的木糖诱导浓度。
同时,抽取不同浓度木糖诱导后SCK6的总RNA,通过逆转录试剂盒(购自)得到相应的cDNA第一条链,然后以其为模板进行相对荧光定量PCR。荧光定量PCR仪和荧光定量PCRiTaqUniversal SYBR Green supermix购自以16S rRNA作为内参基因[18],以不加木糖诱导的SCK6的总RNA作为对照,每个反应做3次重复,用2–△△Ct法[19]分析实验结果,检测不同浓度木糖诱导下基因的表达转录水平。荧光定量PCR用的ComK引物是ComKq-F和ComKq-R、内参基因16S rRNA的引物是16S rRNA-F和16S rRNA-R (表1)。
1.4.3 质粒是否甲基化对转化效率的影响
Russell和Zinder[20]报道大肠杆菌−宿主中抽提的质粒其转化效率要比来自+宿主的质粒高很多 (在大肠杆菌中的转化效率)。GM272(−,−,−)是甲基化酶缺失菌株,其不能对转入其中的质粒或基因片段进行甲基化修饰,Trans5α是常用的克隆菌株,是+宿主,可以对转入其中的质粒或基因片段甲基化。将pDG1730、pHT01和pBS1C 3种质粒分别转入到GM272和Trans5α菌株中,分别获得未甲基化和甲基化修饰的质粒。通过浓度测定、稀释调节质粒为相同浓度后,将质粒转入到SCK6感受态细胞中,比较3种不同来源质粒的感受态效率。
1.4.4 不同抗生素抗性对转化的影响
在1.4.3实验中发现带有不同抗生素抗性的质粒,转化效率也有很大的差别,即使是非常相似仅抗性基因不同的pBS1C与pDG1730质粒,转化效率也相差很大。为了进一步探究不同抗生素抗性对转化的影响,将游离型质粒pHT01进行抗性基因替换,即用壮观霉素抗性基因替换氯霉素抗性基因。以质粒pDG1730为模板,设计引物Spc-F和Spc-R (表1) 扩增壮观霉素抗性基因,PCR产物经胶回收后,用Ⅱ和Ⅰ进行酶切,酶切产物和经Ⅱ和Ⅰ酶切的质粒pHT01连接,连接产物转化大肠杆菌Trans5α感受态细胞,获得重组质粒pHTL01。在相同条件下,转化枯草芽孢杆菌感受态细胞,观察pHT01质粒抗性改变前后转化效率的变化。
1.5 优化条件与原始条件下制备感受态效率
综合单因素改变的最优方法进行组合,在优化条件下进行感受态制备,即用YN作为培养基、1.5%木糖诱导2 h、转化时用GM272来源未甲基化的质粒,以1.2的原始条件作为对照,用质粒pDG1730、pHT01、pBS1C、pBE980b和pHY300plk检测优化后的转化效果。
1.6 统计分析
对于实验中感受态效率的统计分析,采用多次重复实验,去掉相差较大的数据,对剩下相近的数据取平均值的方法。
2 结果与分析
2.1 不同培养基对感受态效率的影响
常规制备枯草芽孢杆菌感受态使用的培养基是LB培养基,然而枯草芽孢杆菌在营养贫乏环境中容易产生芽孢,因此,不同的培养基会影响枯草芽孢杆菌感受态的形成。培养基YN和MD是实验室中常用的培养基,其营养成分比LB丰富,而CDM培养基是文献报道[16]可用来培养枯草芽孢杆菌的合成培养基,主要由无机盐组成,营养贫瘠。按方法1.2的条件,选用这4种培养基制备菌株SCK6的感受态,转化质粒pDG1730的浓度为20 ng/µL,转化结果见图1。结果发现用YN培养基制备的感受态效率是LB培养基的4倍左右,是MD培养基的3–4倍,而在CDM培养基的转化效率最低,说明制备枯草芽孢杆菌的感受态需要营养丰富的培养基。
通过监测制备过程中菌体的密度 (表2),发现SCK6在营养丰富的YN培养基和MD培养基中的菌体密度比LB培养基中高30%,推测用YN培养基制备的感受态效率高是因为YN培养基比LB培养基营养更丰富,更有利于细胞生长,感受态细胞数目更多所致。因此,选用YN培养基作为制备SCK6感受态的最适培养基。
2.2 不同木糖浓度对感受态效率的影响
ComK是枯草芽孢杆菌形成感受态的关键转录因子,它参与调控细胞形态变化、外源DNA吸收等相关的感受态发育后期基因的表达,使细胞进入感受态通路。SCK6是在菌株1A751的染色体上整合了基因,利用木糖诱导的启动子PxylA进行调控,可以诱导SCK6形成感受态细胞。添加不同浓度的木糖诱导,表达产物的多少可能会对感受态的转化效率产生影响。因此,按方法1.2的条件,在YN培养基中加入不同浓度的木糖,分别制备SCK6的感受态,转化质粒pDG1730的浓度为2 ng/µL,转化结果如图2所示,可以看出1.5%木糖诱导所制备的感受态细胞转化效率最高。
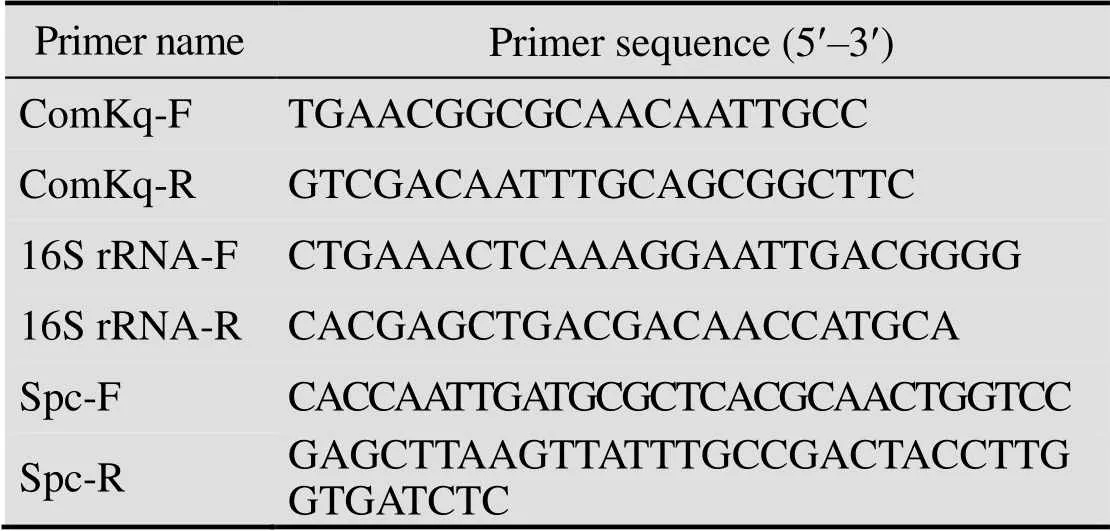
表1 本研究中所用的引物序列
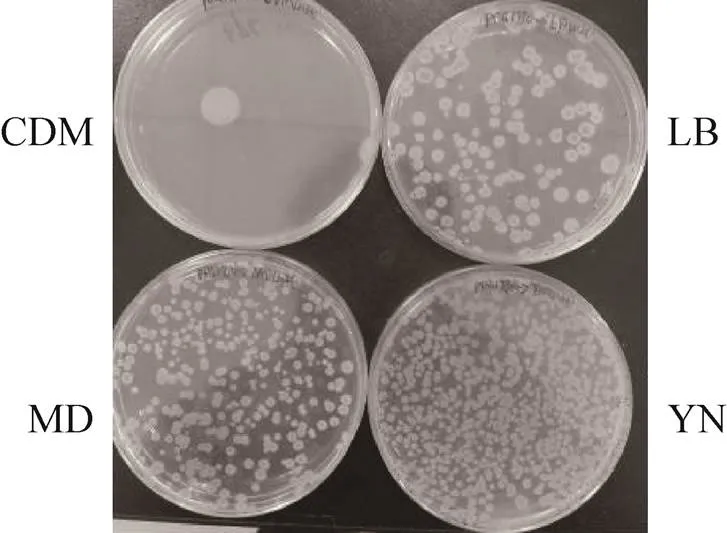
图1 不同培养基制备B. subtilis SCK6感受态的转化效果图
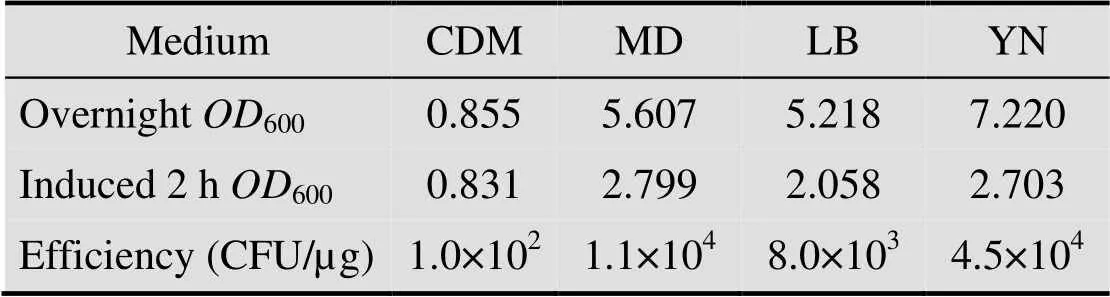
表2 不同培养基对B. subtilis SCK6感受态效率的影响
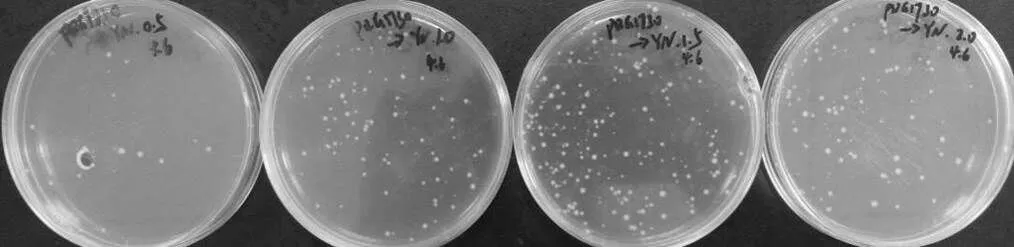
图2 不同木糖浓度诱导培养B. subtilis SCK6感受态的转化效果图
通过监测感受态制备过程中菌体的密度 (表3),发现木糖浓度低时,菌体生长快,但是转化效率偏低;木糖浓度升高,菌体生长变慢,在木糖浓度为1.5%的时候,转化效率达到最高。为了验证ComK表达产物和转化效率的关系,通过定量荧光PCR检测了不同木糖诱导条件下基因的表达水平。图3显示了不同浓度木糖诱导基因表达的相对定量情况,可以看出用1.5%木糖诱导2 h时,的转录水平是最高的,和最高的转化效率保持一致,在其他木糖浓度的时候,的转录水平和转化效率之间也是正相关,说明感受态的效率受ComK表达量的影响。
2.3 质粒甲基化与否对转化效率的影响
Russell 和 Zinder[20]的文献报道,非甲基化的质粒转化效率最高。将枯草杆菌的3种质粒,pDG1730、pHT01和pBS1C分别转入大肠杆菌甲基化缺陷菌株GM272中,抽提获得未甲基化的质粒。然后,将20 ng/µL三种未甲基化的质粒转入用YN培养基培养、1.5%木糖诱导2 h的枯草芽孢杆菌感受态细胞中。同时以甲基化修饰的质粒 (来自Trans5α) 为对照,转化结果见图4。由图可以看出,未甲基化修饰的3种质粒比甲基化修饰质粒的转化效率高3–4倍左右,说明非甲基化的质粒转化枯草芽孢杆菌的转化效率更高,具体数据见表4。
2.4 带不同抗生素抗性基因的质粒对转化效率的影响
由2.3的实验结果发现,在同一批感受态中,转化质粒不同,感受态的转化效率差别很大,尤其是质粒pBS1C与pDG1730,同为整合型质粒,但是它们的转化效率相差50–100倍。在多次的转化实验中我们也发现质粒pDG1730的转化效率相对枯草芽孢杆菌的其他质粒,转化效率是相对较高的。通过质粒图谱分析发现,pBS1C与pDG1730这两个质粒的结构非常相似,有相同的和其他序列,但它们携带的抗性基因不同。pBS1C携带的是氯霉素抗性基因 (753 bp),而pDG1730是壮观霉素抗性基因 (726 bp),初步认为可能枯草芽孢杆菌SCK6中限制性酶在氯霉素抗性基因中有切割位点导致其转化效率降低。
为了进一步验证抗生素抗性对转化效率的影响,游离型质粒pHT01中的氯霉素抗性基因被替换为壮观霉素抗性基因得到质粒pHTL01 (图5)。
将pHT01和pHTL01分别转化进GM272中,抽提获得未甲基化修饰的质粒,然后在相同条件下转化SCK6感受态细胞 (质粒浓度20 ng/µL),结果如图6所示。结果表明壮观霉素抗性的pHTL01比带氯霉抗性的pHT01质粒转化效率高出2–3倍,其中带壮观霉素抗性的pHTL01转化效率为4.50×104CFU/µg,而带氯霉素抗性的pHT01转化效率为2.12×104CFU/µg。这说明SCK6中存在能对氯霉素抗性基因进行编辑的酶,但是对转化效率的影响可能不仅是这个原因,因为质粒pBS1C与pDG1730的转化效率相差50–100倍。
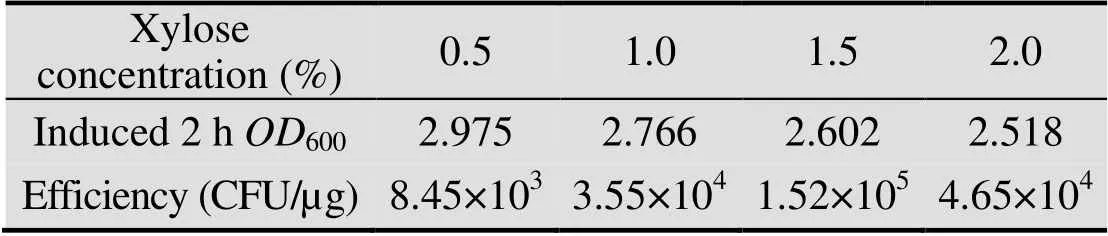
表3 不同木糖浓度对B. subtilis SCK6感受态效率的影响
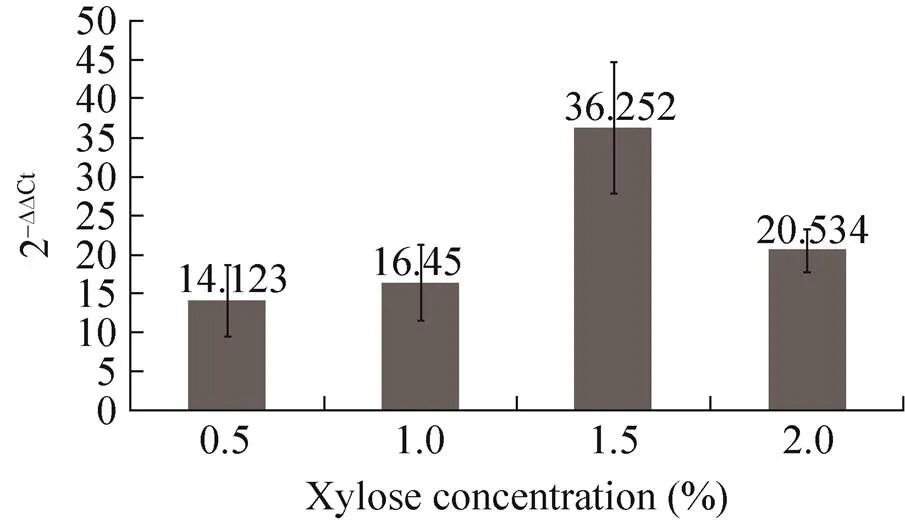
图3 荧光定量PCR检测不同浓度木糖诱导时comK基因转录水平
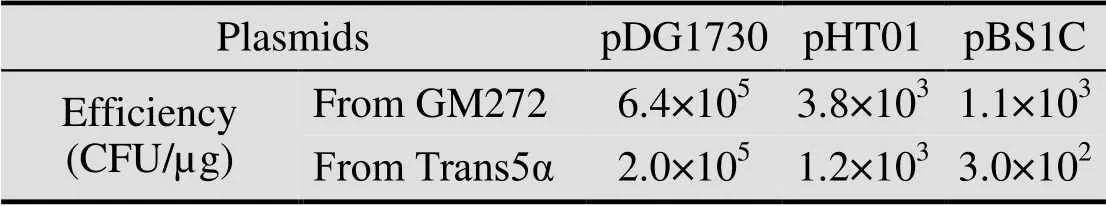
表4 不同质粒甲基化与否转化效率比较
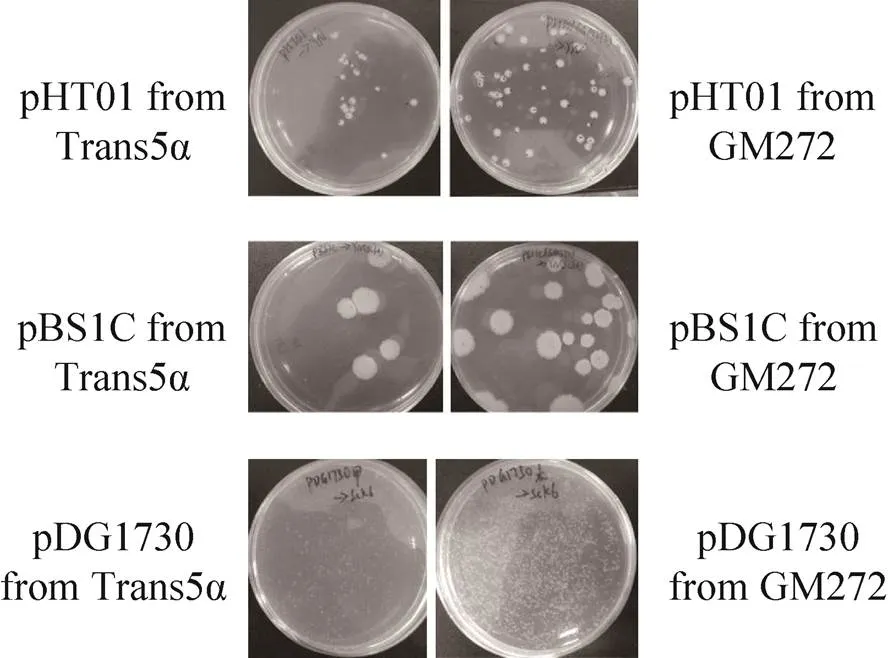
图4 不同甲基化来源质粒转化SCK6的转化效果
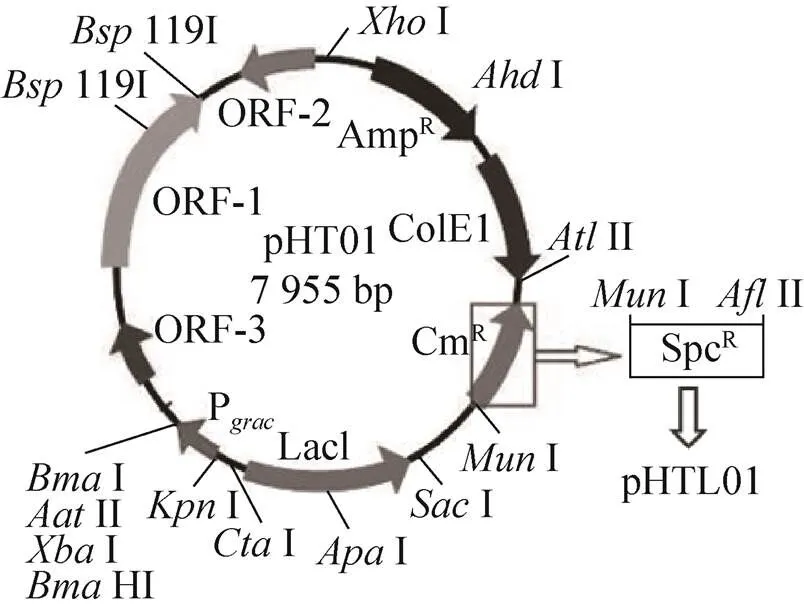
图5 改造质粒pHT01的示意图
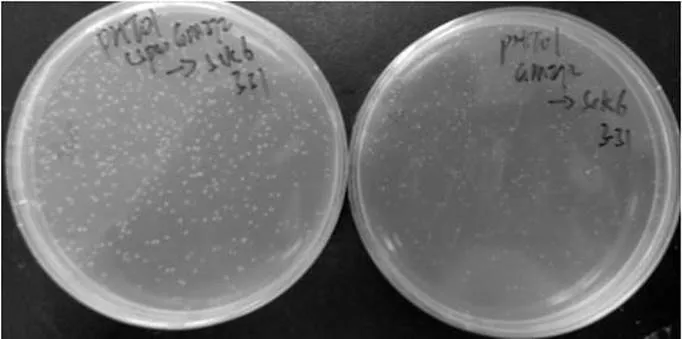
图6 带不同抗生素抗性基因的质粒对转化效率的影响
2.5 综合优化条件与原条件下制备感受态效率比较
综合之前实验结果,分别用优化的条件和原条件去制备菌株SCK6的感受态,并用不同的枯草芽孢杆菌质粒去检验优化条件的效果,优化条件即:用YN培养基进行菌体培养,用1.5%的木糖诱导2 h,转化GM272来源未甲基化的质粒;原始条件即:用LB培养基进行菌体培养,用1.0%的木糖诱导2 h,转化Trans5α来源甲基化的质粒。每组实验设3个平行,对照组用Trans5α来源的质粒转化原始条件下制备的感受态;实验组用GM272来源未甲基化的质粒转化优化条件下制备的感受态。选用了5种不同的质粒pDG1730、pHT01、pBS1C、pBE980b和pHY300plk进行转化,结果如图7和表5所示,概数平板的菌落数,计算转化效率,表中是多次试验的平均数据,可以看到优化条件的转化效率平均比原始条件的转化效率高1–2个数量级,其中来源于GM272的质粒pDG1730利用优化条件转化效率可达到106CFU/µg,这也说明优化的转化条件对枯草芽孢杆菌的质粒具有普适性。
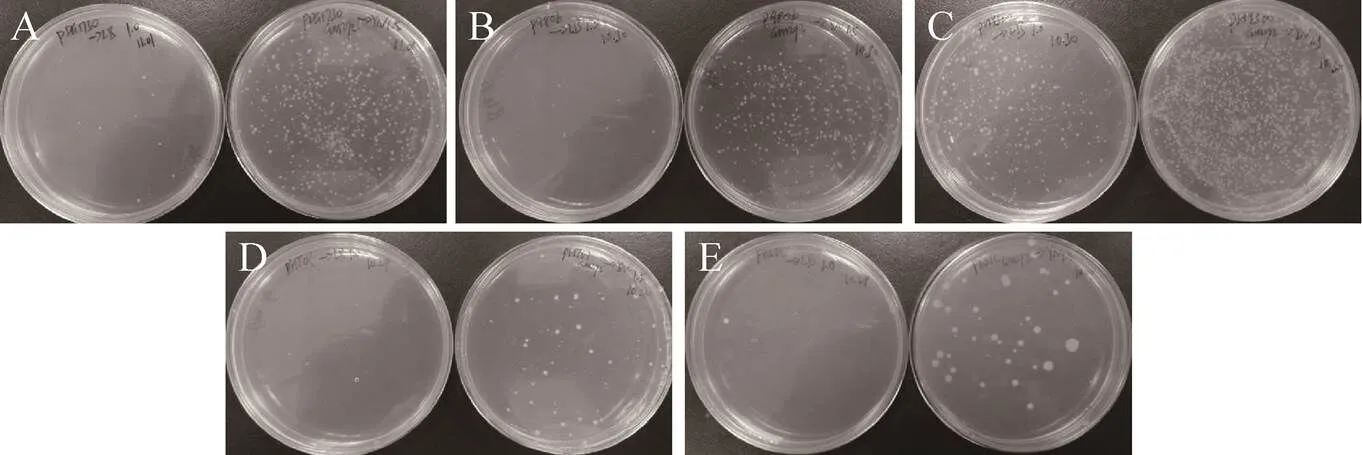
图7 不同质粒检测优化条件与原始条件下制备感受态转化的效果图

表5 不同质粒在优化条件与原条件下制备感受态的转化效率
3 讨论
枯草芽孢杆菌分布广泛安全无毒,在工业酶表达、饲料添加和生物防治等领域被广泛应用。目前基因技术的不断发展,对于基因操作平台的效率要求越来越高,为了消除枯草芽孢杆菌低转化效率的限制,很多研究工作者进行了大量的研究工作,从Canosi的多聚体质粒转化法[5]、Chang的原生质体转化法[7],到Xue的高渗透压电穿孔法[6],再到张晓舟等[14]过量表达感受态转录因子ComK,转化多聚体质粒的方法,枯草芽孢杆菌的转化效率逐渐被提高,转化方法日趋简便。2012年You等[21]在张晓舟的方法基础上,用POE-PCR的方法优化了构建多聚体质粒的过程,从结果可以看到用POE-PCR构建的多聚体质粒转化大肠杆菌的效率远远不及转化完整的环状质粒,而转化枯草芽孢杆菌却比转化完整环状质粒高3个数量级,作者认为主要是因为枯草芽孢杆菌更容易转化多聚体质粒所致,通过本研究结果推测POE-PCR方法构建的多聚体质粒没有甲基化修饰也是转化效率提高的原因之一。枯草芽孢杆菌转化效率的提高可为蛋白质工程 (如定向进化、蛋白突变体库) 等其他生物工程改造提供便利,这样就可以将那些不能利用大肠杆菌进行蛋白质工程分子改造的工业酶,在枯草芽孢杆菌中进行分子改造,极大地发挥枯草芽孢杆菌作为表达宿主的优势。
感受态效率与细胞生长状态、ComK表达情况以及转化用质粒类型都有关,因此本研究在张晓舟的枯草芽孢杆菌SCK6的基础上,对培养基类型、诱导剂木糖浓度以及质粒类型进行了优化探究,最终优化后枯草芽孢杆菌SCK6感受态转化普通枯草芽孢杆菌质粒的效率普遍提高了1–2个数量级,其中转化pDG1730质粒的效率可以达到106CFU/µg,这一结果使得枯草芽孢杆菌在蛋白质工程等方面的应用更为简便。本研究尝试用4种实验室常用的培养基进行感受态制备比较,结果显示用YN培养的细胞密度明显比LB培养的高,感受态效率也相应提高了4倍左右,说明营养贫瘠产生芽孢的条件不适合感受态的形成;用不同浓度木糖去诱导表达的时候,发现当木糖浓度为1.5%时,SCK6感受态细胞内的表达水平最高,转化效率也达到最大。另外,不同质粒类型及质粒上所带的抗生素抗性基因不同也会影响转化效率,未经甲基化修饰的质粒转化效率明显提高。壮观霉素抗性质粒的转化效率高于氯霉素抗性质粒,分析认为在氯霉素抗性基因中可能有SCK6的限制性切割或阻断位点,但是分析已经报道的枯草芽孢杆菌的限制酶,并没有发现相应的位点,也许是其他的DNA切割酶或者是新的限制性酶,尚需进一步研究。
本文在原始条件的基础上,通过优化SCK6感受态的制备条件,利用简单的方法获得了枯草芽孢杆菌的超级感受态,提高了SCK6的转化效率,为枯草芽孢杆菌的蛋白质工程和代谢工程改造奠定了基础。
REFERENCES
[1] Wu SC, Wong SL. Development of improved pUB110-based vectors for expression and secretion studies in. J Biotechnol, 1999, 72(3): 185−195.
[2] Verma D, Satyanarayana T. Production of cellulase-free xylanase by the recombinantand its applicability in paper pulp bleaching. Biotechnol Progr, 2013, 29(6): 1441−1447.
[3] Pohl S, Bhavsar G, Hulme J, et al. Proteomic analysis ofstrains engineered for improved production of heterologous proteins. Proteomics, 2013, 13(22): 3298−3308.
[4] Liu L, Liu YF, Shin HD, et al. Developingspp. as a cell factory for production of microbial enzymes and industrially important biochemicals in the context of systems and synthetic biology. Appl Microbiol Biotechnol, 2013, 97(14): 6113−6127.
[5] Canosi U, Morelli G, Trautner TA. The relationship between molecular structure and transformation efficiency of someplasmids isolated from. Mol Gen Genet, 1978, 166(3): 259–267.
[6] Xue GP, Johnson JS, Dalrymple BP. High osmolarity improves the electro-transformation efficiency of the gram-positive bacteriaand. J Microbiol Methods, 1999, 34(3): 183–191.
[7] Chang S, Cohen SN. High frequency transformation ofprotoplasts by plasmid DNA. Mol Gen Genet, 1979, 168: 111–115.
[8] Spizizen J. Transformation of biochemically deficient strains ofby deoxyribonucleate. Proc Natl Acad Sci USA, 1958, 44(10): 1072–1078.
[9] Wang SX, Li SN, Li HY. Optimization of spore production conditions of strain of producing phytaseZX-29. Hubei Agricultural Sciences, 2014, 53(1): 160–163 (in Chinese).王树香, 李术娜, 李红亚. 产植酸酶枯草芽孢杆菌ZX-29产芽孢条件的优化. 湖北农业科学, 2014, 53(1): 160−163.
[10] D'souza C, Nakano MM, Zuber P. Identification of, a gene of theA operon that regulates the establishment of genetic competence in. Proc Natl Acad Sci USA, 1994, 91(20): 9397−9401.
[11] Smits WK, Eschevins CC, Susanna KA, et al. Stripping: ComK auto-stimulation is responsible for the bistable response in competence development. Mol Microbiol, 2005, 56(3): 604−614.
[12] Van Sinderen D, Venema G. ComK acts as an autoregulatory control switch in the signal transduction route to competence in. J Bacteriol, 1994, 176(18): 5762−5770.
[13] Lu ZH, Zhou YL, Zhang XZ, et al. Sporulation or competence development? A genetic regulatory network smodel of cell-fate determination in. Chin J Biotechnol, 2015, 31(11): 1543–1552 (in Chinese).卢争辉, 周玉玲, 张晓舟, 等. 感受态还是芽胞?细胞命运决定的遗传调控网络. 生物工程学报, 2015, 31(11): 1543–1552.
[14] Zhang XZ, Zhang YHP. Simple, fast and high-efficiency transformation system for directed evolution of cellulase in. Microb Biotechnol, 2011, 4(1): 98−105.
[15] Palmer BR, Marinus MG. Theandstrains of–a review. Gene, 1994, 143(1): 1–12.
[16] Hageman JH, Shankweiler GW, Wall PR, et al. Single, chemically defined sporulation medium for: growth, sporulation, and extracellular protease production. J Bacteriol, 1984, 160(1): 438–441.
[17] Härtl B, Wehrl W, Wiegert T, et al. Development of a new integration site within thechromosome and construction of compatible expression cassettes. J Bacteriol, 2001, 183(8): 2696–2699.
[18] Kirk DG, Palonen E, Korkeala H, et al. Evaluation of normalization reference genes for RT-qPCR analysis ofand four sporulation sigma factor genes ingroup I strain ATCC 3502. Anaerobe, 2014, 26: 14–19.
[19] Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ctmethod. Methods, 2001, 25(4): 402–408.
[20] Russell DW, Zinder ND. Hemimethylation prevents DNA replication in. Cell, 1987, 50(7): 1071–1079.
[21] You C, Zhang XZ, Zhang YHP. Simple cloningdirect transformation of PCR product (DNA multimer) toand. Appl Environ Microbiol, 2012, 78(5): 1593–1595.
(本文责编 郝丽芳)
Preparation and transformation optimization for supercompetentSCK6 cells
Xinzhi Li, Zhenghui Lu, Yuling Zhou, Shiyu Li, and Guimin Zhang
Bioresources Green Transformation Collaborative Innovation Center of Hubei Province, College of Life Sciences, Hubei University, Wuhan 430062, Hubei, China
is Gram-positive aerobic bacterium and widely used as a heterologous protein expression host because of its safety and high protein secretion property. However, comparing to, the low transformation efficiency limits the application ofas a host cell for directed evolution of heterologous enzymes. Therefore, we optimized the competent cell preparation conditions for conventional plasmid, including the alteration of the medium, the concentration of inducer, the plasmid type, and other parameters. Compared with the original LB medium, YN medium improved the transformation efficiency by about 4 folds. The transformation efficiency enhanced by about 2 folds under induction with 1.5% xylose for 2 h. In addition, with plasmids prepared fromGM272 strain the transformation efficiency increased by about 3 folds. Combining all these findings, the transformation efficiency of pDG1730 plasmid under the optimized conditions could reach 106CFU/µg, which was 2 orders of magnitude higher than that the original. Our findings provide references for directed evolution of enzymes and metabolic engineering in.
,gene, xylose, competent cells,pDG1730
Supported by:National Natural Science Foundation of China (No. 31670069), National High Technology Research and Development Program of China (863 Program) (No. 2014AA021303-04).
国家自然科学基金 (No. 31670069),国家高技术研究发展计划 (863计划) (No. 2014AA021303-04) 资助。
September 28, 2016; Accepted: December 15, 2016
Guimin Zhang. Tel: +86-27-88663882; E-mail: zhangguimin6@hotmail.com
网络出版时间:2017-02-13
http://www.cnki.net/kcms/detail/11.1998.Q.20170213.1405.002.html

