质粒pBV220-PTD-tCNTF转化BL21菌株感受态细胞的高效制备方法
吴行伟,刘泽源,李 前,蒲韵竹,任汝通,许秀丽,刘霏霏,张 琴,吴 媛,曲恒燕
(1.解放军总医院,北京 100850;2.军事医学科学院附属医院临床药理室,北京 100071; 3.军事医学科学院毒物药物研究所,北京 100850)
pBV220质粒是由我国科学家自主构建的高效表达载体[1],现已实现了多种活性蛋白的高效表达。CNTF即睫状神经营养因子,它能促使多种神经细胞的存活,是第1个被发现的能维持在体和离体脊髓运动神经元的存活及突起生长的营养因子[2-5];PTD即蛋白转导域,是一种能携带生物大分子穿透生物膜的多肽结构[6]。将改构的CNTF(tCNTF)与PTD连接导入质粒pBV220(pBV220-PTD-tCNTF)后经表达可得到能穿越生物膜的截短式神经营养因子[4],但表达以包涵体形式存在难以纯化。为解决不溶性表达问题我们尝试将易于可溶性表达的改造菌株制作为感受态细胞,转入质粒pBV220-PTD-tCNTF,并探索其高效转化方法。
感受态细胞的制备有很多方法,通常包括物理法和化学法。物理法即电转化法[7-8],此种方法快速高效,但设备昂贵,技术要求高。化学法中最早也最为经典的是氯化钙法,这种方法由Mendel[9]建立于1970年,成为实验室制备感受细胞的一种常规技术,其后在此基础上有很多改进方法。一般认为缓冲液中的Ca2+、Mg2+等二价阳离子可提高转化效率,PEG在浓度为10 g·L-1分子量在8 000和3 350时效果最好,DMSO可提高转化效率,而对于甘油是否能提高转化效率,不同的研究有不同的看法。本实验室以提高质粒转化效率为目的,分别尝试几种制备方法,通过设计实验分析并验证上述常见因素对pBV220-PTD-tCNTF转化感受态细胞转化率的影响,得出最优的水平组合,从而得到具有高转化效率的感受态制备方法,并经测序确定质粒转入的正确性。
1 材料与方法
1.1 材料 经改造后的大肠杆菌BL21菌种由21世纪生物技术研究所曹利民博士惠赠,含有PTD-tCNTF蛋白序列的pBV220质粒(Amp抗性),为军事医学科学院毒物药物研究所构建并保存。
1.2 制备大肠杆菌感受态细胞的方法 氯化钙法采用常规制备方法,INOUE法[10]TSSG法[11]和CaCl2-甘油法[12]分别参照文献方法进行,平行5次。
1.3 质粒的转化 取感受态细胞100 μl(新鲜制备和-80℃保存30 d),冰上放置20 min,低温无菌操作加质粒1 μl,冰浴30 min,42℃热击90 s,立即冰浴2 min,每管加无抗生素LB液体培养基200 μl,37℃ 200 r·min-1振摇1 h,取100 μl涂LB固体培养板(含100 mg·L-1Amp),次日观察菌落数,并计算转化效率。
阴性对照:取经氯化钙法制备的未转化质粒的感受态细胞100 μl涂LB固体培养板(含100 mg·L-1Amp),次日观察菌落数;阳性对照:取经氯化钙法制备的感受态细胞转化质粒后100 μl涂LB固体培养板(无Amp)次日观察菌落数。
1.4 正交设计研究Mg2+、INOUE重悬液、PEG、甘油和DMSO对pBV220-PTD-tCNTF转化感受态细胞即时转化率的影响
1.4.1 正交设计因素水平 试验共设5个影响因素,分别为“培养基与重悬液中Mg2+加与不加”(A),“INOUE重悬与否”(B),“培养中PEG加与不加”(C),“重悬液中甘油加与不加”(D),“重悬液中DMSO加与不加”(E)。参照文献[11],Mg2+采用MgCl2,浓度为50 mmol·L-1,PEG为100 g ·L-1,甘油终浓度为120 g·L-1,DMSO终浓度为70 g· L-1。
1.4.2 实验操作 依据Tab 1正交设计,挑取单克隆菌落至100 ml LB各试验号液体培养基中培养至OD=0.5,冰浴20 min,低温无菌操作向1、3、6、8号培养基中加6 ml DMSO,混匀,分装入50 ml离心管中,4℃ 5 000 r·min-1离心10 min,以各重悬液重悬,4℃ 5 000 r·min-1离心10 min,加2 ml重悬液重悬后100 μl分装。按“1.4质粒的转化”操作转化各试验组所得感受态细胞,并于次日观察菌落数,计算转化效率,并找出最高转化效率的水平组合。
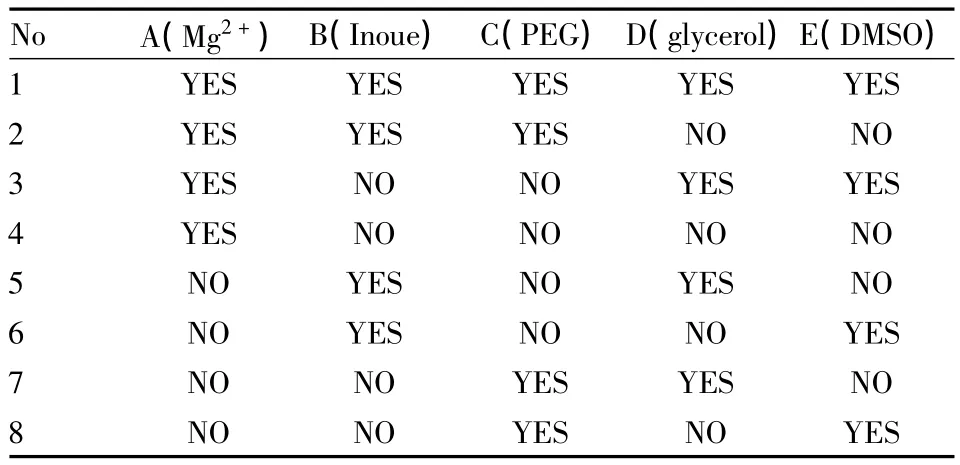
Tab 1 Orthogonal design L8(27)
1.4.3 依据正交设计得出的最佳水平组合重复试验 挑取单菌落活化后于TSSG培养液中37℃,200 r·min-1培养至OD=0.4-0.6,冰浴20 min,加入终浓度60 g·L-1DMSO迅速混匀,4℃,5 000 r·min-1,离心10 min,用含60 g·L-1DMSO的Inoue液30 ml重悬后4℃,5 000 r·min-1,离心10 min,吸出28 ml上清,余液重悬菌体后以100 μl每管分装入预冷EP管,-80℃保存。按“1.3”方法转化,计算转化效率并挑取菌落活化后交由华大基因公司测序。
1.5 转化效率的计算 转化效率即1 μg质粒转化感受态细胞所得的转化子数目,计算公式如下:转化效率(E)=菌落数×稀释倍数/质粒DNA加入量。
1.6 统计学分析 结果分析采用SAS9.1标准版计算平均值及标准差,Excel作图,正交设计结果采用正交设计定量资料的方差分析(GLM过程)进行统计分析。
2 结果
2.1 阴性对照与阳性对照的比较 未转化质粒的感受态细胞涂不含Amp抗生素的LB平板(即阳性对照),菌株长满皿底;未转化质粒的感受态细胞涂含Amp抗生素的LB平板(即阴性对照),皿中无菌落出现(Fig 1)。说明Amp抗生素具有明显抑制无抗性菌株生长的作用,且所用菌株无抗Amp突变菌的出现。
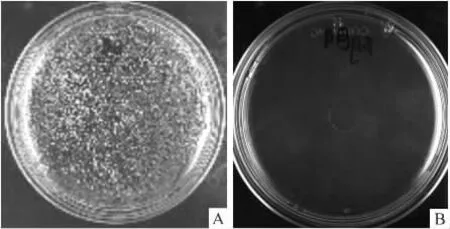
Fig 1 Results of positive control and negative control
2.2 不同大肠杆菌感受态细胞转化率的比较 pBV220-PTD-tCNTF质粒转化4种方法制备的感受态细胞的效率最高的是INOUE法为(8.52±1.22)×107,CaCl2法,CaCl2-甘油法,TSSG法的转化率分别为:(5.43±0.72)×106、(7.45 ±0.65)×106、(9.71±1.81)×106;感受态细胞-80℃保存30 d后的转化效率分别为:CaCl2法(6.20±0.31)×104; CaCl2-甘油法(6.57±0.97)×106;TSSG法(9.76±1.31)× 106;INOUE法(1.63±0.019)×106(Fig 2)。
2.3 正交设计研究Mg2+、INOUE重悬液、PEG、甘油和DMSO对pBV220-PTD-tCNTF即时转化感受态细胞转化率的影响
2.3.1 总模型 F值=22.04,P=0.044,R2=0.9822总模型具有统计学意义。
2.3.2 因素各统计量与各水平平均值 见Tab 3,5个影响因素中A和B的P值小于0.05,说明“Mg2+加否”和“Inoue重悬与否”对转化率影响的差异具有统计学意义,而“PEG加否”,“甘油加否”,和“DMSO加否”对结果影响的差异不具有统计学意义,几个因素中“Inoue重悬与否”P值最小,说明其对pBV220-PTD-tCNTF质粒转化感受态细胞的影响最大。
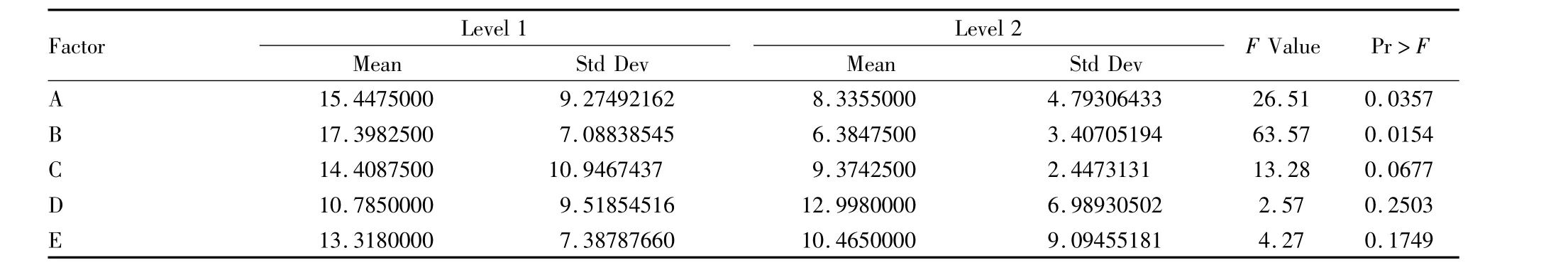
Tab 2 Statistics of the factors and mean values of each level to its factors(×106)
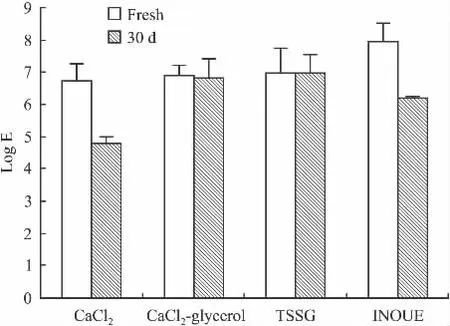
Fig 2 Logarithms to transformation efficiencies of 4 approaches to get competent cells immediately and after a storage for 30 days
ABCE的1水平平均值均大于2水平,其中B因素“Inoue重悬与否”的平均值差异最大,其次是A因素“Mg2+加否”;D因素“甘油加否”1水平平均值小于2水平,说明甘油对pBV220-PTD-tCNTF转化感受态细胞有抑制作用,其他因素可提高其转化效率。
由上述结果得到最优的水平组合为A1B1C1D2E1,与预测相符。重复最佳水平组合试验得到的转化率为(29.63± 4.95)×107。
2.4 最优组合制备菌样测序 将最优组合制备并转化好的BL21菌株交由华大基因测序公司进行测序,结果显示,转化生长的菌体含有pBV220转入的PTD-tCNTF基因序列,并无突变序列的存在。
3 讨论
本试验所用4种方法除了TSSG缓冲液之外其余缓冲液中皆有CaCl2的使用。从4种方法的转化率比较看来,CaCl2法对质粒pBV220-PTD-tCNTF转化大肠杆菌BL21的效率偏低,且-80℃保存30 d后的转化率降低程度很大。加15%甘油后的转化率有些许提高,且-80℃保存30 d后的转化效率提高很多,说明甘油作为冻存保护剂对于保持感受态细胞转化效率具有积极的效果。本实验也尝试了代红星等[11]在TSS法的基础上改进的TSSG法,按其报道方法操作得到的转化效率,约为CaCl2法的两倍,TSSG法被称为“一步制备法”,这种方法简便易行,不需低温离心,对于缺乏低温离心设备的实验室是理想的选择。最早的INOUE法是Castumase等[13]在1995年报道的,后在其基础上有少许改进,这种方法转化率非常高,被称为“超高效法”,但其-80℃的保存转化效率有一定程度的降低。
影响质粒转化感受态细胞转化效率的因素有很多,如质粒大小不同,所得的转化效率就不一致,一般4~7.3 kb时差别不大,质粒越大转化效率相应的会越低,pBV220-PTD-tCNTF约为3.7 kb,属于较小的质粒,故转化率比大的质粒稍高。各考察因素对pBV220-PTD-tCNTF转化感受态细胞转化率的影响中INOUE重悬液的重悬与否对结果的影响最大,其与重悬液中Mg2+添加与否在95%的置信区间内均具有统计学意义,INOUE重悬液中含有Mn2+、Ca2+、K+和PIPES,可见各种金属阳离子的存在可明显提高pBV220-PTD-tCNTF转化感受态细胞的转化效率。正交设计结果显示因素PEG3350的P值为0.0677,说明其对本实验的转化效率有一定影响,从其转化效率的平均值来看,培养基中加PEG3350有助于提高pBV220-PTD-tCNTF转化感受态细胞。因素D重悬液中甘油添加与否和因素E DMSO添加与否的P值均大于0.05,说明从统计学角度来看甘油和DMSO的添加对于本实验的转化效率没有明显影响,而从平均值来看添加甘油是不利于提高转化效率的。在CaCl2-甘油法与单纯CaCl2法的比较中可发现添加甘油有助于提高保存转化效率。而TSSG法中未添加甘油也得到了很高的保存转化效率,说明DMSO也可能具有较好的提高保存转化效率的作用。实验得到的最优组合基本符合各因素的影响方式,且确定了甘油对转化效率的抑制作用。
在实验设计方面采用L8(27)正交设计这种方法的优点是可以通过牺牲因素间的交互作用来达到减少试验次数的目的。本实验因素全组合(含重复试验)的最少试验次数为26,即64次,而采用正交设计只需8次试验即可达到观察每个因素对结果的影响,且正交表中空白两列可用来估计实验误差,达到了节约试验成本的目的。
PTD蛋白与CNTF结合后可携带后者透过生物屏障,使其更好的发挥治疗神经系统疾病的效应。采用pBV220载体后虽然对融合蛋白有很高的表达效率,但由于包涵体的存在,蛋白的纯化与复性成为其具继续成药的瓶颈。本实验我们采用PBV220-PTD-tCNTF质粒转化经基因工程改造过的大肠杆菌BL21,得到了占总表达量约40%的可溶性表达蛋白,为后续目的蛋白的大量获得开辟了道路。
[1] 张智清,姚立红,侯云德.含PRPL启动子的原棱高效表达载体的组建及其应用[J].病毒学报,1990,6:111-6.
[1] Zhang Z Q,Yao L H,Hou Y D.Construction and application of a high level expression vector containing PRPLpromoter[J].Chin J Virol,1990,6:111-6.
[2] Sendner M,Arakawa Y,Stockli K,et al.Effect of ciliary neurotrophi factor on motonneuron survival[J].Cell Sei Suppl,1991,15:103-9.
[3] 石向群,陈兴洲,陆兵勋.睫状神经营养因子及受体的研究进展[J].国外医学·脑血管疾病分册,1999,7(2):76-9.
[3] Shi X Q,Chen X Z,Lu B X.The research progression of CNTF and it,s receptor[J].Cerebrovascul Dis Fore Med Sci,1999,7(2): 76-9.
[4] 曲恒燕,刘泽源,李媛媛,孙曼霁.TAT-tCNTF融合蛋白对Aβ25-35诱导SH-SY5Y细胞损伤的保护作用[J].中国药理学通报,2010,26(4):442-6.
[4] Qu H Y,Liu Z Y,Li Y Y,Sun M J.Protective effects of TAT-tCNTF fusion protein on SH-SY5Y cells induced by β-amyloid peptide(25-35)[J].Chin Pharmacol Bull,2010,26(4):442-6.
[5] 张予阳,于庆海.神经营养因子对缺血性脑损伤的影响及其药物调节[J].中国药理学通报,2003,19(3):261-4.
[5] Zhang Y Y,Yu Q H.Effects of neurotrophic factors on ischemic damage and the regulation by medicines[J].Chin Pharmacol Bull,2003,19(3):261-4.
[6] Gump J M,Dowdy S F.TAT transduction:the molecular mechanism and therapeutic prospects[J].Trends Mol Med,2007,13 (10):443-8.
[7] Dower W J,Miller J F,Ragsdale C W.High efficiency transformation of E.coli by high voltage electroporation[J].Nucleic Acids Res,1988,16:6127-45.
[8] Potter H.Application of electroporation in recombinant DNA technology[J].Methods Enzymol,1993,217:461-83.
[9] Mandel M.Calcium dependent bacteriophage DNA infection[J].Mol Biol,1970,53(1):159-62.
[10]杨 坤,巩振辉,李大伟.大肠杆菌高效感受态细胞的制备及快捷转化体系的建立[J].北方园艺,2010(14):127-30.
[10]Yang K,Gong Z H,Li D W.The preparation of super E.coli competent cell and the establishment of fast plasmid transformation into E.coli[J].North Horticult,2010(14):127-30.
[11]代红星,张庆桥,樊宝良.一种简捷有效的大肠杆菌感受态细胞制备方法[J].安徽农业科学,2008,36(29):12627-8.
[11]Dai H X,Zhang Q Q,Fan B L,A simple and effective method for preparation of E scherichia coli competent cells[J].J Anhui Agr Sci,2008,36(29):12627-8.
[12]刘卫今,蒋 勇,完迪迪.简单高效的感受态细胞制备和质粒转化体系的建立[J].安徽农业科学,2008,36(7):2745-6.
[12]Liu W J,Jiang Y,Wan D D.Study on a simple and efficient preparation of competent cell and the establishment of plasmid transformation system[J].J Anhui Agr Sci,2008,36(7):2745-6.
[13]Castuma C E,Huang R P,kornberg A,Reusch R N.Inorganic polyphosphosphates in the acquisition of competence in Escherichia coli[J].JBC,1995,270(22):19280-3.
