毕赤酵母高密度发酵产Ⅲ型类人胶原蛋白及其胃粘膜修复功能
李伟娜,尚子方,段志广,李林波,贺婧,范代娣
毕赤酵母高密度发酵产Ⅲ型类人胶原蛋白及其胃粘膜修复功能
李伟娜1,2,尚子方1,2,段志广1,2,李林波1,2,贺婧1,2,范代娣1,2
1 西北大学化工学院陕西省可降解生物医用材料重点实验室,陕西西安 710069 2 西北大学化工学院陕西省生物材料与发酵工程技术研究中心,陕西西安 710069
为提高重组毕赤酵母发酵重组人Ⅲ型胶原蛋白产量,采用响应面对其生长阶段的BMGY培养基(Buffered minimal glycerol-complex medium) 组成进行优化。通过Placket-Burman试验,得出酵母提取物、蛋白胨、甘油对胶原蛋白产量有显著影响,通过Box-Behnken中心组合实验以及Design-Expert分析软件建立了以胶原蛋白产量为响应值的响应方程,得到最适浓度分别为酵母提取物1.13%,蛋白胨1.61%,甘油0.86%。经实验验证,在最优BMGY培养基条件下培养12 h后,所得到毕赤酵母干重为4.41 g/L,生长阶段的菌重量增加了26%。在22 L发酵罐中通过高密度发酵,产量达到4.71 g/L。该重组胶原蛋白对大鼠乙酸灼伤胃粘膜有明显修复作用,为生物医用材料的应用制备奠定了基础。
毕赤酵母,重组人Ⅲ型胶原蛋,响应面优化法,胃粘膜
胶原蛋白是结缔组织中最主要的结构蛋白,对维持细胞形态、维护生物组织和器官的正常生理功能和损伤修复都有着重要作用[1-2]。因良好的生物相容性、生物可吸收性和促新细胞形成等特征,广泛应用于包括生物医用材料、化妆品、食品工业、医药和印染等领域[3]。相比酸、碱水解法或酶解法从动物的皮和骨组织中提取并纯化过程中易带来病毒隐患、生物功效和临床疗效不稳定等问题,利用基因工程技术重组表达胶原蛋白成为研究热点和研究方向[4-5]。
嗜甲醇酵母菌主要应用于基因工程蛋白的表达[4,6]。相比哺乳动物细胞,具有真核蛋白质合成途径的不要求复杂的生长培养基或培养条件,在基因水平上比较容易操纵[7]。一般可以通过培养基的优化设计、发酵过程关键参数的调控以及甲醇诱导等发酵控制策略实现的高密度发酵[8]。Placket-Burman (PB) 设计是一种高效筛选重要影响因素的统计方法[9],近年来应用广泛的响应面分析方法 (RSM) 可预测响应值以及研究因素间交互作用,并且已成功应用于多例发酵培养基成分优化中[10-11]。
消化性溃疡是消化系统的常见病、多发病,一般认为主要与胃粘膜的攻击因子和防御因子之间的失衡有关,以胃粘膜防御能力的减弱为主。服用抗酸性药物如西咪替丁、沙漠替丁等可缓解,但易引起多种并发症[12]。结合类人胶原蛋白具有的良好生物学相容性、细胞黏附性、促新细胞形成和止血功能,推测胶原蛋白对于粘膜治愈方面能够发挥很大的优势[10-14]。
重组胶原蛋白发酵属于分段式发酵,与产物生成紧密相关的诱导阶段发酵已经经过优化[15],因此本研究对菌体生长阶段所需具有缓冲能力的甘油混合培养基 (BMGY培养基参数,包括酵母提取物、蛋白胨、甘油、硫酸铵、酵母氮碱和生物素等) 进行优化。首先通过PB设计确定对胶原蛋白产量影响的重要参数并以RSM进行优化,然后在22 L生物工程(Bioengineering) 发酵罐中进行高密度发酵。最后,以造模成功率最高 (接近100%)、稳定性良好的大鼠乙酸性胃黏膜损伤模型研究类人胶原蛋白对乙酸性胃溃疡的修复作用,探究重组人Ⅲ型胶原蛋白对胃溃疡治疗的效果。
1 材料与方法
1.1 材料
大肠杆菌DH5α感受态细胞购自TaKaRa公司。巴氏毕赤酵母GS115宿主菌株为本实验室保存。表达载体穿梭质粒pPIC9k购自Invitrogen 公司。实验动物SPF级健康雄性SD大鼠20只,体重100−120 g,购于西安交通大学医学部实验动物中心。
1.2 仪器
瑞士Bioengineering 22 L发酵罐,发酵在线控制器,空气压缩机;纯氧瓶;高速冷冻离心机,湖南湘仪有限公司;电子分析天平:瑞士Mettler 公司;蛋白电泳仪:美国BioRad公司;酶标仪Power Wave XS2:美国Gene公司;分光光度计Model 2082PCS:美国UNICO;真空冷冻干燥机:美国Labconco公司。
1.3 方法
1.3.1 菌种和培养基
选择本实验室自构建的重组GS115为实验菌种,表达载体为pPIC9k。AOX1基因的启动子受甲醇强烈诱导,使其能够利用甲醇作为唯一碳源快速生长并表达分泌性人Ⅲ型胶原蛋白[16]。GS115中重组人Ⅲ型胶原蛋白载体的构建和蛋白的表达方法参考文献[16]。
1.3.2 细胞生长条件
生长阶段的细胞在YPD (酵母提取物1%,蛋白胨2%,葡萄糖2%,琼脂2%) 中培养,30 ℃、24 h。在25 mL BMGY缓冲培养基 (酵母提取物1%,蛋白胨2%,0.1 mol/L pH 6.0磷酸钾缓冲液,酵母氮碱1.34%,生物素4×10–5%,甘油1%) 中操作,220 r/min、18 h后,室温1 500−3 000×离心5 min,收集菌体细胞。轻轻倒出上清液,将底部菌体重悬至600为1.0,然后在BMMY (buffered methanol- complex medium) 培养基中诱导表达[15],培养基成分为发酵培养基成分:酵母提取物1.19%、蛋白胨2.1%、甲醇1.18%、酵母氮碱0.3%、硫酸铵0.77%和生物素4.5×10–5%。
1.3.3 分析方法
分光光度计通过浊度测定600的细胞密度。用BandScan 5.0软件分析胶原蛋白SDS-PAGE条带所占比例,然后乘以其对应的总蛋白含量,计算出相应胶原蛋白含量。
1.3.4 过程参数优化
通过PB设计确定重要参数。筛选发酵培养基中对毕赤酵母细胞生长量有显著影响的浓度参数:酵母提取物、蛋白胨、甘油、酵母氮碱、硫酸铵和生物素。对每个因素分别选取高、低水平,以胶原蛋白产量作为响应值,PB试验设计如表1所示。用Design-Expert 8 (Stat-Ease, Inc., Minneapolis, MN, USA)软件对各因素效应分别进行检验,根据因素置信度高低,选取显著因素作进一步考察。
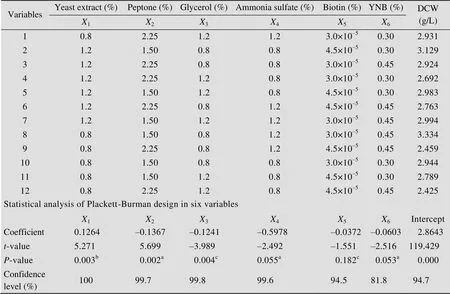
表1 因素水平PB试验设计对应细胞生长结果及各因素效应的统计分析
Note:2=95.33%;2(adj)=89.72%;aNon-significant at<0.05;bSignificant positive effect;cSignificant negative effect.
响应面法分析。重要参数确定后采用快速爬坡实验进行三因素三水平实验设计,每个因素分别设计因素水平中心点和最低、最高水平,细胞干重为响应值。因素与编码水平如表2所示,根据Box-Behnken试验设计及输入变量预测二次方程。运用Design-Expert 8软件响应面分析程序对17组试验的响应值进行回归分析,经过回归方程拟合,根据回归方程的方差分析及模型可信度分析,以验证模型的有效性。
1.3.5 毕赤酵母高密度发酵
在22 L发酵罐中对毕赤酵母进行大规模诱导表达,发酵罐搅拌转速500 r/min,罐压0.1 Mpa,溶氧维持在20%以上。当600为20左右时,发酵罐中接种2 L BMGY种子培养基。甘油间歇补料,开始补甘油 (含12 mL/L PTM1微量元素的50%甘油),补料速度为每L初始发酵体积18 mL/h,温度和pH分别维持在28.5 ℃和5;流加甘油阶段,搅拌速度逐渐增加到900 r/min;培养液溶氧水平突然增加,表明培养基中的甘油消耗完全。以含12 mL/L PTM1微量元素溶液的纯甲醇启动诱导,采取60 s控制阶段以维持30%左右的溶解氧水平。诱导维持约78 h,定时收集样品以检测培养上清液中的细胞生长 (600)和蛋白浓度。
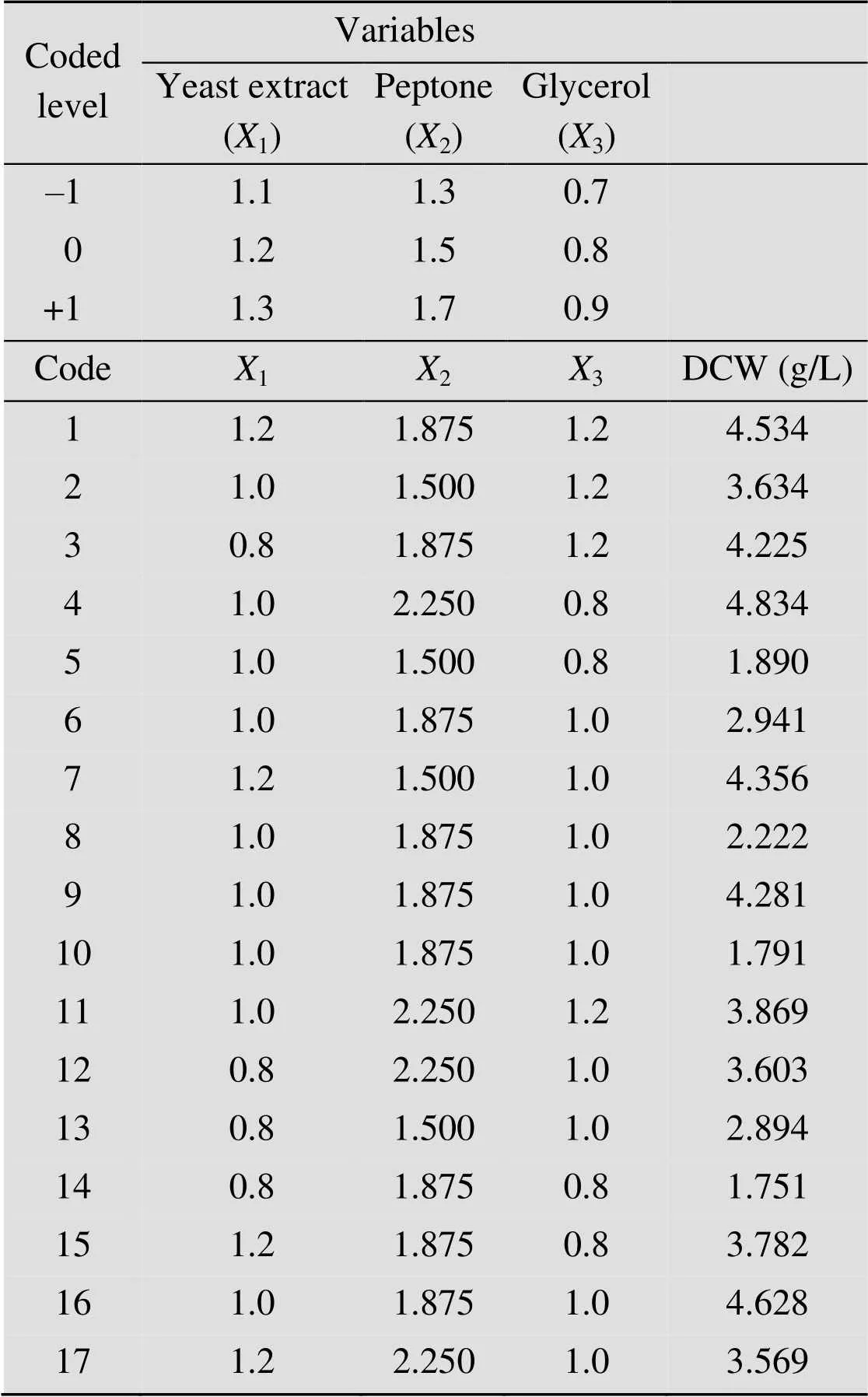
表2 BBD试验因素编码水平、试验设计和实验结果
Note:1=(1−1.2)/0.1;2=(2−1.5)/0.2;3= (3−0.8)/0.1.
1.3.6 蛋白的分离纯化
收集酵母发酵液,4 ℃、8 000 ×离心20 min,收集上清。乙醇沉淀,溶解、过滤、硫酸铵分级沉淀,收集沉淀蛋白并用磷酸缓冲液 (PBS) 溶解。经超滤样品用CM琼脂Fast Flow柱层析,上样,用0.01 mol/L PBS (pH 6.0) 平衡柱子,然后用0−1.0 mol/L的氯化钠溶液梯度洗脱,收集蛋白峰。层析后的样品负载于Sephadex G-100脱盐,紫外检测波长为215 nm,收集目的蛋白[17]。
1.3.7 类人胶原蛋白修复大鼠的乙酸性胃溃疡
将20只雄性大鼠分2组,每组10只,分笼喂养,在实验室条件下正常喂养2 d,使其能够更好地适应环境;胃溃疡模型建立前24 h禁食不禁水。如图1所示,大鼠腹腔注射麻醉药麻醉后,仰卧固定,上腹部皮肤正中切口,切开腹腔找到胃,于胃体与幽门部分界处血管最少的区域内,用微量注射器在胃窦前壁注入50 μL 20%乙酸溶液达胃壁肌层与浆膜层之间,将大网膜组织与注射部位的浆膜组织缝合一针,关闭腹腔,缝合,术后单笼饲养,模型建立完成。模型建立后第3天开始,每日灌胃给药1次 (模型组为生理盐水,实验组为类人胶原蛋白),灌胃量0.8 mL/200 g,连续给药7 d,末次给药1 d后脱臼处死。打开大鼠腹壁并结扎贲门、幽门,向胃内注入1%甲醛溶液10 mL,然后将胃浸泡于10%甲醛溶液中固定15 min。沿胃大弯剪开胃壁,生理盐水冲洗。
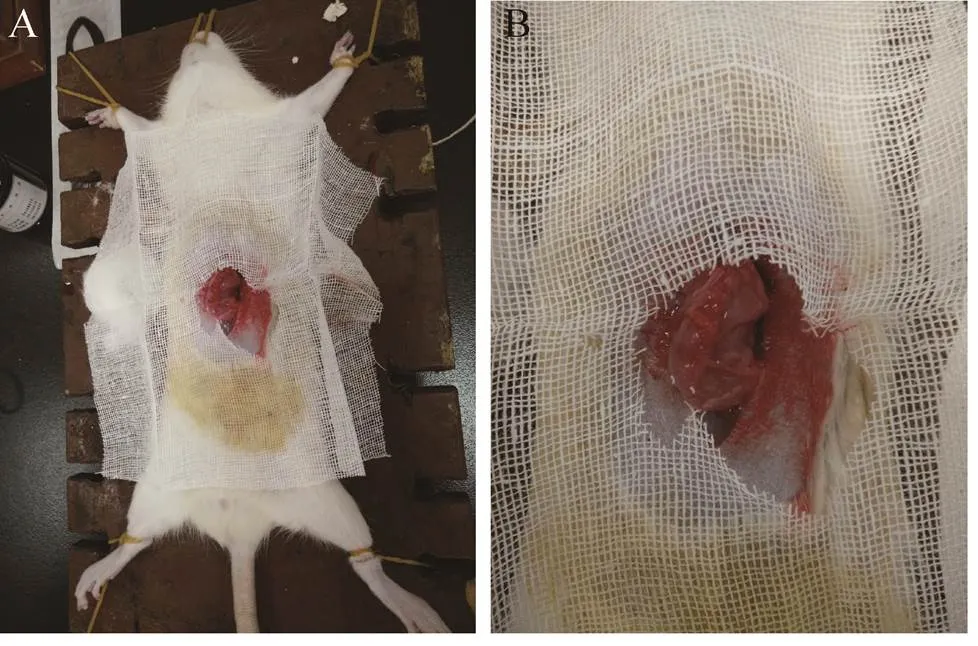
图1 大鼠胃粘膜修复实验建模过程中大鼠仰卧固定 (A),切开大鼠腹壁在腹腔找到胃 (B)
2 结果与分析
2.1 PB设计实验筛选参数
复杂的营养成分为微生物生长和生产次级代谢物所必需,营养原料是控制该菌体生长合成的关键[18]。从发酵培养基参数:酵母提取物、蛋白胨、甘油、酵母氮碱、硫酸铵和生物素中筛选出对胶原蛋白产量有显著影响的浓度参数,通过PB设计实验对这6个因素进行12组实验,结果见表1。PB设计得到的细胞干重变化范围在2.42–3.33 g/L之间。通过检验筛选有显著影响的变量。<0.05说明该因素对响应有显著影响。如表1所示,为0.002的蛋白胨确定为最重要影响因素,其次为酵母提取物(0.003) 和甘油(0.004)。因此,选取这3个因素作为显著因素用于后续优化研究。
2.2 Box-Behnken设计实验
采用响应面分析法中的Box-Behnken设计法,进一步研究关键因素,对筛选的3因素取3个水平,Box-Behnken设计及其实验结果如表2,预测值和实验值接近,实验细胞干重最低、最高值分别为1.75 g/L,4.83 g/L。对细胞干重进行二次回归拟合,得到对蛋白胨(1)、酵母提取物(2) 和甘油(3) 带交互项和平方项的三元二次方程:
DCW= 4.43 – 0.0771+ 0.0592+ 0.923– 0.331–0.602–1.133–0.5812–0.2613– 0.04423。
上述拟合模型的2=95.87%,调整后的2= 89.67%,这表明该拟合模型只有约10.33%的变量无法被其解释,说明该模型拟合性良好。回归方程的方差分析结果见表3,可以看出,该拟合模型的失拟项=0.051>0.05,表明模型失拟不显著,另外=0.000,失拟值=0.945也说明回归显著,曲面效应显著。
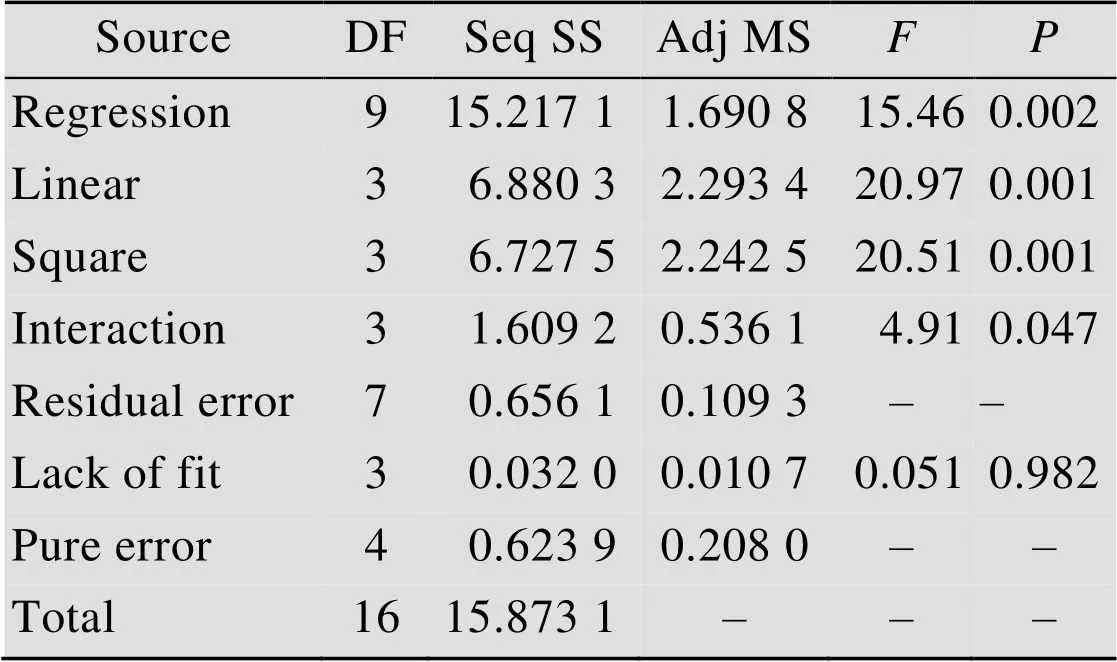
表3 用于细胞干重优化的拟合多项式回归方程的方差分析
2.3 响应曲面分析
3D响应面和2D等高线图是回归方程的图形表示[19],如图2A、B、C所示,通过响应面及等高线图,更直观地判断各两两因素对因变量 (细胞生长量) 的影响,优化浓度范围。
图2A为甘油浓度取中间水平时,酵母提取物与蛋白胨对毕赤酵母菌体生长量的影响。等高线图相对椭圆的轮廓可知,在整个酵母提取物浓度范围内,随蛋白胨含量的增加,细胞生长量不断提高,但是蛋白胨浓度高于1.5% (零水平) 时,细胞生长量随蛋白胨浓度的增加而逐渐降低。和Plackett-Burman的结果相符合,蛋白胨在酵母提取物和蛋白胨对毕赤酵母菌体生长量的影响中占主要地位。
图2B为当蛋白胨为零水平时,在整个酵母浓度范围内,甘油低于0水平 (浓度0.7%–0.8%) 时,毕赤酵母菌体产量的增加随着二者含量的增加而不断提高;而甘油浓度高于零水平 (0.8%–0.9%) 时,其生长量随甘油含量的增加而逐渐降低。因此,甘油在蛋白胨和甘油对毕赤酵母菌体生长量的影响中占主要地位。
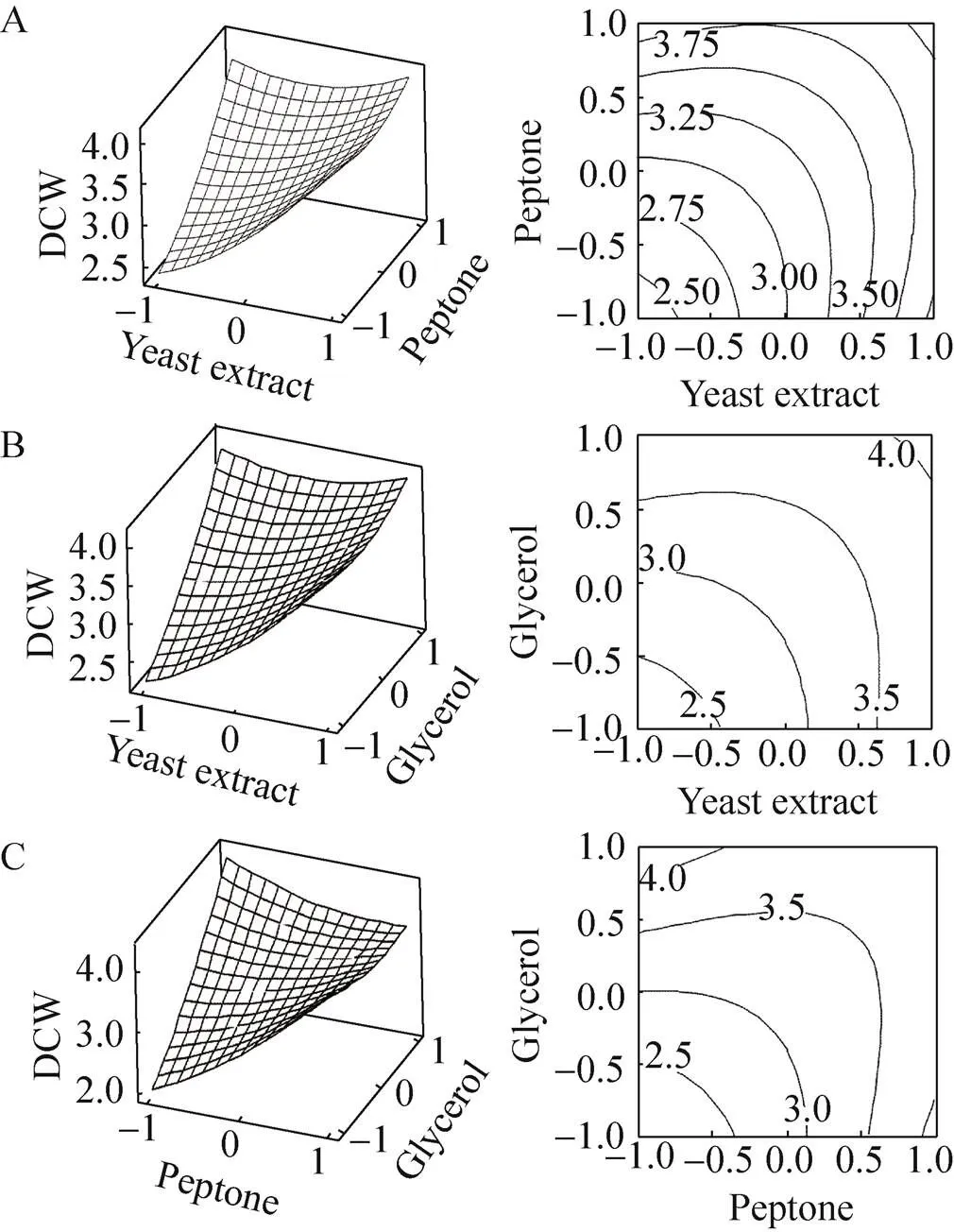
图2 酵母提取物与蛋白胨 (A)、酵母提取物与甘油 (B)、蛋白胨与甘油 (C) 交互影响胶原蛋白产量的响应面和等高线图
图2C为以酵母提取物浓度取中间水平时,在整个蛋白胨浓度范围内,毕赤酵母菌体生长量随着甘油和蛋白胨浓度的增加而提高,而当甘油浓度高于零水平 (0.8%–0.9%) 时,其生长量随甘油含量的增加而逐渐降低。由此可见,甘油在蛋白胨和甘油对毕赤酵母菌体生长量的影响中占主要地位。
2.4 模型验证实验结果分析
对回归方程中的各个变量求一阶偏导数,求得1、2、3对应真实值分别为酵母提取物1.13%,蛋白胨1.61%,甘油0.86%,再将真实值代入方程式中,算出细胞干重最优值为4.44 g/L。
重新活化菌种,经种子液培养,然后接种到BMGY培养液中,保持其他条件相同,经过12 h BMGY培养基培养,收获菌体进行测定,所得毕赤酵母干重平均值为4.41 g/L。相对于之前未优化培养基培养的毕赤酵母干重值3.50 g/L,高出26%。因此该响应面法对培养基优化结果可靠,达到了较好的优化效果。
2.5 高密度发酵工艺
表达系统成本低、表达量高、能对外源基因进行正确翻译和修饰等优势;近来在发酵罐培养重组蛋白表达方面的优势日益显现[20-21]。
根据响应面优化工艺控制参数,菌体生长曲线和目的蛋白表达曲线如图3所示。已知经BMMY发酵培养基成分优化,诱导期表达系统生产重组人Ⅲ型胶原蛋白的量成功增加了19.3%[15]。甲醇流加方式对细胞代谢的影响表明,相较脉冲方式,间歇甲醇流加更有利于目的蛋白的生产[22]。我们采取两段式补料,在甲醇诱导补料初期,细胞开始从以甘油生长状态转变为以甲醇为碳源诱导表达的生长状态需要一定适应期,如图3A所示,第27小时甲醇诱导补料时,菌体细胞生长极其缓慢,在甲醇诱导初期前3 h设定甲醇流加量为3.6 mL/(h·L),经过3−5 h适应期,菌体逐渐适应利用甲醇为碳源的环境,菌体密度开始逐渐增加,目的蛋白也开始诱导表达。当酵母菌体细胞完全适应甲醇的代谢后,菌体生长繁殖增快,根据溶氧变化逐渐加大甲醇补加速率。随着酵母菌体细胞密度的增加,蛋白表达量也逐渐增加。在甲醇诱导33 h左右,菌体浓度600达到240。
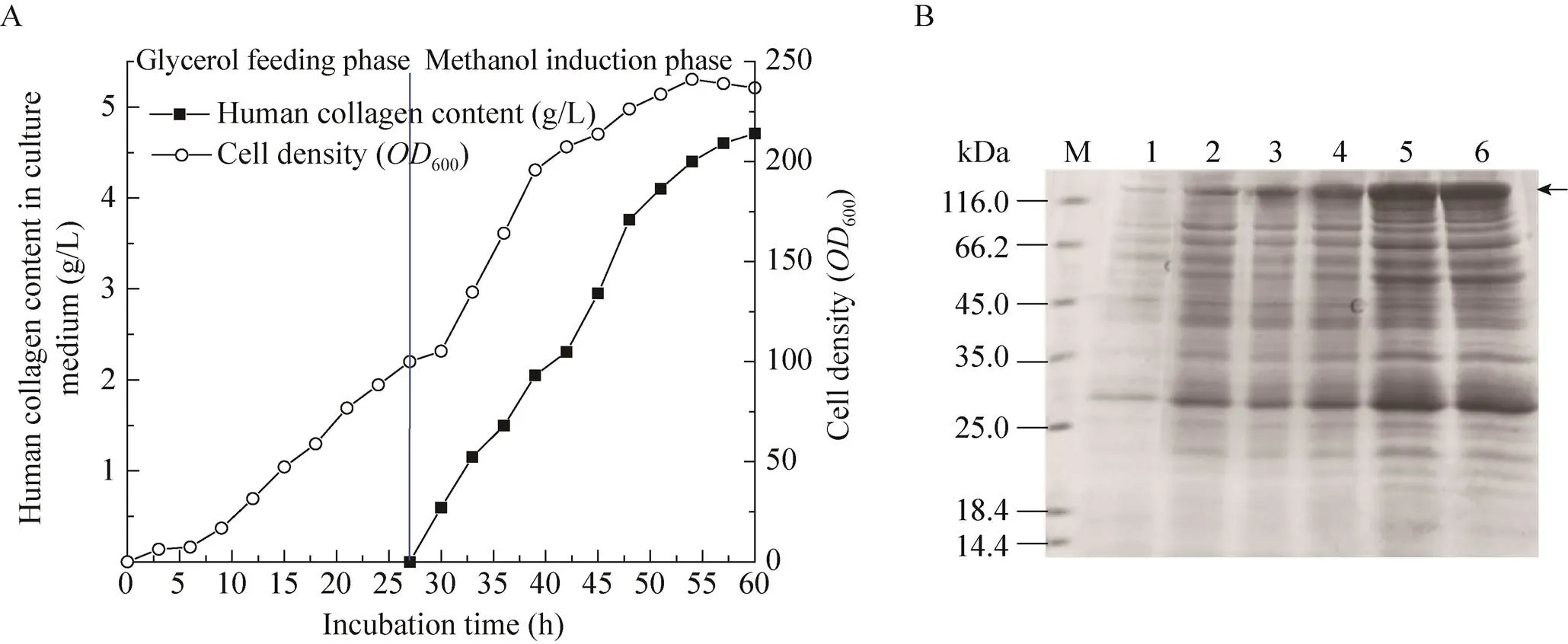
图3 高密度发酵菌体生长和目的蛋白表达曲线(A) 和发酵中不同时间点蛋白SDS-PAGE分析 (B)
分析不同时间点发酵液上清蛋白SDS-PAGE,结果见图3B。目的蛋白表达量逐渐增加,同时蛋白降解。当酵母细胞培养到54 h时,即诱导27 h左右,菌体量、目的蛋白表达量趋于稳定,继续发酵目的蛋白增加量不多,因菌体密度过大自溶释放胞内酶,造成对目的蛋白的降解。因此,甲醇诱导第33小时时,停止发酵。经蛋白浓度检测,发酵培养到60 h时,目的蛋白表达量最高,可达4.71 g/L。
2.6 类人胶原蛋白促进胃粘膜修复的生物功效
类人胶原蛋白可通过影响细胞膜,增强细胞贴壁生长功能而促进细胞生长[19],以前课题组的实验结果显示类人胶原蛋白具有促进上皮细胞、成纤维细胞生长的功效[23-24],能促进溃疡愈合。课题组研究的外用类人胶原蛋白口腔粘膜修复液治疗溃疡安全有效,能显著缩短溃疡愈合时间,已经获得国家医疗器械注册许可进入市场。本研究旨在研究实验室构建的系列类人胶原蛋白在粘膜修复方面其他的潜在用途,课题组以胃溃疡作为粘膜修复模型,建立了乙酸致慢性胃溃疡模型[25]。本文利用重组类人胶原[26]、Ⅰ型、Ⅲ型胶原蛋白α1链修复大鼠的乙酸性胃溃疡,研究HLC对乙酸性胃溃疡的修复作用。
在本次动物实验中,动物溃疡模型建立后,分别用类人胶原蛋白与重组的类人Ⅰ、Ⅲ型胶原蛋白α1链进行修复对比,观察不同的人源型胶原HLC对乙酸性胃溃疡的修复效果。由图4可以看出,给药胶原蛋白实验组的大鼠胃粘膜都有一定程度的修复。在给药1周后,其中类人胶原蛋白的修复效果最佳,已基本修复为正常水平,胃内粘膜光滑未见溃疡斑点,类人胶原Ⅰ型和Ⅲ型胶原α1链相对于模型组也有比较好的修复效果,但修复效果弱于类人胶原蛋白,而胃溃疡后单纯补给生理盐水的模型组的溃疡部位不能随着时间延长自行修复。实验结果同时显示,类人胶原蛋白治疗乙酸损伤胃黏膜大鼠时未发现毒副作用,大鼠生长正常 (图5)。类人胶原蛋白及其系列重组人源型Ⅰ型、Ⅲ型胶原α1链均可用于胃溃疡粘膜的修复,其作用效果初步获得实验验证。
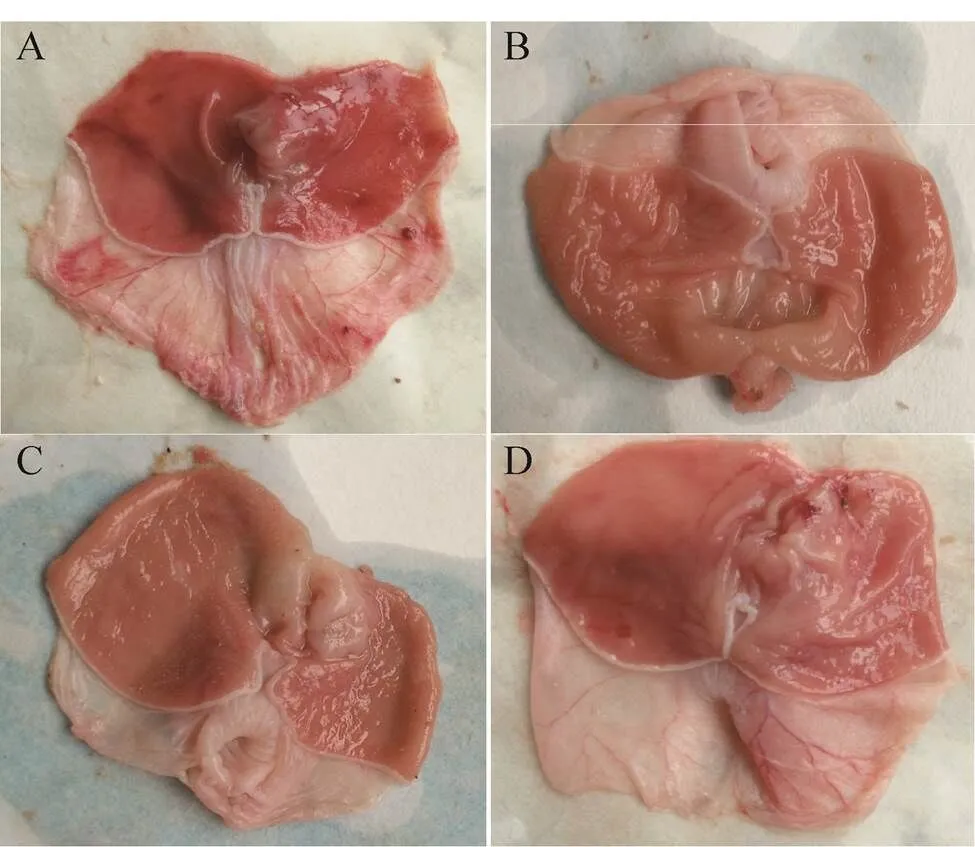
图4 模型组(A) 与实验组类人胶原蛋白 (B)、Ⅰ型(C) 和Ⅲ型 (D) 大鼠胃部解剖图
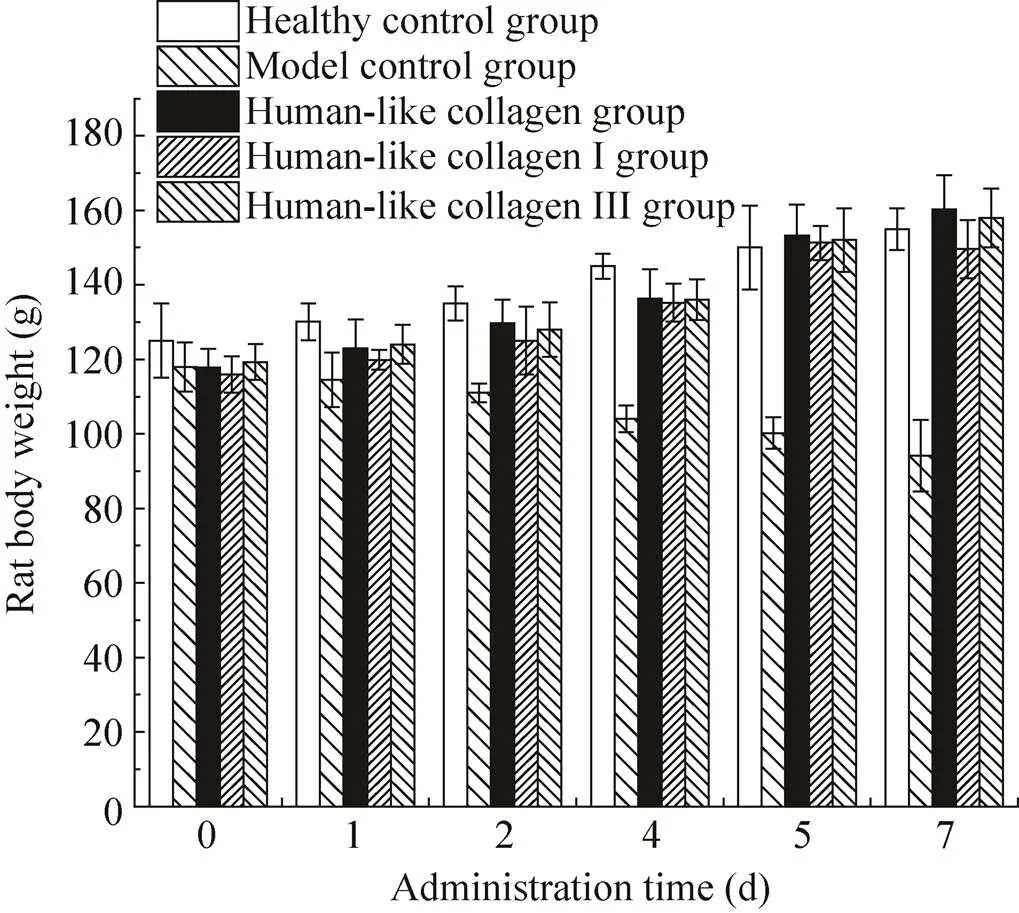
图5 健康对照组、模型对照组与实验组类人胶原蛋白、Ⅰ型和Ⅲ型大鼠给药治疗前后体重变化
后续还需要进一步通过以下两方面实验验证:1) 确定类人胶原蛋白对胃溃疡作用的量效关系。研究不同剂量的胶原蛋白在修复胃溃疡模型时对溃疡指数、溃疡抑制率及对病灶部位的修复程度进行组织学观察;2) 研究类人胶原蛋白对乙酸性胃溃疡黏膜的修复机制。测定胃组织碱性成纤维细胞生长因子(bFGF)、表皮生长因子(EGF)、肿瘤坏死因子(TNF-β) 的水平等,为进一步开发功效性药食兼用的粘膜修复药物提供基础数据。
3 结论
对表达系统生产重组人Ⅲ型胶原蛋白的BMMY发酵培养基成分 (酵母提取物1.13%、蛋白胨1.61%、甘油 0.86%、硫酸铵0.8%、酵母氮碱0.3%和生物素4.5×10–5%) 进行优化,使得重组人Ⅲ型胶原蛋产量成功增加了19.3%。采取甲醇间歇流加补料,在22 L自控发酵罐上进行类人胶原蛋白高密度发酵,产量达到4.71 g/L,对于后期工业发酵过程的工艺优化和生产成本的缩减有重要意义。实验结果同时显示,类人胶原蛋白治疗乙酸损伤胃黏膜大鼠时未发现毒副作用,大鼠生长正常。类人胶原蛋白及其系列重组人源型Ⅰ型、Ⅲ型胶原α1链均可用于胃溃疡粘膜的修复,其作用效果初步获得实验验证。
REFERENCES
[1] Yu XY, Tang CE, Xiong SB, et al. Modification of collagen for biomedical applications: a review of physical and chemical methods. Curr Org Chem, 2016, 20(17): 1797–1812.
[2] Gelse K, PöschlE, Aigner T. Collagens—structure, function, andbiosynthesis. Adv DrugDeliverRev, 2003, 55(12): 1531–1546.
[3] deshmukh SN, Dive AM, Moharil R, et al. Enigmatic insight into collagen. J Oral Maxillofac Pathol, 2016, 20(2): 276–283.
[4] Yang LX, Xiu JX, Zhu XJ, et al. Advance in the studies of the production of recombinant human collagens. Hebei Chem Eng Ind, 2007, 30(7): 43–46 (in Chinese). 杨立霞, 修建新, 朱欣杰, 等. 重组生产胶原蛋白的研究进展. 河北化工, 2007, 30(7): 43–46.
[5] Pinkas DM, Ding S, Raines RT, et al. Tunable, post-translational hydroxylation of collagen domains in. ACS Chem Biol, 2011, 6(4): 320–324.
[6] Potvin G, Ahmad A, Zhang ZS. Bioprocess engineering aspects of heterologous protein production in: a review. Biochem Eng J, 2012, 64: 91–105.
[7] Singh S, Gras A, Fiez-Vandal C, et al. Large-scale production of membrane proteins in: the production of G protein-coupled receptors as a case study//Bill RM, Ed. Recombinant Protein Production in Yeast. New York: Humana Press, 2012, 866: 197–207.
[8] Stratton J, Chiruvolu V, Meagher M. High cell-density fermentation//Higgins DR, Cregg JM, Eds. Pichia Protocols. Totowa, NJ: Humana Press, 1998, 103: 107–120.
[9] Plackett RL, Burman JP. The design of optimum multifactorial experiments. Biometrika, 1946, 33(4): 305–325.
[10] SoniSK, GoyalN, GuptaJK, et al. Enhanced production of α-amylase fromsubsp.in solid state fermentation by response surface methodology and its evaluation in the hydrolysis of raw potato starch. Starch- Stärke, 2012, 64(1): 64–77.
[11] Singh S, Pakshirajan K, DavereyA. Screening and optimization of media constituents for decolourization of mordant blue-9 dye by. Clean Technol Environ Policy, 2010, 12(3): 313–323.
[12] Wang ZC. Study on the protective effect ofskin collagen peptide on gastric muscosa in rats [D]. Qingdao: Ocean University of China, 2013 (in Chinese).王志聪. 鳕鱼皮胶原蛋白肽对大鼠胃黏膜的保护作用研究 [D]. 青岛: 中国海洋大学, 2013.
[13] Feng QJ, Nie YJ. Curative effect observation of treating recurrent oral ulcer with external use of human like collagen. Gen J Stomatol, 2016, 3(3): 108–109 (in Chinese). 丰秋婧, 聂玉洁. 外用类人胶原蛋白治疗复发性口腔溃疡的疗效观察. 全科口腔医学杂志, 2016, 3(3): 108–109.
[14] Cheng N, Fan DD. Experimental research of human-like collagen on BHK-21 cell growth. J North Univ: Natl Sci Ed, 2005, 35(5): 581–584 (in Chinese).程宁, 范代娣. 类人胶原蛋白对BHK-21细胞生长的影响. 西北大学学报: 自然科学版, 2005, 35(5): 581–584.
[15] Ma XX, Fan DD, Zhu CH, et al. Optimization of fermentation medium for collagen production of recombinantduring induction phase. J Chem Pharm Res, 2014, 6(7): 1802–1809.
[16] HeJ, Ma XX, Zhang FL, et al. New strategy for expression of recombinant hydroxylated human collagen α1 (Ⅲ) chains inGS115. Biotechnol Appl Biochem, 2015, 62(3): 293–299.
[17] Li Lb, Fan Dd, Ma Xx, et al.High-level secretory expression and purification of unhydroxylated human collagen α1(Ⅲ) chain inGS115. Biotechnol Appl Biochem, 2015, 62(4): 467–475.
[18] Venil CK, Lakshmanaperumalsamy P. Application of response surface methodology in medium optimization for protease production by the new strain ofSB08. Pol J Microbiol, 2009, 58(2): 117–124.
[19] Hakobyan L, Gabrielyan L, Trchounian A. Yeast extract as an effective nitrogen source stimulating cell growth and enhancing hydrogen photoproduction bystrains from mineral springs. Int J Hydrogen Energy, 2012, 37(8): 6519–6526.
[20] Cereghino GPL, Cereghino JL, Ilgen C, et al. Production of recombinant proteins in fermenter cultures of the yeast. Curr Opin Biotechnol, 2002, 13(4): 329–332.
[21] Tang YP, Yang XL, Hang BJ, et al. Efficient production of hydroxylated human-like collagenthe co-expression of three key genes inorigami (DE3). Appl Biochem Biotechnol, 2016, 178(7): 1458–1470.
[22] Lei JY, Guan B, Li B, et al. Expression, purification and characterization of recombinant human interleukin-2-serum albumin (rhIL-2-HSA) fusion protein in. Protein Expr Purif, 2012, 84(1): 154–160.
[23] Zhu CH, Fan DD, Duan ZG, et al. Initial investigation of novel human-like collagen/ chitosan scaffold for vascular tissue engineering. J Biomed Mater Res A, 2009, 89(3): 829–840.
[24] Zhu CH, Fan DD, Ma XX, et al. Effects of chitosan on properties of novel human-like collagen/chitosan hybrid vascular scaffold. J Bioact Compat Polymers, 2009, 24(6): 560–576.
[25] Yu JX, Du JZ, Li S, et al. Feasibility of intragastric administration of acetic acid for inducing gastric ulcer model in mouse. J Shanxi Med Univ, 2013, 44(7): 579–581, 590 (in Chinese).于嘉兴, 杜俊喆, 李帅, 等. 小鼠灌胃乙酸建立胃溃疡模型的可行性研究. 山西医科大学学报, 2013, 44(7): 579–581, 590.
[26] Fan DD. Human collagen and its production method: China, 01106757.8. 2005-04-13 (in Chinese).范代娣. 一种类人胶原蛋白及其生产方法: 中国, 01106757.8. 2005-04-13.
(本文责编 陈宏宇)
Production ofgastric-mucosa protective collagen Ⅲ by
Weina Li1,2, Zifang Shang1,2, Zhiguang Duan1,2, Linbo Li1,2, Jing He1,2, and Daidi Fan1,2
1 Shaanxi Key Laboratory of Degradable Biomedical Materials, School of Chemical Engineering, Northwest University, Xi’an 710069, Shaanxi, China 2 Shaanxi R&D Center of Biomaterials and Fermentation Engineering, College of Chemical Engineering, Northwest University, Xi’an 710069, Shaanxi, China
To improve collagen production by recombinant, we applied Placket-Burman and Box-Behnken design to optimize the fermentation medium. Through Placket-Burman design, three variables in the medium (concentration of yeast extract, peptone and glycerol) were selected for having significant effect on cell dry weight. Through Box-Behnken design regression coefficients analysis, a secondary degree polynomial equation was established, and the optimum levels of the three variables were yeast extract 1.13%, peptone 1.61% and glycerol 0.86%. During the growth period, an average cell dry weight of 4.41 g/L was obtained after 12 h fermentation, increased by 26%. Through high density fermentation, the production of recombinant human collagen (Ⅲ) was up to 4.71 g/L in 22 L fermentor. The recombinant human collagen (Ⅲ) exhibited good results to repair acetic acid induced gastric ulcer in rats.
, human collagen (Ⅲ), response surface methodology, gastric tissue
Supported by:Educational Commission of Shaanxi Province of China (No. 16JS104), China Postdoctoral Science Foundation (No. 2015M582698), Scientific Research Foundation in Northwest University (No. 338050025).
陕西省教育厅重点实验室科研计划项目(No. 16JS104),博士后科学基金面上项目 (No. 2015M582698),西北大学科研启动金 (No. 338050025) 资助。
October 14, 2016; Accepted: December 22, 2016
Daidi Fan. Tel: +86-29-88303360; E-mail: fandaidi66@126.com
网络出版时间:2017-01-09
http://www.cnki.net/kcms/detail/11.1998.Q.20170109.1235.001.html

