沉默小鼠成纤维细胞活化蛋白表达对原代胰腺癌细胞增殖及凋亡的影响
邵叶波 靳大勇 戎叶飞 许雪峰
·论著·
沉默小鼠成纤维细胞活化蛋白表达对原代胰腺癌细胞增殖及凋亡的影响
邵叶波 靳大勇 戎叶飞 许雪峰
目的应用RNA干扰技术沉默小鼠胰腺癌相关成纤维细胞的成纤维活化蛋白(FAP)表达,观察其对小鼠原代胰腺癌细胞增殖及凋亡的影响。方法构建靶向小鼠FAP基因的重组表达质粒siFAP及对照质粒siMOCK,分别转染小鼠原代胰腺癌相关成纤维细胞mPCa-FCs-1212,采用定量RT-PCR法及蛋白质印迹法检测转染细胞的FAP mRNA及蛋白表达。将该细胞与小鼠原代胰腺癌细胞mPCa-1212按1∶1的比例共培养,应用MTT比色法检测mPCa-1212细胞的增殖抑制率,应用Annexin V-FITC/PI染色及流式细胞仪检测细胞凋亡。结果转染重组质粒siFAP的mPCa-FCs-1212细胞的FAP mRNA及蛋白表达较转染对照质粒siMOCK的细胞的表达明显下调[0.584±0.029比1.052±0.281,P=0.0213;(27.18±3.23)%比(61.58±4.72)%,P=0.0317]。转染siFAP和转染siMOCK的mPCa-FCs-1212分别与mPCa-1212细胞共培养3 d后,mPCa-1212的增殖抑制率分别为(23.02±3.32)%和(1.11±0.23)%;细胞凋亡率分别为(42.31±5.34)%和(7.38±2.09)%,两组细胞的差异具有统计学意义(P= 0.000)。结论沉默FAP基因的mPCa-FCs-1212在体外可有效抑制mPCa-1212细胞的增殖,诱导细胞凋亡,可能是一种潜在的基因治疗新方法。
RNA,小分子干扰; 基因沉默; 成纤维细胞活化蛋白; 胰腺肿瘤; 细胞增殖; 细胞凋亡
成纤维细胞活化蛋白(fibroblast activation protein, FAP)是一种仅在恶性上皮肿瘤间质中表达的Ⅱ型膜抗原,其可促进肿瘤细胞的增殖和转移[1]。我们前期成功构建了FAP的真核表达载体,并验证其在C57BL/6小鼠体内外均可顺利表达[2]。本研究采用RNA干扰(RNA interfernce,RNAi)技术沉默小鼠胰腺癌相关成纤维细胞(mPCa-FCs-1212)FAP基因,观察其对小鼠原代胰腺癌细胞(mPCa-1212)的增殖和凋亡的影响。
材料与方法
一、siRNA载体的构建
[3]所示的序列和方法,采用化学合成法合成针对小鼠FAP基因的shRNA。它的单链DNA模板组成元件为5′端的BamHⅠ酶切位点+siRNA靶向沉默序列+环状结构序列TTGATATCCG+siRNA反向互补序列+U6启动子终止序列TTTTTT+3′端的HindⅢ酶切位点。靶向FAP的siRNA(siFAP)序列为5′-AAGCTCTGGCGATATTCATAC-3′;阴性对照的随机siRNA(siMOCK)序列为5′-CTACCGTTGTTATAGGTGT-3′。 引物由上海生工生物工程公司合成。先将正、反向寡核苷酸序列经95℃加热、退火至室温,获得双链siRNA插入片段,将siFAP、siMOCK插入片段、质粒pRNAT-U6.1/Neo分别进行BamHⅠ和HindⅢ双酶切,酶切产物经过凝胶回收试剂盒(博大泰克公司)回收纯化后,于16℃连接过夜,然后转化大肠杆菌感受态DH5α,取100 μl菌液涂布于氨苄青霉素抗性的选择性培养基平板,置37℃培养过夜。分别挑选出含有siFAP及siMOCK重组子pRNT-U6-siFAP、pRNT-U6-siMOCK的大肠杆菌克隆,经BamHⅠ和HindⅢ双酶切及DNA测序验证。DNA测序由上海生工生物工程有限公司完成。
二、细胞转染、筛选以及与mPCa-1212细胞共培养
mPCa-FCs-1212细胞为中山医院普外科中心实验室保存,常规培养、传代。当细胞丰度达到65%~70%时,用Lipofectamine 2000(Invitrogen公司)将纯化后的pRNT-U6-siFAP和pRNT-U6-siMOCK分别转染细胞。采用含有新霉素1000 μg/ml的培养基筛选阳性细胞克隆,并在含新霉素500 μg/ml的培养基中扩大培养。分别取稳定表达pRNT-U6-siFAP或pRNT-U6-siMOCK的mPCa-FCs-1212细胞作为实验组,以不转染质粒的mPCa-FCs-1212细胞作为对照组,调整细胞浓度至1×105个/ml。mPCa-1212为中山医院普外科中心实验室保存,常规培养、传代。取对数生长期癌细胞,以1∶1的比例分别与上述3组mPCa-FCs-1212共培养3 d。
三、FAP mRNA表达检测
收集3组mPCa-FCs-1212细胞,应用Trizol(Invitrogen公司)抽提细胞总RNA,应用ReverTra Ace-α First Strand cDNA Synthesis Kit[日本东洋纺(TOYOBO)生物科技(上海)有限公司]逆转录成cDNA。以cDNA为模板,应用SyBR Green RealTime PCR Master MIX[日本东洋纺(TOYOBO)生物科技(上海)有限公司]在荧光定量PCR仪上行实时定量PCR。FAP引物为5′-AGGTCTGCAGAGAAGCAAGAATAC-3′和5′-GAATACGAGTGTCAGACA-TGG-3′;内参GAPDH引物为5′-GCACAGTCAAGGCCGAGAAT-3′和5′-GCCTTCTCCATGGTGGTGAA-3′。退火温度为58℃,扩增循环数为40次。采用2-△△Ct(△△Ct=△Ct转染组-△Ct对照组)公式计算mRNA表达量。各样本重复3次,取均值。
四、FAP蛋白表达检测
收集3组mPCa-FCs-1212细胞,提取细胞蛋白,常规行蛋白质印迹法检测FAP蛋白表达。兔抗小鼠FAP抗体及内参β-actin抗体(Santa Cruz公司)1∶1000稀释, AP标记的二抗(Jackson Immuno-research公司)1∶1000稀释,最后ECL发光。利用BandScan软件分析各条带的灰度值,以(FAP 条带灰度值-背景灰度值)/(β-actin灰度值-背景灰度值)的百分值表示。
五、细胞增殖抑制检测
取3组共培养细胞,以每孔1×104个密度接种于96孔培养板各孔,分别培养1~7 d,每组每天设3个复孔。检测时每孔加入MTT 20 μl(5 mg/L)培养4 h,离心去上清,加入DMSO溶解沉淀,用酶标仪测各孔490 nm处的吸光值(A490),取均值。细胞增殖抑制率=(1-实验组A490值/对照组A490值)×100%。
六、细胞凋亡检测
取3组共培养3 d的细胞,PBS洗涤2次后重悬细胞,调整细胞浓度为1×104个/ml,加入Annexin V-APC结合液室温避光孵育10 min,加入碘化丙啶(PI)染色液,轻轻混匀,冰浴避光放置,上流式细胞仪检测细胞凋亡。以20 000个细胞为检测单位,实验重复3次。
七、统计学处理
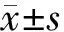
结 果
一、siFAP转染的沉默效果
siFAP组、siMOCK组、对照组mPCa-FCs-1212细胞的FAP mRNA相对表达量分别为0.584±0.029、1.052±0.281、1.103±0.325, siFAP组显著低于siMOCK组及对照组(P=0.0213、0.0187),而siMOCK组与对照组的差异无统计学意义 (P=0.0732)。
siFAP组、siMOCK组、对照组mPCa-FCs-1212细胞的FAP蛋白相对表达量分别为(27.18±3.23)%、(61.58±4.72)%、(65.29±4.78)%(图1)。siFAP组显著低于siMOCK组和对照组 (P=0.0317、0.0389),而siMOCK组与对照组的差异无统计学意义(P=0.0912)。
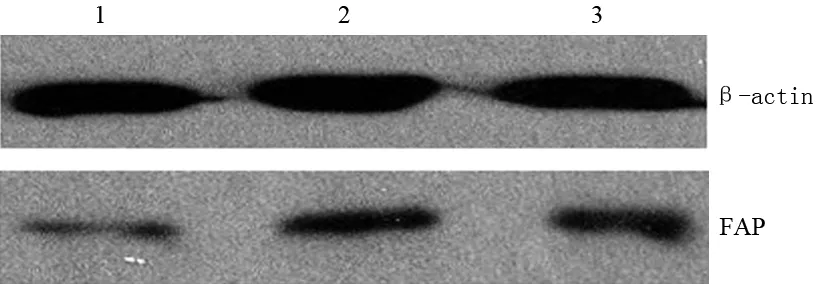
图1siFAP组(1)、siMOCK组(2)、对照组(3)细胞的FAP蛋白表达
在免疫荧光显微镜下观察, siFAP组的成纤维细胞的胞质中呈现很弱的红色荧光,而siMOCK组和对照组的成纤维细胞的胞质呈现出明显的红色荧光(图2),与蛋白质印迹法检出的蛋白表达结果相吻合。
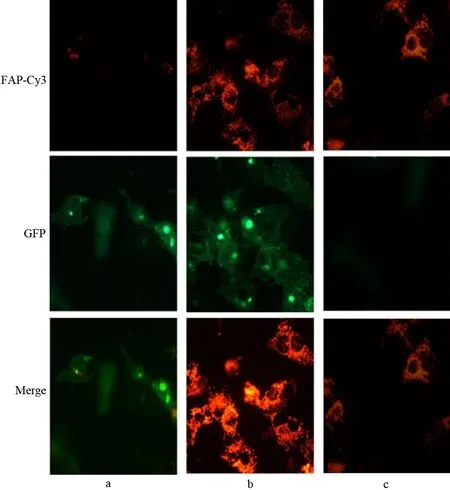
图2siFAP组(a)、siMOCK组(b)、对照组(c)细胞的FAP蛋白表达(荧光显微镜 ×200)
二、mPCs-1212细胞增殖抑制率
与siFAP转染的mPCa-FCs-1212细胞共培养的mPCa-1212细胞增殖抑制率随时间的延长而增加,而与siMOCK转染或未转染的mPCa-FCs-1212细胞共培养的mPCa-1212细胞在培养第2天即进入指数生长期,至第5天开始增殖略变慢(图3)。siFAP转染的mPCa-FCs-1212细胞对mPCa-1212细胞的增殖抑制率显著高于siMOCK转染或未转染的mPCa-FCs-1212细胞(P值均<0.01,表1)。
图3 各组细胞的增殖抑制率
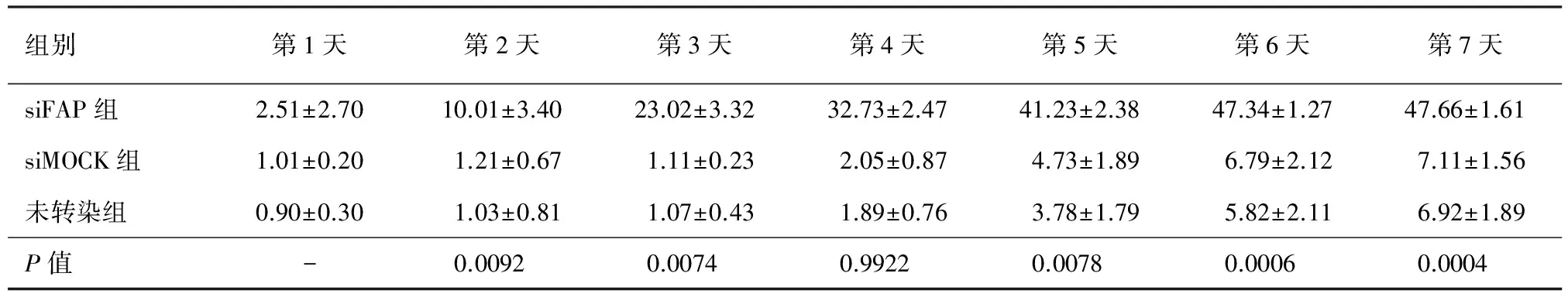
组别第1天第2天第3天第4天第5天第6天第7天siFAP组2.51±2.7010.01±3.4023.02±3.3232.73±2.4741.23±2.3847.34±1.2747.66±1.61siMOCK组1.01±0.201.21±0.671.11±0.232.05±0.874.73±1.896.79±2.127.11±1.56未转染组0.90±0.301.03±0.811.07±0.431.89±0.763.78±1.795.82±2.116.92±1.89P值-0.00920.00740.99220.00780.00060.0004
注:P值为siFAP组与未转染组比较;-:未行统计学分析
三、mPCa-1212细胞凋亡的变化
siFAP、siMOCK转染及未转染的mPCa-FCs-1212细胞分别与mPCa-1212细胞共培养3 d后,mPCa-1212细胞的凋亡率分别为(42.31±5.34)%、(7.38±2.09)%及(7.02±2.09)%。凋亡细胞主要以早期凋亡为主,偶尔也伴随少数的晚期凋亡和坏死细胞。与siFAP转染的mPCa-FCs-1212细胞共培养的mPCa-1212细胞的凋亡率显著高于与siMOCK转染或未转染mPCa-FCs-1212细胞共培养的mPCa-1212细胞(P值均为0.000)。
讨 论
肿瘤相关成纤维细胞(TAFs)能够促进肿瘤细胞的侵袭、生长和转移。FAP则是TAFs表面的一个增殖性标志物,其过度表达可以促进局部上皮细胞增殖及肿瘤细胞的增殖和转移[4]。研究发现,恶性肿瘤基质成分的50%~95%是由FAP表达阳性的成纤维细胞所构成,其主要位于血管周围,可与血液循环中的抗体结合。此外FAP是一种仅在局部表达的膜分子,不能分解为可溶性产物进入血液循环,从而保证肿瘤局部有丰富的靶物质[5]。我们以往的实验证实,在注射重组FAP核酸疫苗后,小鼠对胰腺癌的免疫耐受力明显高于未免疫小鼠,其对于小鼠胰腺癌的增殖有一定的抑制效果[6]。
本研究结果显示,转染了siFAP的mPCa-FCs-1212细胞的FAPmRNA及蛋白表达被明显抑制,证实本研究所设计的siRNA序列是正确的,同时也表明,mPCa-FCs-1212细胞过表达FAP基因。
mPCa-FCs-1212细胞的FAP基因被沉默后,可以抑制小鼠胰腺癌细胞的生长,促进并导致该细胞发生凋亡。
由此可见,FAP蛋白的表达与小鼠胰腺癌细胞及肿瘤相关成纤维细胞的增殖和凋亡关系密切。当FAP蛋白呈现稳定的高表达时,无论是胰腺癌上皮细胞还是肿瘤相关成纤维细胞都呈现出良好的生长状态,且细胞增殖明显;而当FAP表达受抑制时,上述细胞的增殖和生长状态均受到抑制并开始出现凋亡,且随培养时间的延长日趋明显。本研究结果可为针对TAFs作为治疗目标,开展靶向性生物治疗研究提供实验基础和理论依据。
参考文献
[1] Aggarwal S, Brennen WN, Denmeade SR, et al. Fibroblast activation protein peptide substrates identified from human collagen I derived gelatin cleavage sites. Biochemistry, 2008, 47:1076-1086.
[2] 邵叶波,许雪峰,靳大勇,等.小鼠成纤维活化蛋白真核表达载体的构建及表达.中华实验外科杂志,2010,27:452-454.
[3] Bracken AP, Pasini D, Helin K, et al. EZH2 is downstream of the pRB-E2F pathway, essential for proliferation and amplified in cancer. EMBO J, 2003,22:5323-5335.
[4] Kalluri R, Zeisberg M. Fibroblasts in cancer. Nat Rev Cancer,2006, 6:392-401.
[5] Minchinton AI, Tannock IF. Drug penetration in solid tumours. Nat Rev Cancer, 2006, 6:583-592.
[6] 邵叶波,许雪峰,靳大勇,等. 小鼠成纤维细胞活化蛋白核酸疫苗对其宿主胰腺癌抑制作用的研究.中华普通外科杂志,2012,27:61-62.
Effectoffibroblastactivationproteinexpressionsilencingofmousefibroblastcellsontheproliferationofmousepancreaticcancercells
SHAOYe-bo,JINDa-yong,RONGYe-fei,XUXue-feng.
DepartmentofGeneralSurgical,ZhongshanHospital,FudanUniversity,Shanghai200032,China
Correspndingauthor:XUXue-feng,Email:xu.xuefeng@zs-hospital.sh.cn
ObjectiveSmall interfering RNA (siRNA) was used to silence the fibroblast activation protein (FAP) expression of mouse pancreatic cancer related fibroblast cells (mPCa-FCs-1212), and to observe the effects of mPCa-FCs-1212 silencing FAP gene on mouse pancreatic cancer cells (mPCa-1212) proliferation and apoptosis.MethodsThe small interfering RNA targeting FAP gene was designed; the recombinant siRNA plasmid siFAP and control plasmid siMOCK was constructed, which were transfected into mPCa-FCs-1212, respectively. The FAP mRNA and protein expression in transfected cells were examined by real-time PCR and Western blotting. The mPCa-1212 and transfected mPCa-FCs-1212 were co-cultured with a 1∶1 ratio in vitro. The growth inhibitory rates and apoptosis rates of mPCa-1212 were detected by MTT assay and Annexin V-FITC/PI staining and FCM assay.ResultsThe mRNA and protein expressions of FAP in siFAP transfected mPCa-FCs-1212 were significantly down-regulated when compared with that in siMOCK transfected mPCa-FCs-1212[0.584±0.029vs.1.052±0.281,P=0.0213; (27.18±3.23)%vs. (61.58±4.72)%,P=0.0317]. The mPCa-1212 was co-cultured with the mPCa-FCs-1212 transfected with siFAP or siMOCK for 3 d, and the inhibitory rates of mPCa-1212 were (23.02±3.32)% and (1.11±0.23)%, and the apoptosis rates were (42.31±5.34)% and (7.38±2.09)%, the difference between the two groups was statistically significant (P=0.000).ConclusionsmPCa-FCs-1212 silencing FAP gene can inhibit the proliferation of mPCa-1212 in vitro and induce cell apoptosis, and may be a potential new approach to gene therapy.
RNA, small interfering; Gene silence; Fibroblast activation protein; Pancreatic neoplasms; Cell proliferation; Apoptosis
10.3760/cma.j.issn.1674-1935.2012.04.008
复旦大学附属中山医院青年基金资助项目(科补-261)
200032 上海,复旦大学普外科研究所 复旦大学附属中山医院普外科
许雪峰,Email: xu.xuefeng@zs-hospital.sh.cn
2012-03-07)
(本文编辑:吕芳萍)

