MAT1基因沉默对胰腺癌细胞生长的影响
刘建平 陶永胜 李辉 张世能 袁世珍
·短篇论著·
MAT1基因沉默对胰腺癌细胞生长的影响
刘建平 陶永胜 李辉 张世能 袁世珍
我们既往的研究证实,作为调控细胞周期循环的关键基因之一,人类MAT1(ménage à trios 1)基因在胰腺癌组织中表达增强,它参与胰腺癌的发生[1-2]。转染反义MAT1基因可使胰腺癌细胞出现明显的G1期阻滞[3]。为此,本研究应用体外转录法合成靶向MAT1基因的小干扰RNA(small interference RNA, siRNA),转染胰腺癌Capan-2细胞,观察其对细胞的生长抑制效应,探讨siRNA沉默MAT1基因用于胰腺癌基因治疗的可行性。
一、材料与方法
1.细胞培养及MAT1蛋白表达的检测:人胰腺癌细胞株Capan-2从美国加州大学引进,常规培养、传代。收集对数生长期细胞,裂解提取蛋白,常规行蛋白质印迹法检测细胞MAT1蛋白表达。羊抗人MAT1多抗(Santa Cruz biotechnology公司)工作浓度1∶100,兔抗羊IgG单抗(Santa Cruz biotechnology公司)工作浓度1∶500,用PBS代替抗体作为阴性对照。细胞胞质或胞核出现棕黄色颗粒为阳性[2]。
2.靶向MAT1的siRNA合成及细胞转染:参照Elbashir等[4]的哺乳动物细胞RNAi的“AA-N19”设计原则,以MAT1基因的cDNA序列为模板,筛选4条mRNA序列:序列1:5′-GGUGUUGUCCAAAUCCACAUU-3′;序列2:5′-GUCGUUCCACUUCUAAAGCUU-3′;序列3:5′-ACGUCACUGGUUUUACAGGUU-3′;序列4:5′-CUGUGGAAAACGUCA CUGGUU-3′。另设计1条阴性对照序列,5′-AGCGGAUCCAAUCUUUGUGUU-3′。 在GenBank数据库中使用BLAST以确保目的序列与其他基因没有同源性。然后根据碱基互补原则设计出总长度为29个碱基的脱氧核苷酸链,共10条,由QIAGEN-Operon公司合成。采用SilencerTMsiRNA Construction Kit(Ambion公司)在体外转录合成4条21-nt的靶向MAT1的siRNAs(siRNA-MAT1)和阴性对照的siRNAs(siRNA-C)。用紫外分光光度仪检测每一条siRNA的产量和纯度,用2%琼脂糖凝胶电泳检测产物大小和完整性。用SilencerTMsiRNA Labeling Kit(cy3)(Ambion公司)标记siRNAs,用SilencerTMsiRNA Transfection Kit(Ambion公司)将5条siRNAs分别转染Capan-2细胞,在荧光显微镜下直接计数判断转染效率[2]。应用4条siRNA-MAT1中转染效率最高的细胞进行以下实验。
3.细胞生长曲线绘制:取对数生长期siRNA-MAT1转染细胞、siRNA-C转染细胞、未转染细胞,分别以1×105个细胞密度接种于6孔细胞培养板的各孔,其中未转染细胞又分为Lipid对照组(培养液中加Lipid)和空白对照组。连续培养3 d,并于每天同一时间消化细胞,光镜下直接计数活细胞数量,按我们以往的方法[2]绘制各组细胞的生长曲线图。
4.细胞周期及增殖指数检测: 分别取siRNA-MAT1转染组和空白对照组细胞,连续培养3 d,按我们以往的方法[2]上流式细胞仪分析细胞周期曲线,并计算细胞增殖指数(PI)。
5.统计学处理:应用SPSS11.5统计软件分析,计量资料用t检验。P<0.05为差异具有统计学意义。
二、结果
1.Capan-2细胞的MAT1蛋白表达:MAT1蛋白在胰腺癌细胞株Capan-2中呈强阳性表达(图1)。

图1siRNA-MAT1转染(a)和未转染细胞(b)MAT1表达(×200)
2.siRNA-MAT1的转染效率:Capan-2细胞中转染效率>90%,转染后Cy3荧光能持续96 h(图2)。
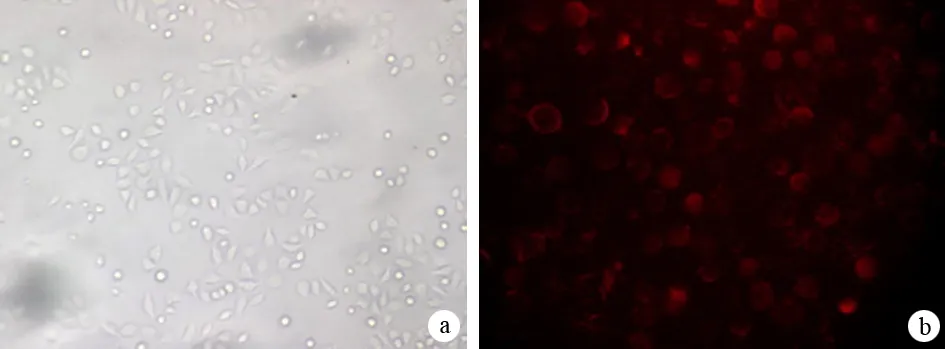
图2Capan-2细胞转染siRNA-MAT1后的光镜(a)及荧光显微镜下(b)照片(×400)
3.siRNA-MAT1转染对Capan-2细胞增殖的影响:4条设计合成的siRNAs序列中有2条(序列2和序列3)可显著抑制Capan-2细胞的生长,其中序列2在72 h后细胞生长抑制率为21.6%,96 h后的生长抑制率为26.7%;序列3在72 h后细胞生长抑制率达38.8%,96 h后的抑制率达41.8%(图3),二者有差异(P<0.01),故选取序列3继续后续实验。流式细胞仪分析显示siRNA-MAT1(序列3)转染组转染48 h后G0/G1期细胞比例明显上升,到72 h后已出现明显的G0/G1期细胞滞留,S期细胞比例明显下降,PI值亦明显下降,有显著性差异(表1)。
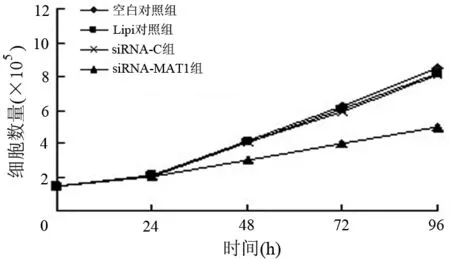
图2 siRNA-MAT1(序列3)抑制BxPC3细胞增殖生长

组别转染后24hG0/G1SPI空白对照组52.9±1.922.8±1.946.8±2.5转染组53.5±1.926.1±1.8a47.1±1.8组别转染后48hG0/G1SPI空白对照组54.5±1.130.6±1.245.5±1.2转染组70.3±1.6b20.0±0.9a29.6±1.6b组别转染后72hG0/G1SPI空白对照组57.9±1.624.3±1.942.1±1.7转染组81.9±2.3b11.3±0.7b18.1±0.7b
注:与空白对照组比较,aP<0.05;bP<0.001
讨论既往研究早已明确细胞周期蛋白依赖性激酶(cyclin-dependent kinase, CDK )在细胞生长周期中所起的作用,而作为CDK的激活激酶(CDK activating kinase,CAK)是通过影响CDK的活性来控制细胞进程的。MAT1基因是CAK这一三聚体复合物( MAT1/CDK7/Cyclin H)的重要组成部分,对CAK的活性起着分子开关的作用。 Rossi等[7]经典的基因敲除实验已证实,MAT1 (-/-)基因缺陷型小鼠细胞不能进入S期,从而影响细胞的增殖和生长。Wu等[8]报道,转导反义MAT1的RNA进入骨肉瘤细胞株MG-63,72 h后细胞生长抑制率约33.3%,G0/G1期细胞比例由44.2%上升到67.0%。Zhang等[9]转导反义MAT1的RNA进入成神经细胞瘤CHP126细胞中, 72 h后G0/G1期细胞比例由43%上升到66%。张世能等[3]证实,转染反义MAT1的RNA进入胰腺癌BxPC3细胞后,通过CAK磷酸化Rb途径影响细胞周期蛋白,使细胞生长阻滞于G1期的晚期。Ohkawa等[10]发现,丙肝病毒核心能使MAT1从CAK中分离,从而削弱了细胞由G1期向S期转化的能力。基于MAT1基因在调节信号分子转导、控制细胞周期进程、影响细胞增殖或凋亡等方面的关键性作用,可以推测,在未来的抗病毒治疗(如艾滋病,病毒性肝炎)和肿瘤基因治疗的靶目标中,MAT1基因是值得期待的一个突破口[11-13]。
我们以往的实验结果显示,转染siRNA-MAT1 72 h后,胰腺癌BxPC3细胞生长明显受抑制[2]。本实验在Capan-2细胞中又获得相似结果,高比例的细胞滞留于G0/G1,未见明显凋亡峰出现,再一次证实MAT1基因的正常表达是细胞从G1期进入S期所必需的,单纯下调MAT1蛋白的表达即可抑制肿瘤细胞生长,使其滞留于G0/G1期。我们以往的实验显示,反义MAT1的RNA在非肿瘤细胞中可诱发明显的细胞凋亡,但在肿瘤细胞中均未见凋亡峰出现[2-3,8-9]。本实验在Capan-2细胞中亦未诱发细胞凋亡,提示靶向MAT1基因的单纯反义RNA或RNAi干扰沉默技术可能都不足以使肿瘤细胞出现明显的凋亡。
[1] 刘建平,袁世珍,张世能,等.胰腺癌中MAT1蛋白的表达与其临床病理特征的关系.中国病理生理杂志,2005,21:163-166.
[2] 刘建平, 袁世珍, 张世能. 小干扰RNA沉默MAT1基因治疗胰腺癌的实验研究. 中华医学杂志,2007,87:2719-2723.
[3] 张世能,徐凤琴,黄志清,等.反义MAT1重组腺病毒对人胰腺癌细胞BxPC-3的周期调控作用.中华医学杂志,2005,85:1348-1351.
[4] Elbashir SM, Harborth J, Lendeckel W, et al. Duplexes of 21-nucleotide RNAs mediates RNA interference in cultured mammalian cells. Nature,2001, 411: 494-498.
[5] Plasterk RH. RNA silencing: the genome`s immune system. Science, 2002, 296:1263-1265.
[6] Harborth J, Elbashir SM, Bechert K, et al. Identification of essential genes in cultured mammalian cells using small interfering RNAs. J Cell Sci, 2001, 114: 4557-4565.
[7] Rossi DJ, Londesborough A, Korsisaari N, et al. Inability to enter S phase and defective RNA polymerase II CTD phosphorylation in mice lacking Mat1. EMBO J, 2001, 20: 2844-2856.
[8] Wu L,Chen P,Shum CH,et al.MAT1-modulated CAK activity regulates cell cycle G(1) exit.Mol Cell Biol,2001,21:260-270.
[9] Zhang S, He Q, Peng H, et al. MAT1-modulated cyclin-dependent kinase-activating kinase activity cross-regulates neuroblastoma cell G1 arrest and neurite outgrowth. Cancer Res, 2004, 64: 2977-2983.
[10] Ohkawa K, Ishida H, Nakanishi F, et al. Hepatitis C virus core functions as a suppressor of cyclin-dependent kinase-activating kinase and impairs cell cycle progression. J Biol Chem, 2004, 279:11917-11926.
[11] 刘建平, 袁世珍.“分子开关”MAT1基因的研究进展.国外医学·生理、病理科学与临床分册,2004,24:306-308.
[12] Li Y, Jin G, Wang H, et al. Polymorphisms of CAK genes and risk for lung cancer: a case-control study in Chinese population. Lung Cancer, 2007, 58:171-183.
[13] Helenius K, Yang Y, Alasaari J, et al. Mat1 inhibits peroxisome proliferator-activated receptor gamma-mediated adipocyte differentiation. Mol Cell Biol, 2009,29:315-323.
10.3760/cma.j.issn.1674-1935.2012.04.016
518029 深圳,广东省边防总队医院消化内科(刘建平、陶永胜、李辉);中山大学附属第二医院消化内科(张世能、袁世珍)
刘建平,Email: championliu@yahoo.com.cn
2011-06-24)
(本文编辑:屠振兴)

