信号转导和转录激活子1的活化抑制蛋白对急性胰腺炎的预后判断
陈平 赵德寿 孙蕴伟 姚玮艳 章永平 袁耀宗
·论著·
信号转导和转录激活子1的活化抑制蛋白对急性胰腺炎的预后判断
陈平 赵德寿 孙蕴伟 姚玮艳 章永平 袁耀宗
目的检测信号转导和转录激活子1的活化抑制蛋白(PIAS1)在急性胰腺炎(AP)大鼠胰腺中的表达,探讨其对AP病情的评估价值。方法SD大鼠按随机分配表法分为对照组、急性水肿性胰腺炎(AEP)组、急性坏死性胰腺炎(ANP)组,各15只。术后0.5、6、16、24、48、72 h分批处死大鼠,取血清检测C反应蛋白(CRP)、淀粉酶水平,测胰腺组织含水量,行胰腺常规病理检查并评分,采用蛋白质印迹法和免疫组化法检测胰腺组织PIASI表达。记录大鼠72 h生存情况,行Cox多因素风险评估。结果ANP组16 h时的胰腺病理评分、胰腺含水量、血清CRP和淀粉酶水平分别为(7.70±2.55)分、(2.91±0.57)%、(0.36±0.05)mg/L、(3141±625)U/L,均显著高于AEP组的(2.60±1.04)分、(2.04±0.47)%、(0.24±0.05)mg/L、(1984± 637)U/L,亦显著高于对照组的(0.80±0.42)分、(1.21±0.27)%、(0.14±0.03)mg/L、(978±353) U/L(P值<0.05或<0.01)。ANP组大鼠平均生存时间为(26.4±3.4) h,较AEP组的(57.3±4.2)h和对照组的(71.3±0.5) h显著缩短(P值均<0.01)。ANP组16 h时的胰腺组织PIAS1蛋白表达较AEP组及对照组显著下调(0.10±0.01比0.80±0.07和0.87±0.05,P<0.01)。Cox分析显示PIAS1为影响AP大鼠生存时间的独立因素之一。结论PIAS1在ANP中低表达,与AP病情严重度呈负相关,可以成为预测病情严重程度及预后的指标。
胰腺炎; PIAS1; 预后; 大鼠
急性胰腺炎(acute pancreatitis, AP)根据病情的轻重,临床上分为轻症(mild acute pancreatitis, MAP)和重症(sever acute pancreatitis, SAP)两型。适时地判断病情对疾病的治疗方式选择具有关键作用。基于促炎症介质在AP的进展中发挥重要的介导作用[1],研究促炎症介质活化环节中枢的信号转导通路已成为目前研究的热点之一。我们既往的研究[2]发现,Janus激酶1(janus kinase,JAK1)/STAT1、3信号转导途径早期即参与AP促炎症介质聚集、放大及最终失控的病理过程。通过调控或关闭JAK1/STAT1信号转导途径可控制AP时的“瀑布”式炎症反应。基于此,本研究进一步检测JAK1/STAT1信号转导途径负性调控因子——信号转导和转录激活子1(signal transducer and activator of transcription 1, STAT1)的活化抑制蛋白(protein inhibitor of activated STAT-1,PIAS1)在AP大鼠胰腺组织的表达,探讨其评估AP病情的价值。
材料和方法
一、实验动物及分组
Sprague Dawley大鼠由上海交通大学医学院附属瑞金医院动物实验室提供。按随机分配表法分为急性坏死性胰腺炎(ANP)组、急性水肿性胰腺炎(AEP)组和对照组,各15只。参照Mizunuma等[3]分3次腹腔内注射20% L-精氨酸溶液1000 mg/kg体重、间隔1 h的方法构建AEP模型,参照张明钧等[4]的方法构建ANP模型,对照组仅行开、关腹手术。术后0.5、6、16、24、48、72 h分批处死大鼠,收集血清及胰腺组织。同时各组均制备相同数目的大鼠,观察生存情况,以72 h为截尾时点,归为完整数据。
二、观察指标及方法
1.胰腺组织病理学检查:取部分胰腺组织置4%多聚甲醛溶液固定48 h,送上海交通大学医学院病理教研室行病理检查。采用Grewal等[5]标准进行评分。
2.胰腺组织含水量测定:取部分胰腺组织剔去脂肪,称湿重,然后置72℃烘烤24 h,称干重,胰腺组织湿/干重系数=(湿重-干重)/干重×100%,表示胰腺组织的含水量。
3.血清C反应蛋白(CRP)和淀粉酶水平检测:血清送上海交通大学医学院附属瑞金医院检验科通过Beckman X7全自动生化分析仪测定。
4.胰腺组织PIAS1蛋白表达检测:采用RIPA分裂液(上海申能博彩公司)抽提胰腺组织总蛋白,采用BCA法(Pierce公司)定量蛋白。取20 μg样品常规行蛋白质印迹法检测PIAS1蛋白。抗PIAS1一抗(Santa cruz公司)工作浓度1∶200,辣根过氧化物酶标记的二抗(上海康成公司)工作浓度1∶5000,最后应用ECL-plus试剂盒(Amersham Biosciences公司)发光,压片后冲洗显影。采用Bio-Rad公司数码成像系统对图片进行扫描,Quantity One软件灰度分析,以GAPDH作为内参照。
另取胰腺组织常规固定、石蜡包埋、切片,行免疫组化染色检测PIAS1蛋白表达。以磷酸盐缓冲溶液代替一抗作阴性对照。由病理科医师盲法读片,取5个高倍镜视野,各计数100个细胞,以胞质中出现棕黄色颗粒为阳性表达细胞,计算阳性表达细胞占总细胞数的百分比,<10%为-,10%~29%+,30%~49%++, 50%~69%+++,>70%++++。
三、统计学处理
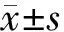
结 果
一、胰腺病理组织学改变
对照组大鼠胰腺组织未见明显病理改变;AEP组大鼠小叶间明显充血水肿,中性粒细胞浸润增多,出现少量坏死;ANP组大鼠见胰腺间质肿胀,炎细胞浸润,微血管壁结构破坏,红细胞渗出,腺泡细胞和脂肪坏死(图1)。对照组、AEP组、ANP组16 h点大鼠胰腺组织病理评分分别为(0.80±0.42)、(2.60±1.04)、(7.70±2.55)分,AEP组显著高于对照组,ANP组又显著高于AEP组(t值分别为-3.86、5.14,P<0.05)。
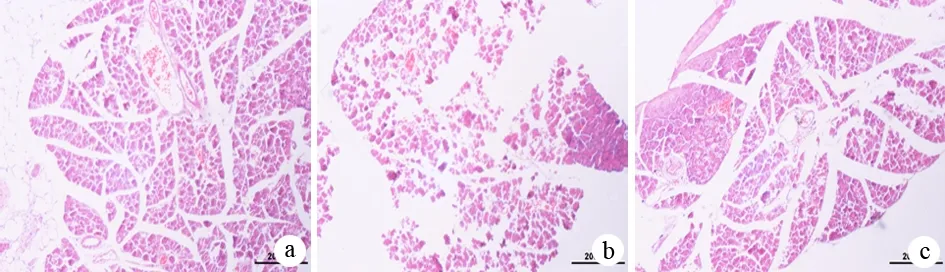
图1对照组(a)、AEP组(b)、ANP组(c)大鼠胰腺的病理改变( ×200)
二、胰腺组织湿/干重系数变化
对照组、AEP组、ANP组16 h点大鼠湿/干重系数分别为(1.21±0.27)%、(2.04±0.47)%、(2.91±0.57)%, AEP组显著高于对照组,ANP组又显著高于AEP组(t值分别为4.74、3.69,P<0.05)。
三、血清淀粉酶及CRP水平变化
对照组、AEP组、ANP组大鼠的血清淀粉酶水平分别为(978±353)、(1984± 637)、(3141± 625)U/L;CRP水平分别为(0.14±0.03)、(0.24±0.05)、(0.36±0.05)mg/L。AEP组显著高于对照组,ANP组又显著高于AEP组(t值分别为4.36、4.09、4.62、5.26,P<0.01)。
四、胰腺组织PIAS1蛋白表达的变化
各组大鼠胰腺组织PIAS1的表达见图2、图3及表1、表2。ANP组大鼠胰腺组织的PIASI表达明显下降,以16 h时的变化最明显。胰腺组织PIAS1蛋白表达与病情严重程度之间呈负相关(r=-0.675,P<0.01)。
五、生存率及多因素分析
ANP组大鼠平均生存时间为(26.4±3.4)h,95%可信区间为19.67~33.06;AEP组大鼠平均生存时间为(57.3±4.2)h, 95%可信区间为49.11~65.42;对照组大鼠平均生存时间为(71.3±0.5)h,95%可信区间为70.26~71.40。3组生存率的差异具有统计学意义 (χ2=70.26,P<0.01,图4)。
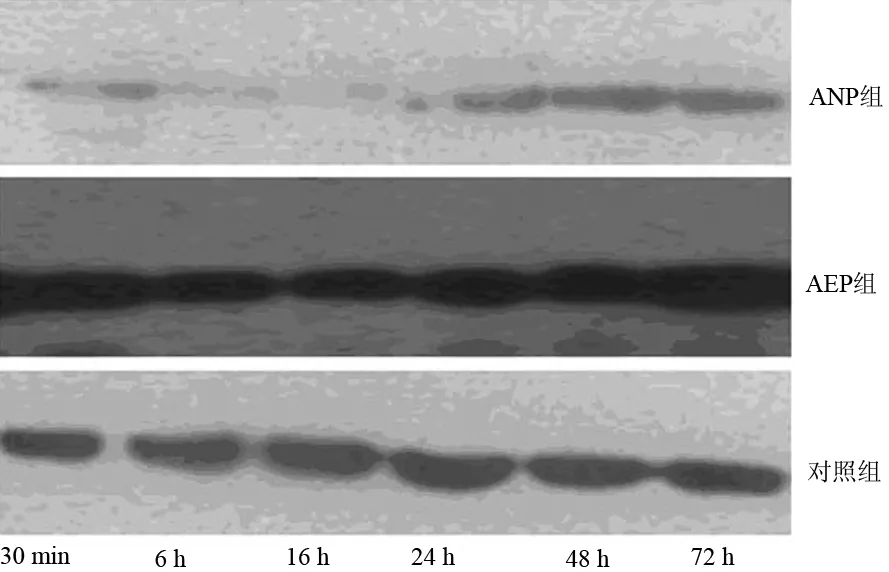
图2 各组大鼠胰腺组织PIAS1蛋白表达
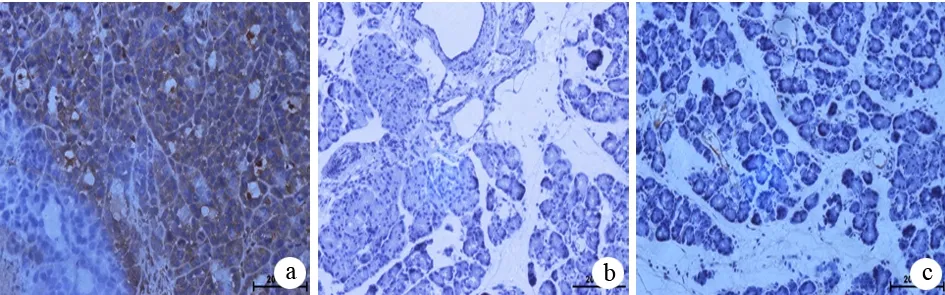
图3对照组(a)、AEP组(b)、ANP组(c)PIASI蛋白表达(免疫组化×200)
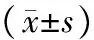
表1 各组大鼠胰腺组织PIAS1蛋白的表达量
注:与对照组比较,t=24.00,aP<0.05;与AEP组比较,t=16.78,bP<0.01
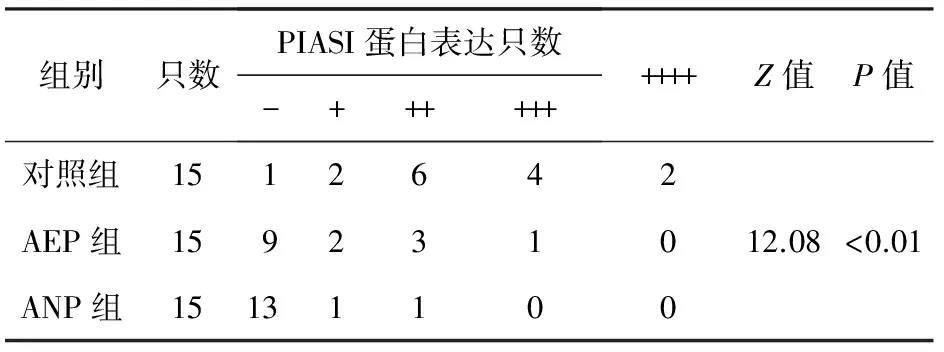
表2 各组大鼠胰腺组织PIAS1蛋白表达
Cox比例风险回归模型多因素分析结果显示,血清淀粉酶水平(β=0.001,P=0.003)、PIAS1蛋白表达水平(β=-0.822,P=0.019)为影响AP预后的独立因素,而血清CRP水平不影响AP预后(β=-2.076,P= 0.619)。
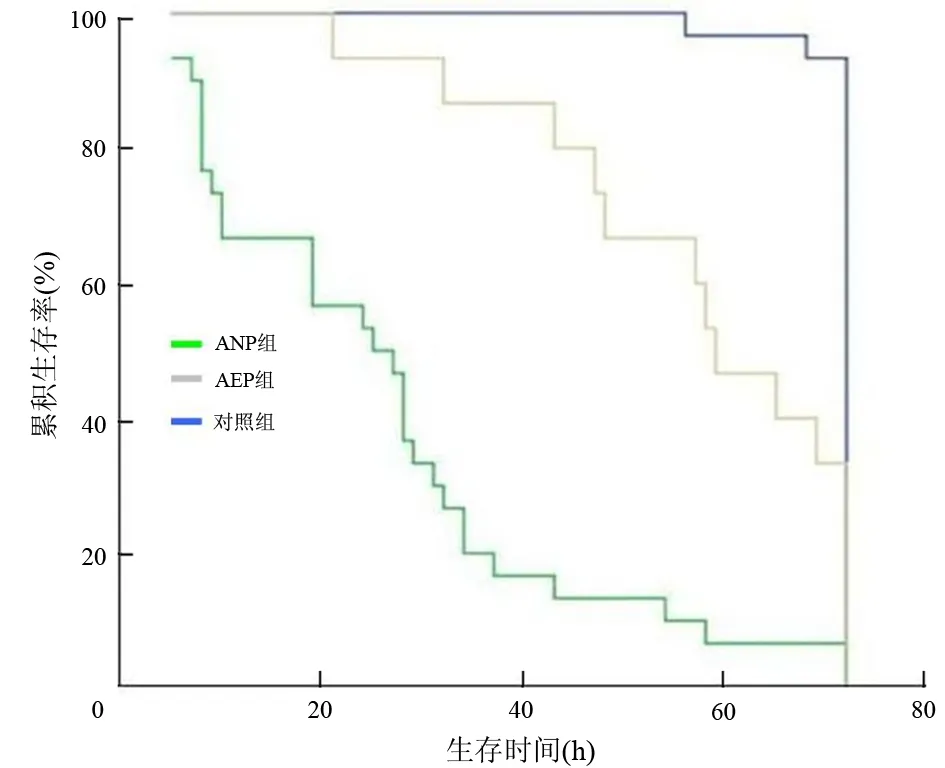
图4 各组大鼠72 h生存率
讨 论
PIAS1作为PIAS家族成员之一和一类小泛素修饰物连接酶E3家族成员之一,位于大鼠8号染色体长臂24区,基因全长1956 bp,蛋白分子质量为71 000,结构序列包括SAP结构域、RLD锌指结构域、酸性结构域和丝氨酸/苏氨酸结构域等保守结构域。目前研究发现,PIAS1可与缺氧、炎症和张力负荷所激活的STAT1相互作用而特异性抑制STAT1下游基因的转录[6]。PIAS1基因敲除小鼠的STAT1介导的部分下游基因转录增加,从而对脂多糖引起的内毒素性休克敏感,血清中促炎症介质水平增高,发育迟缓,围产期死亡增加,因此认为PIAS1敲除小鼠对脂多糖诱导的脓毒血症具有超敏性[7]。此外,Liu等[8]发现在TNF-α或脂多糖刺激下,PIAS1的Ser90磷酸化,通过SUMO化作用于IκB激酶,发挥
NF-κB活性,减轻炎症反应。我们前期使用腺病毒肺泡内炎性细胞的数目,减轻疾病的病情[9]。
Ad5/F35-PIAS1质粒尾静脉注射预处理ANP大鼠,结果明显上调肺组织PIAS1蛋白表达,下调肺组织STAT1、MMP-9和细胞间黏附分子1蛋白表达,减少本研究结果显示,ANP大鼠胰腺组织PIAS1蛋白的表达较AEP、对照组大鼠明显下调,PIAS1的表达与AP病情严重程度呈负相关,且PIAS1表达水平是影响AP大鼠生存时间的独立因素,因此可以作为判断AP病情及预后的潜在指标。
[1] Bhatia M. Acute pancreatitis as a model of SIRS. Front Biosci, 2009, 14:2042-2050.
[2] 陈平, 姚玮艳, 章永平, 等. 雨蛙素诱导的急性胰腺炎体外细胞模型的信号转导通路研究.中华胰腺病杂志, 2010,10: 272-275.
[3] Mizunuma T, Kawamura S, Kishino Y. Effects of injecting excess arginine on rat pancreas. J Nutr, 1984, 114: 467-471.
[4] 张明钧,姚玮艳,乔敏敏, 等. 肠壁穿刺逆行胰胆管注射牛黄胆酸钠重症急性胰腺炎造模. 上海交通大学学报(医学版), 2006, 26: 488-490.
[5] Grewal HP, Mohey el Din A, Gaber L, et al. Ameliomoration of the physiologic and biochemical changes of acute pancreatitis using an anti-TNF-α polyclonal antibody. Am J Surg, 1994, 167: 214-218.
[6] Liu B, Shuai K. Targeting the PIAS1 SUMO ligase pathway to control inflammation. Trends Pharmacol Sci, 2008, 29: 505-509.
[7] Liu B, Mink S, Wong KA, et al. PIAS1 selectively inhibits interferon-inducible genes and is important in innate immunity. Nat Immunol, 2004, 5: 891-898.
[8] Liu B, Yang R, Wong KA, et al. Negative regulation of NF-kappaB signaling by PIAS1. Mol Cell Biol, 2005, 25: 1113-1123.
[9] Chen P, Huang L, Sun Y, et al.Up-regulation of PIAS1 protects against sodium taurocholate-induced severe acute pancreatitis associated with acute lung injury. Cytokine, 2011, 54: 305-314.
SeverityandprognosticpredictionofproteininhibitorofactivatedSTAT1onacutepancreatitis
CHENPing,ZHAODe-shou,SUNYun-wei,YAOWei-yan,ZHANGYong-ping,YUANYao-zong.
DepartmentofGastroenterology,RuijinHospital,SchoolofMedicine,ShanghaiJiaotongUniversity,Shanghai200025,China
Correspondingauthor:YUANYao-zong,Email:yyz28@medmail.com.cn
ObjectiveTo investigate the expression of protein inhibitor of activated STAT-1 (PIAS1) in rat with acute pancreatitis (AP) and study its prediction value for severity and prognosis.MethodsSD rats were randomly divided into control, acute edematous pancreatitis (AEP), and acute necrotizing pancreatitis (ANP) groups with 15 rats in each group. The rats were sacrificed at 0.5, 6, 16, 24, 48, 72 h post-operatively. Serum CRP and amylase levels were determined. Water content of pancreas was measured. The pancreatic tissue was routinely harvested and underwent pathologic examination and was scored. The PIAS1 protein expression was measured by Western blot and immunohistochemistry method. The survival rates at 72h were recorded and the risk analysis of multiple factors was investigated by Cox regression method.ResultsThe pathologic score, water content of pancreas, serum CRP and amylase levels at 16h in ANP group were (7.70±2.55), (2.91±0.57)%, (0.36±0.05)mg/L, (3141±625)U/L, which were significantly higher than those in AEP group [(2.60±1.04), (2.04±0.47)%, (0.24±0.05)mg/L, (1984± 637)U/L)], and also significantly higher than those in control group [(0.80±0.42), (1.21±0.27)%, (0.14±0.03)mg/L,(978±353)U/L, (P<0.05or0.01)]. The survival time of ANP rats was [(26.36±3.41) h, 95%CI:19.67~33.06 h], which were significantly shorter than that in AEP group [(57.26±4.16)h, 95%CI:49.11~65.42)], and also significantly shorter than that in control group [(71.33±0.54) h,95%CI:70.26~71.40,P<0.01]. The expression of PIAS1 at 16h in ANP group was significantly lower than those in AEP group and control group (0.10±0.01vs.0.80±0.07, 0.87±0.05,P<0.01). The Cox analysis suggested that PIAS1 was an independent prognosis factor for the survival time of AP rats.ConclusionsPIAS1 is lowly to moderately expressed in ANP, and is negatively correlated with AP severity, and may be an independent risk factor for the prediction of severity and prognosis of AP.
Pancreatitis; Protein inhibitor of activated STAT-1; Prognosis; Rat
10.3760/cma.j.issn.1674-1935.2012.04.010
200025 上海,上海交通大学医学院附属瑞金医院消化内科(陈平、孙蕴伟、姚玮艳、章永平、袁耀宗);兰州大学第二医院检验科(赵德寿)
袁耀宗,Email: yyz28@medmail.com.cn
2012-04-10)
(本文编辑:吕芳萍)

