靶向性沉默DNMT1基因对胰腺癌细胞DNA甲基化的影响
徐岷 张尤历 高道键 张玉琦 李兆申 高军 杜奕奇 龚燕芳 吴洪玉 高飞
·论著·
靶向性沉默DNMT1基因对胰腺癌细胞DNA甲基化的影响
徐岷 张尤历 高道键 张玉琦 李兆申 高军 杜奕奇 龚燕芳 吴洪玉 高飞
目的观察DNA甲基转移酶1(DNMT1)基因沉默后对人胰腺癌PaTu8988细胞的DNMT活性及hMLH-1基因CpG岛DNA甲基化状态的影响。方法由美国Ambion公司设计合成DNMTl siRNA和阴性对照siRNA,分别用15、30 nmol/L的浓度转染胰腺癌PaTu8988细胞,以未转染组细胞作为对照。应用实时PCR和蛋白质印迹法检测DNMT1 mRNA和蛋白的表达;用DNMT活性检测试剂盒检测其活性;用亚硫酸氢盐测序PCR(BSP)法检测hMLH-1基因CpG岛的甲基化状态;实时PCR法检测hMLH-1 mRNA的表达。结果转染48 h后,DNMT1 siRNA15、30 nmol/L组细胞DNMT1 mRNA表达量分别为0.573±0.026和0.143±0.044,显著低于对照组的1.020±0.217及阴性siRNA 15、30 nmol/L组的0.900±0.475和0.938±0.327(P值均<0.05);DNMT1 siRNA组的DNMT1蛋白表达亦低于对照组和阴性siRNA组。DNMT1 siRNA15、30 nmol/L组细胞DNMT活性分别为0.364±0.124和0.250±0.072,明显低于对照组的0.931±0.065及阴性siRNA 15、30 nmol/L组的0.665±0.055和0.472±0.040。DNMT活性与DNMTl mRNA表达呈正相关(r=0.69,P<0.01)。DNMTl RNA干扰后导致hMLH-1基因CpG位点的8个甲基化减少到1个甲基化。结论DNMTl siRNA能特异性抑制胰腺癌PaTu8988细胞DNMTl 基因的表达,明显抑制DNMT的活性,并引起hMLH-1基因CpG岛去甲基化。
DNA甲基转移酶l; RNA,小分子干扰; 胰腺肿瘤; 甲基化
DNA甲基化是重要的基因表观修饰方式之一,是指在DNA甲基转移酶(DNA methyltransferases,DNMTs)的作用下使CpG二核苷酸5′端的胞嘧啶转变为5′甲基胞嘧啶。DNMT1在哺乳动物细胞中是含量最多的DNMTs,主要起着维持DNA甲基化的作用。本实验将DNMT1小分子干扰RNA(small interfering RNA, siRNA)转染人胰腺癌PaTu8988细胞,观察DNMTl基因沉默后对细胞DNMT活性、hMLH-1 mRNA及其CpG岛甲基化位点的影响。
材料和方法
一、细胞分组
人胰腺癌PaTu8988细胞系由德国Marburg市Philipps大学细胞生物学和分子病理学研究所Elsasser博士惠赠,常规培养、传代。DNMTl siRNA(ID:110914)和阴性对照siRNA(阴性siRNA)由美国Ambion公司设计合成。DNMTl siRNA序列:正义链为5′-GGCGGCUCAAAGAUUUGGATT-3′,反义链为5′-UCCAAAUCUUUGAGCCGCCTG-3′。 取对数生长期细胞,分为对照组,阴性siRNA 15、30 nmol/L组,DNMTl siRNA 15、30 nmol/L组。待细胞生长至60%~70%时,采用Lipofectamine 2000(美国Invitrogen公司)将不同浓度的阴性siRNA或DNMT1 siRNA转染细胞,对照组仅加入等容积Opti-DMED培养液。培养6 h后更换为含10%小牛血清的DMEM继续培养48 h,收集各组细胞,PBS洗3次。
二、DNMT1 mRNA、hMLH-1 mRNA表达的检测
采用Trizol提取各组细胞的总RNA。实时PCR法检测DNMT1 mRNA的表达。应用Primer5.0软件设计引物,DNMT1引物:5′-GTGGGGGACTGTGTCTCTGT-3′和5′-TGAAAGCTGCATGTCCTCAC-3′,扩增片段204 bp;hMLH-1引物:5′-TCCCGAAAGGAAATGACTGC-3′和5′-CTCCGATAACCTGAGAAC-ACCAAA-3′,扩增片段279 bp;内参GAPDH引物:5′-GCACCGTCAAGGCTGAGAAC-3′和5′-ATGGTGGTGAAGACGCCAGT-3′,扩增片段142 bp。引物由上海生工生物工程技术服务有限公司合成。PCR仪为7500型(美国Applied Biosystems公司)。扩增条件:95℃ 1 min;95℃ 15 s,60℃ 15 s,72℃ 45 s,共 40个循环。mRNA相对表达量(RQ)=2-ΔΔCT,实验重复3次,取均值。以对照组mRNA表达量的均数为1,计算其他各组mRNA表达量的倍数。
三、DNMT1蛋白检测
提取上述各组细胞总蛋白,用BCA法进行蛋白定量,取20 μg蛋白常规行蛋白质印迹法检测DNMT1蛋白的表达。兔抗人DNMT1多抗(美国Abcom公司)1∶1000稀释,HRP标记的羊抗兔二抗1∶2000稀释,最后加入ECL反应液,暗室显影、定影后扫描。以β -actin蛋白表达作为内参照。
四、DNMT活性检测
按照核蛋白提取试剂盒(美国Epigentek公司)说明书提取各组细胞核蛋白,采用DNA甲基转移酶活性检测试剂盒(美国Epigentek公司)测定细胞核蛋白中DNMT活性,以吸光值表示。
五、hMLH-1基因CpG岛的甲基化状态检测
采用酚/氯仿抽提法提取细胞总DNA,采用DNA甲基化试剂盒(美国Zymo Research公司)进行亚硫酸氢盐处理。应用BSP法检测hMLH-1基因CpG岛的甲基化。参考文献[1]设计引物,上游5′-GGAGTGAAGGAGGTTAYGGGTAAGT-3′,下游5′-AAAAACRATAAAACCCTATACCTAATCTATC-3′,扩增产物182 bp。引物由上海生工生物工程技术服务有限公司合成。PCR反应条件:94 ℃ 3 min,94℃ 30 s、56℃ 30 s、72℃ 30 s,40个循环,72℃ 10 min。PCR产物用2%琼脂糖电泳进行鉴定,用胶回收试剂盒(维特洁公司)回收及纯化PCR产物,并插入pMD-18T载体(日本TAKARA公司),送上海美季生物公司测序。
六、统计学处理
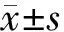
结 果
一、各组细胞DNMTl mRNA及蛋白的表达
对照组,阴性siRNA15、30 nmol/L组,DNMTl siRNA 15、30 nmol/L组细胞的DNMT1 mRNA相对表达量分别为1.020±0.217、0.900±0.475、0.938±0.327、0.573±0.026和0.143±0.044。对照组与阴性siRNA组之间差异无统计学意义(P>0.05);DNMT1 siRNA组显著低于其他各组(P值均<0.05),且其30 nmol/L组更显著低于DNMT1 siRNA 15 nmol/L组(t=3.692,P<0.05)。
各组DNMT1蛋白表达变化同mRNA的表达(图1)。

图1 各组细胞DNMT1蛋白的表达
二、各组细胞DNMT活性的变化及其与DNMTl mRNA表达的相关性
对照组,阴性siRNA15、30 nmol/L组,DNMTl siRNA 15、30 nmol/L组细胞DNMT活性的吸光值分别为0.931±0.065、0.665±0.055、0.472±0.040、0.364±0.124和0.250±0.072;抑制率分别为(0.00±6.96)%、(28.61±5.88)%、(49.27±4.29)%、(60.90±13.29)%和(73.15±7.77)%,依次逐渐增加,两两组间的抑制率差异均有统计学意义(P<0.05)。DNMT活性与DNMTl mRNA表达呈正相关(r=0.69,P<0.01,图2)。
三、各组细胞hMLH-1 mRNA表达及CpG岛的甲基化状态
对照组,阴性siRNA15、30 nmol/L组,DNMTl siRNA 15、30 nmol/L组细胞的hMLH-1 mRNA表达量分别为1.012±0.241、0.986±0.325、1.021±0.303、3.264±0.617和5.733±0.847。对照组与阴性siRNA组之间差异无统计学意义(t=0.011,P>0.05);DNMT1 siRNA组显著高于其他各组(P值均<0.05),且其30 nmol/L组更显著高于15 nmol/L组(t=4.08,P<0.05)。扩增的hMLH-1基因CpG岛的DNA包含22个CpG位点,RNA干扰后导致hMLH-1基因CpG位点的8个甲基化减少到1个甲基化(图3)。
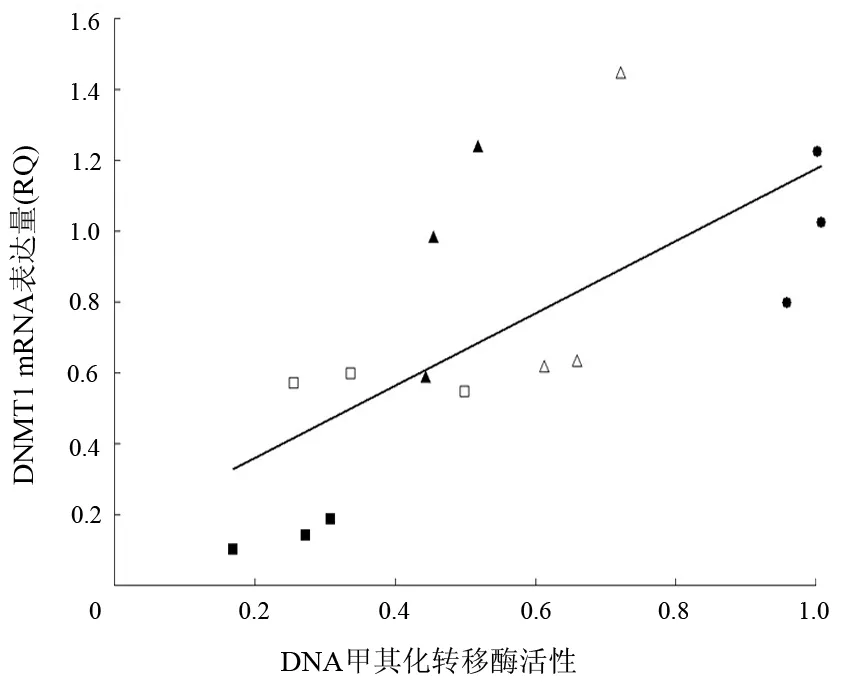
图2 DNMTl mRNA表达与DNMTl活性的相关性
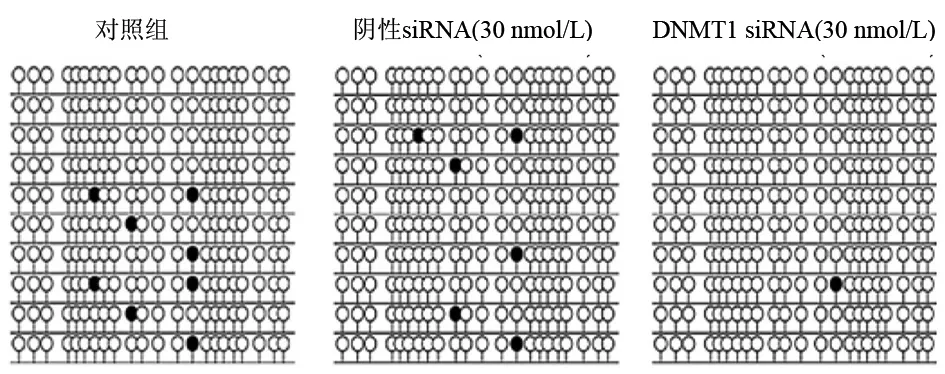
黑点表示甲基化的CpG位点,黑圈表示非甲基化的CpG位点
图3RNA干扰后各组hMLH-1基因CpG岛的甲基化状况
讨 论
肿瘤的发生与多种基因的异常甲基化密切相关,包括抑癌基因、DNA损伤修复基因及与肿瘤代谢和浸润相关的基因。肿瘤组织中的DNA甲基化异常总的特征为广泛低甲基化伴局部高甲基化[1]。通常情况下,DNA高甲基化不仅可以直接或间接影响基因转录,也可导致C-T突变而引起基因表达异常,导致细胞恶变,最终形成肿瘤[2-3]。DNA的去甲基化与转录的启动、基因活化和行使功能有关,因此针对DNA去甲基化的治疗是治疗肿瘤的新途径。
Robert等[4]研究发现,无论使用反义核苷酸还是siRNA选择性沉默DNMT1表达,均能明显降低结肠癌HCT116、SW48和SW480细胞的DNMT的活性,并引起细胞总体甲基化水平下降。Ting等[5]研究发现,沉默DNMT1基因后,结肠癌SW48细胞、膀胱癌T24细胞内仍维持了DNA高甲基化状态。但在乳腺癌细胞中干扰DNMT1 基因,甲基化转移酶的活性降低90%。然而,Rhee等[6-7]靶向性沉默DNMT1基因只能引起结肠癌HCT116细胞总体甲基化水平下降20%,不能有效引起抑癌基因的重新表达。而同时沉默DNMT1和DNMT3b基因表达,可以引起细胞总体甲基化水平下降95%,许多抑癌基因重新表达,有效抑制细胞生长。Sowinska等[8]构建了稳定表达沉默DNMT1和(或)DNMT3b基因的乳腺癌MCF-7细胞和胰腺癌AsPC1细胞,分别引起甲基化水平下降59%、57%、45%和38%,联合干扰两个基因可引起CXCL12启动子CpG岛甲基化水平下降75%和68%。Leu等[9]研究发现,联合沉默DNMT1和DNMT3b基因可抑制卵巢癌细胞的生长,其效果明显强于单独沉默DNMT3b基因;联合两种siRNA干扰引起癌细胞去甲基化的作用亦明显强于单独沉默DNMT1或DNMT3b基因。
本研究结果显示,DNMT1 siRNA可以高效、特异性地抑制DNMT1基因的表达,同时DNMT活性抑制率达60%以上,DNMT活性与DNMTl mRNA表达呈正相关,支持DNMT1在DNMT活性中占主导作用的观点,与其他部分研究结果一致[4-6]。
Robert等[4]研究发现,靶向性沉默DNMT1基因能明显降低结肠癌HCT116、SW48和SW480细胞内抑癌基因CDKN2A的去甲基化和基因表达增加。Jung等[10]使用siRNA靶向性沉默DNMT1基因,可引起CDKN2A、RASSF1A等抑癌基因去甲基化和重新表达。Ting等[5]研究发现,沉默DNMT1基因后,乳腺癌细胞中Cdkn2a、Sfrp1和Gata4基因的启动子发生去甲基化,基因表达增加。Suzuki等[11]通过沉默DNMT1基因可以使非小细胞肺癌NCI-H1299和乳腺癌HCC1954细胞的RASSF1A、p16ink4A、CDH1和HPP1基因启动子的甲基化水平降低80%,并使这些基因重新表达。提示DNMT1基因也可通过调
控hMLH-1基因的甲基化状态,进而影响细胞的增殖。人类错配修复基因1(hMLH-1)是与细胞增殖有关的一个基因。本研究结果显示,沉默DNMT1基因后hMLH-1 mRNA表达增加,其启动子的CpG岛呈现去甲基化状态,与上述研究结果类似。
[1] House MG, Guo M, Iacobuzio-Donahue C, et al. Molecular progression of promoter methylation in intraductal papillary mucinous neoplasms (IPMN) of the pancreas. Carcinogenesis, 2003, 24:193-198.
[2] Esteller M. Epigenetics in cancer. N Engl J Med, 2008, 358:1148-1159.
[3] Esteller M. DNA methylation and cancer therapy: new developments and expectations. Curr Opin Oncol, 2005, 17:55-60.
[4] Robert MF, Morin S, Beaulieu N, et al. DNMT1 is required to maintain CpG methylation and aberrant gene silencing in human cancer cells. Nat Genet, 2003, 33:61-65.
[5] Ting AH,Jair KW,Schuebel KE,et al.Differential requirement for DNA methyltransferase 1 in maintaining human cancer cell gene promoter hypermethylation.Cancer Res,2006,66:729-735.
[6] Rhee I, Jair KW, Yen RW, et al. CpG methylation is maintained in human cancer cells lacking DNMT1. Nature, 2000, 404:1003-1007.
[7] Rhee I, Bachman KE, Park BH, et al. DNMT1 and DNMT3b cooperate to silence genes in human cancer cells. Nature, 2002, 416:552-556.
[8] Sowińska A, Jagodzinski PP. RNA interference-mediated knockdown of DNMT1 and DNMT3B induces CXCL12 expression in MCF-7 breast cancer and AsPC1 pancreatic carcinoma cell lines. Cancer Lett, 2007, 255:153-159.
[9] Leu YW, Rahmatpanah F, Shi H, et al. Double RNA interference of DNMT3b and DNMT1 enhances DNA demethylation and gene reactivation. Cancer Res, 2003, 63:6110-115.
[10] Jung Y, Park J, Kim TY, et al. Potential advantages of DNA methyltransferase 1 (DNMT1)-targeted inhibition for cancer therapy. J Mol Med, 2007, 85:1137-1148.
[11] Suzuki M, Sunaga N, Shames DS, et al. RNA interference-mediated knockdown of DNA methyltransferase 1 leads to promoter demethylation and gene re-expression in human lung and breast cancer cells. Cancer Res, 2004, 64:3137-3143.
EffectsofDNAmethyhransferase1genesilencingonDNAmethylationofpancreaticcancer
XUMin,ZHANGYou-li,GAODao-jian,ZHANGYu-qi,LIZhao-shen,GAOJun,DUYi-qi,GONGYan-fang,WUHong-yu,GAOFei.
DepartmentofGastroenterology,AffiliatedHospitalofJiangsuUniversity,Zhenjiang212001,China
Correspondingauthor:GAOFei,Email:soar1999@163.com
ObjectiveTo assess the effects of DNA methyhransferase 1 (DNMT1) gene silencing on DNMTs activity and methylated CpG sites of hMLH-1 in pancreatic cancer cell line PaTu8988.MethodsDNMTl siRNA and negative control siRNA was constructed by Ambion Company of United States. Then they were transfected into pancreatic cancer cell line PaTu8988 at the concentrations of 15, 30 nmol/L, and the cells without transfection was used as the control group. Real-time PCR and Western blotting were applied to detect the DNMTl mRNA and protein expression, and DNMTs activity was detected by using DNMTs activity assay kit. Change of methylation of CpG island of hMLH-1 was detected by bisulfite sequencing PCR (BSP). The expression of hMLH-1 mRNA was detected by Real-time PCR.ResultsAt 48 h after transfection, Real-time RT-PCR analysis showed that the levels of DNMT1 mRNA in DNMT1 siRNA group (15 nmol/L) and DNMT1 siRNA group (30 nmol/L) were 0.573±0.026and0.143±0.044,which were significantly lower than those in control group 1.020±0.217 and negative siRNA 15 nmol/L group 0.900±0.475, and negative siRNA 30 nmol/L group 0.938±0.327(P<0.05). Western blotting analysis showed that the level of DNMT1 protein of DNMT1 siRNA group was also lower than those of negative siRNA and control groups. DNMT activity in DNMT1 siRNA15, 30 nmol/L groups was 0.364±0.124and0.250±0.072, which were significantly lower than those in control group 0.931±0.065and negative siRNA group 0.665±0.055 and 0.472±0.040.DNMT activity was positively correlated with DNMTl mRNA expression (r=0.69,P<0.01). DNMTl RNA interference decreased 8 methylated CpG sites of hMLH-1 to 1 site.ConcluslonsDNMTl siRNA can specifically inhibit the expression of DNMTl gene of PaTu8988 and DNMT activity, and can decrease methylated CpG sites of hMLH-1 gene.
DNA methyhransferase 1 (DNMT1); RNA,small interfering; Pancreatic neoplasms; Methylation
10.3760/cma.j.issn.1674-1935.2012.04.006
江苏省自然科学基金(BK2009210);江苏省卫生厅科研项目(H200836);辽宁省博士科研启动基金(20101131);镇江市科研计划项目(SH2009012)
212001 江苏镇江,江苏大学附属医院消化科(徐岷、张尤历);第二军医大学长海医院消化科(高道键、张玉琦、李兆申、高军、杜奕奇、龚燕芳、吴洪玉);沈阳军区总医院内窥镜科(高飞)
高飞,Email:soar1999@163.com
2011-11-16)
(本文编辑:吕芳萍)

