外源性透明质酸对人牙周膜细胞增殖及成牙骨质、成纤维分化的影响
金洁琪,光梦凯
(1.首都医科大学附属北京友谊医院口腔科,北京 100050;2.中日友好医院口腔医学中心,北京 100029)
透明质酸(hyaluronan,HA)广泛存在于人体软组织及结缔组织,包括牙周膜组织等的细胞外基质中,其对抗炎、伤口愈合起关键作用,目前临床上应用广泛[1,2]。内源性HA 作为牙周膜组织的重要组成部分,可以抗炎并促血管生成及伤口愈合[3],而外源性HA 对牙周组织的应用有待进一步研究。人牙周膜细胞(human periodontal ligament cells,hPDLCs)有分化潜能[4],本实验旨在研究在HA 的作用下其增殖及分化的情况,为HA 应用于牙周疾病的治疗提供依据。
1 材料和方法
1.1 实验材料
细胞为慕尼黑大学牙学院基础实验室自有hPDLCs 细胞系。成骨诱导(osteogenic stimulation,OS)液:FBS,盘尼西林链霉素,地塞米松,L-抗坏血酸,β-甘油磷酸盐,抗坏血酸等(均来自美国Sigma 公司)加入细胞培养液配成。HA 来自Hyalose 公司。查文献后选择分子量3~6Da 的Nano HA 及分子量150K Da 的HA。实验中HA 浓度为20ng/ml[5]。
1.2 实验方法
实验分组:空白对照组(Con);OS 组(osteogenic stimulation,+OS,阳性对照);Nano HA 组(+OS+Nano HA);150K HA组(+OS+150K HA)。
21d 细胞培养:hPDLCs 培养于37℃,5% CO2的恒温箱中,每周换液2 次。每周同一时间对细胞进行显微镜拍照及形态学观察。
细胞增殖WST-1检测:将hPDLCs均匀种在4盒48 孔培养皿中,等待48h,细胞完全附着生长后,标记为起点,分别在第0d,7d,14d,21d 进行细胞增殖测验。WST-1 试剂盒来自Roche 公司,加入培养皿30min后,将细胞进行ELISA测试。
对牙骨质相关的牙骨质附着蛋白(cementum attachment protein,CAP),牙骨质蛋白(cementum protein 1,CEMP1),韧带相关的Scleraxis(SCX),感染相关的Toll 样受体(toll like receptor 4,TLR4)基因进行rt-PCR 检测:将hPDLCs 均匀种在6孔培养皿中,等待48h,细胞完全附着生长后,标记为起点,分别在第0d,3d,7d,21d 刮取细胞,提取RNA,转化为cDNA 后,进行rt-PCR 试验。管家基因选择甘油醛-3-磷酸脱氢酶(glyceraldehyde 3 phosphate dehydrogenase,GAPDH)。具体基因序列见表1。1.3 统计学方法
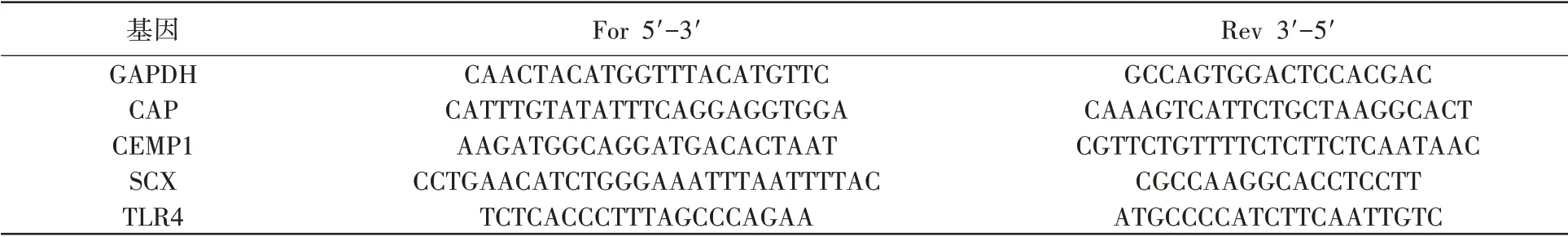
表1 rt-PCR检测的标记物的基因序列
应用Prism 8.0 软件进行数据分析。两两比较采用t检验,组间比较采用one-way ANOVA。
2 结果
2.1 hPDLCs21d细胞培养的形态学观察
由图1(见封二)可见,A 组空白对照组中hPDLCs 呈梭形生长,随着培养时间的增加,集落逐渐融合,细胞均匀聚集分布,培养后期细胞逐渐经纬状交叠,细胞形态尖锐,边缘伸展(图A1~A3)。C 组为Nano HA 组(图C1~C3),D 组为150K HA组(图D1~D3),细胞形态均较空白对照组较为圆钝,边缘收缩,细胞培养后期(21d)时尤为明显。B 组为成骨诱导的阳性对照组OS 组(图B1~B3),hPDLCs 形态介于空白对照组及HA 组之间,较空白对照组圆钝,但细胞收缩程度不如HA组明显。

图1 hPDLCs培养7d、14d、21d时显微镜下观察照片(×10)
2.2 HA抑制hPDLCs增殖
实验初期,各组细胞生长速度接近,组内无统计学差异。从第7d 开始,空白对照组显著高于OS 组及150K HA 组(P<0.01);OS 组显著高于Nano HA 组(P=0.0009)。第14d 时,hPDLCs 增殖速度空白对照组>OS 组>Nano HA 组>150K HA 组。第21d 时,空白对照组增速显著高于Nano HA 组及150K HA组(P<0.01);OS组细胞增殖速度亦显著高于Nano HA 组及150K HA 组(P=0.0398,P=0.0057)。Nano HA 与150K HA 两组之间细胞增殖速度无明显差异。综合看来HA 对hPDLCs 增殖明显有抑制作用,见图2。

图2 PDLCs WST-1增殖实验
2.3 HA抑制hPDLCs表达CAP
图3A 示,7d 时4 个组的CAP 表达均达到高峰,而21d 时回落至初始线以下。3d 时可见空白对照组比OS,Nano HA 组及150K HA 组都高(P<0.01);OS 组亦高于150K HA 组(P=0.0191),可见150K HA 对CAP 表达有抑制作用。7d 时2 个HA组CAP 表达亦低于空白对照和OS 组,Nano HA组更是低于150K HA 组(P=0.0103)。21d 时,HA组的CAP表达亦低于空白对照组,而与OS组无统计学差异。总之HA 基本上抑制hPDLCs 表达CAP。
2.4 HA抑制hPDLCs表达CEMP1
图3B 示,HA 刺激下,hPDLCs 中CEMP1 的表达与CAP 类似,7d 时均有较高的表达,21d 时回落。3d 时,HA 对CEMP1 的表达有抑制作用,HA组均低于空白对照组和OS 组。7d 时,空白对照组最高,而OS 组,Nano HA 组及150K HA 组内无明显差异。21d 时,Nano HA 组与空白对照组的CEMP1 表达无明显差异;而空白对照组的表达高于OS组及150K HA组(P=0.0036,P=0.0004);Nano HA 组的CEMP1 表达亦高于150K HA 组(P=0.0375)。总之HA,尤其是150K HA抑制hPDLCs表达CEMP1。
2.5 150K HA先促进后抑制hPDLCs表达SCX
图3C 示,hPDLCs 的表达量很低。前3d 各组之间SCX的表达差异无统计学意义。7d时,OS组和150K HA 组的SCX 表达显著高于空白对照组,亦显著高于Nano HA 组(均P<0.01)。21d 时,空白对照组SCX 表达升高,而150K HA 组表达降低,显著低于空白对照组,P=0.004)。
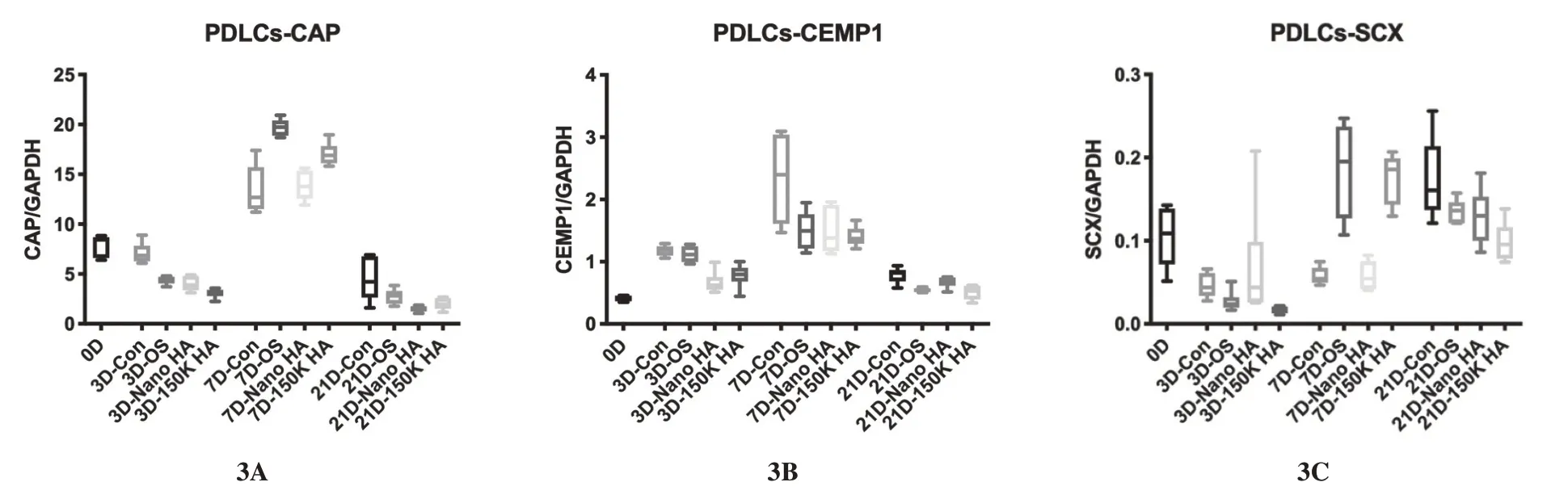
图3 hPDLCs rt-PCR 中CAP、CEMP1、SCX的表达
2.6 HA促进hPDLCs表达TLR4
图4 示,前期hPDLCs 的TLR4 表达在较低水平,而在21d 时显著提升。3d 时HA 组TLR4 表达显著高于空白对照组及OS组;Nano HA组亦高于150K HA 组(P=0.0378)。7d 时各组表达均高于空白对照组,而150K HA 组则低于OS 及Nano HA 组(P=0.0461,P=0.0132)。21d 时各组高于空白对照组,而OS 组、Nano HA 组及150K HA 组之间差异无统计学意义。总之,HA 尤其是Nano HA,促进hPDLCs表达TLR4。
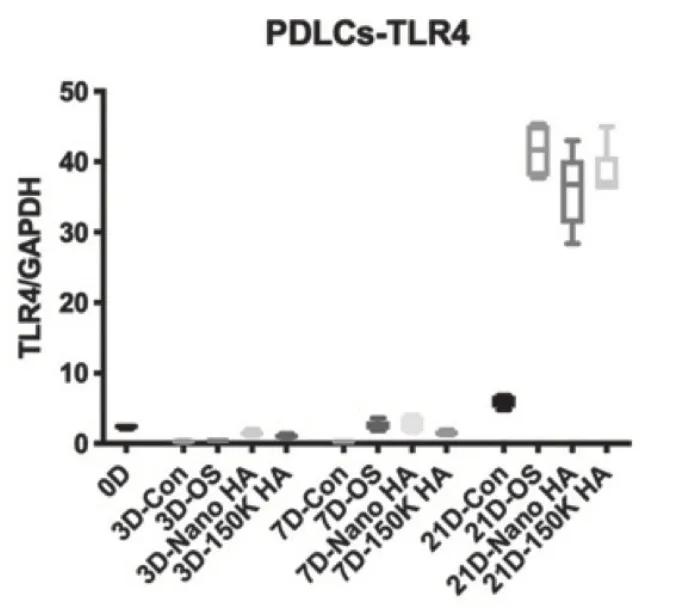
图4 hPDLCs rt-PCR 中TLR4的表达
3 讨论
本实验细胞形态学观察中,在Nano HA 和150K HA 刺激下,hPDLCs 形态较空白对照组明显圆钝;印证了Al-Rekabi等学者的研究成果:HA可提高hPDLCs 的收缩性,且降低其细胞迁移能力。该实验中,HA 刺激下的hPDLCs 形态较对照组明显收缩[6]。HA 对大部分细胞有抑制增殖的作用[7],在本实验中亦得到了验证。不过也有学者研究发现HA 可以促进PDL 细胞增殖[8],其观测时间为细胞种植后的3d 和5d,与本实验不同;且使用的HA 分子量未知,而HA 对细胞的作用与HA的分子量相关,因此与本实验结论相悖。
牙周附着丧失是牙周炎症的重要表现。CAP和CEMP1 是牙周附着及牙骨质相关蛋白[9]。hPDLCs是具有分化潜能的细胞,在适当的诱导下可以分化为成牙骨质细胞[10]。可惜在本实验中,2种HA 都对hPDLCs 的成牙骨质分化起抑制作用。7d 时所有组CAP 及CEMP1 表达均升高而在21d回落,HA 组表达CAP 均低于空白对照组,但无统计学差别;21d 时150K HA 明显抑制CEMP1 表达。SCX 是调节成纤维细胞形成纤维组织的蛋白,可以促上皮细胞向间充质细胞转化,对组织愈合纤维形成起关键作用[11]。此外SCX还可以机械压力下促进腱细胞转化和增殖,从而修复肌腱[12]。本实验发现150K HA 在7d 可促进SCX 表达,而在21d 时抑制hPDLCs 表达SCX。考虑到牙周组织承受各种咀嚼压力,因此很有必要进一步研究HA 对SCX 的调节作用。TLR4 是炎症相关因子,炎症状态下可激活组织免疫反应[13]。TLR4 还可以调节hPDLCs 的成骨分化[14]。本实验中,2 种HA,尤其是Nano HA,在3d 可明显促进hPDLCs表达TLR4,21d 时OS 组与HA 组间无差异,但亦均明显高于空白对照组。HA 可诱导受损组织中成纤维细胞和角质细胞分化以修复受损伤的组织[15]。此外HA 还可以诱导软骨、韧带的修复及hPDLCs 神经方向的分化[16,17],且可以促进hPDLCs早期成骨分化[8]。有学者在老鼠牙周炎模型上使用了HA 凝胶,得到很好的骨再生[18]。因此HA在牙周炎患者的临床应用还是很有前景。

