产β-葡聚糖酶突变株培养基的优化
邵金华刘凯杨锦兀
(湖南科技学院 生命科学与化学工程系,湖南 永州 425100)
β-葡聚糖属植物细胞壁中的结构性非淀粉多糖,是以右旋葡萄糖为基本单位,属于多糖类中的同多糖类,具有线型的空间结构,存在于禾谷类(包括大麦、燕麦、黑麦和小麦等)的糊粉层和胚乳细胞壁中。谷物类β-葡聚糖独特的分子结构,赋予了其独特的性质,能以高分子量的形式溶于水,且形成溶液的粘度很高,给工业生产带来了诸多的不便。β-葡聚糖酶属于水解酶类,具有降解β-葡聚糖,破坏植物细胞壁结构;提高内源性消化酶活性,减少肠道微生物,降低小肠内容物粘度;利于动物对营养物质的消化和吸收,同时,提高生长性能和粮食的转化率,在食品、饲料工业等方面有广阔应用前景。
1.料和方法
1.1.种
突变株Bacillus subtilis spp.,由本实验室在校园内的土壤中筛选后诱变制得。
1.2.要原料和试剂
大麦粉,购自重庆漓泉啤酒厂,磨成粉,过80目筛。
标准大麦β-葡聚糖,美国Sigma公司产品。
其它试剂均为分析纯。
1.3.养基及培养条件
1.3.1.本培养基(g/l00ml):
蛋白胨 1.0,牛肉膏0.4,琼脂 1.8,NaCl0.4,pH 7.2; 121℃,25min灭菌。
1.3.2.始培养基(g/100mL)
大麦β-葡聚糖 0.2, KNO30.1, NaH2PO40.002, MgS040.03, CaCO30.005, FeCl30.002 , 刚果红0.004,琼脂1.8,pH 7.2,121℃,25 min灭菌。
1.3.3.瓶发酵条件
在250ml的三角瓶中装入35ml培养基,1210C,灭菌 25 min,冷却至室温,接种(接种量为2.2x106个孢子/ml 发酵液),pH值6.5,370C, 200r/min振荡培养60h。
1.4.验方法
1.4.1.-葡聚糖酶酶活力测定[1]待测粗酶液用pH6.0的乙酸钠缓冲液稀释一倍,取经60℃预热的此稀释酶液1.0ml,加入经60℃预热的1.0%β-葡聚糖溶液1.0ml,60℃恒温准确反应10min,立即加入DNS试剂3ml,混匀,立即用DNS法测定还原糖含量。酶活单位定义: 在上述反应条件下1s中从大麦β-葡聚糖产生1nmol葡萄糖所需酶量为一个酶活力单位(u)。
1.4.2.酵液,还原糖含量测定:DNS法[2]
1.4.3.酵液总糖含量测定:盐酸水解法[3]
1.4.4.酵液pH测定:pH计法
1.4.5.酶的培养基优化
在初始培养基的基础上依次改变碳源和氮源的种类及浓度,再分别确定各微量元素的最佳添加量。
2.果和讨论
2.1.同碳源对产酶的影响
用六种常见碳源分别代替基础培养基中的碳源进行单因素试验,碳源添加量以总糖含量相等为依据。表2-1表明,大麦粉是最佳的碳源,可能是因为β-葡聚糖酶是一种典型诱导酶,特定的碳源对酶合成具有一定诱导效应[4]。
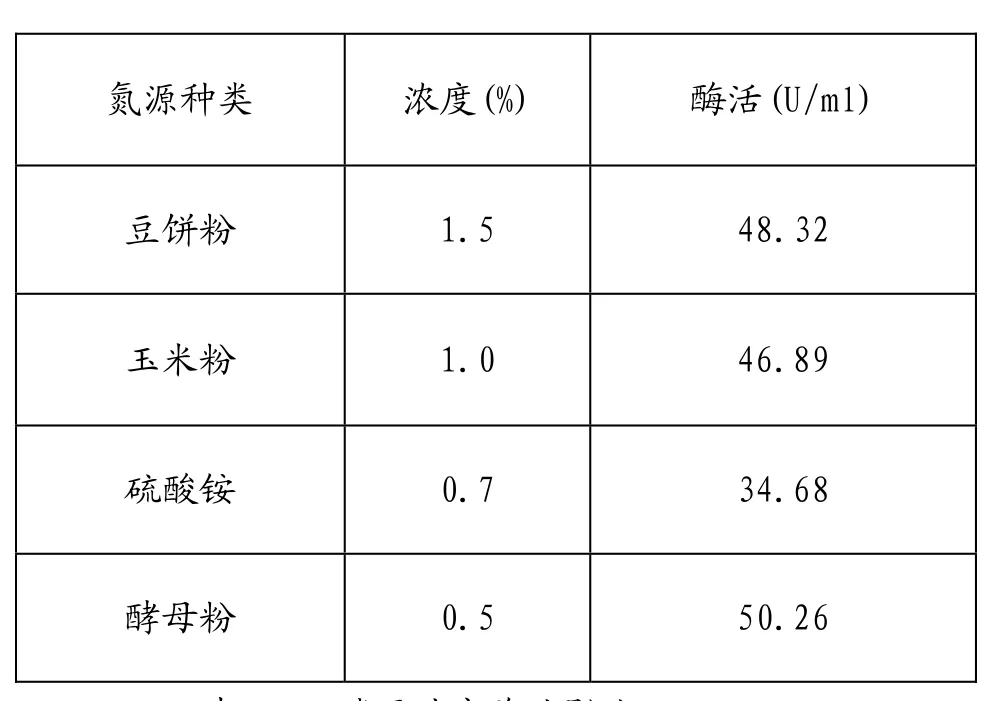
表2.1碳源对产酶的影响
2.2.同氮源对产酶的影响
本实验选择了常用的几种无机氮源和有机氮源进行氮源单因素实验(添加量以N元素摩尔数相等为依据)。结果表明,酵母粉为最好的氮源,其次为豆饼粉。

表2.2 氮源对产酶的影响
2.3.gSO4浓度对产酶的影响
对细胞来说,Mg2+是金属离子当中较为重要的一种,它是许多酶活性中心不可缺少的一部分,结果表明MgS04的最适浓度为0.02g/100ml,超过0.02g/100ml会抑制酶的活性。

图2.1 MgSO4浓度对β-葡聚糖酶产酶的影响
2.4.H2PO4的浓度对产酶的影响
在添加的营养盐中,对KH2PO4的浓度高低是否影响β-葡聚糖酶的酶活进行了对比实验,图2-2表明,高浓度的KH2PO4对β-葡聚糖酶的酶活有抑制作用,KH2PO4浓度最佳量为0.002(g/l00ml)。

2.5.aC03浓度对产酶的影响
钙一般不参与微生物的细胞结构物质,但它是某些酶的激活剂,而且钙离子能调节细胞透性,对β-葡聚糖酶也有一定的激活作用[5]。从图2-3可以看出,CaC03的最适浓度0.05g/100ml.
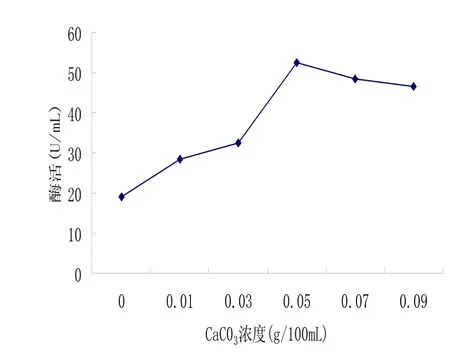
图2.3 CaCO3浓度对产酶的影响
2. 6正交试验确定最佳碳氮比及最佳培养基配方
本实验选择了大麦粉、玉米粉、豆粕粉,MgS04, CaC03浓度进行五因素四水平的正交试验[6]。由表2-3可知,大麦粉浓度是影响最显著的因素,五个因素对发酵产酶的显著性依次为A>C> B>D>E,最佳条件分别为A3B3C4D3E3,即最适浓度(g/l00ml)为大麦粉3.0,玉米粉2.0, 豆粕粉4.0,MgSO40.03, CaCO30.05。按此方案进行验证实验,产β-葡聚糖酶活力达到56.53U/ml,是初始产酶条件的1.8倍.

表2.3培养基配方正交试验结果分析表
3. 论
采用单因素实验和正交实验对芽孢杆菌突变株Bacillus subtilis spp.摇瓶分批发酵生产β-葡聚糖酶的培养基和发酵条件进行了研究,得出其最佳培养基配方为(g/100ml): 大麦粉3.0,玉米粉2.0, 豆粕粉4.0,MgSO40.03, CaCO30.05; 糊精、大麦粉等多糖有利于突变株Bacillus subtilis spp.β-葡聚糖酶的产生,葡萄糖、蔗糖等易利用性碳源不利于菌体生物量的积累和β-葡聚糖酶的产生。酵母粉为突变株Bacillus subtilis spp.产β-葡聚糖酶的最佳氮源,其次为豆饼粉;试验中选用的无机氮源均不利于β-葡聚糖酶的产生。MgS04和CaCO3浓度对β-葡聚糖酶的产生有较大影响,而KH2PO4浓度对β-葡聚糖酶的产生影响较小。突变株Bacillus subtilis spp.β-葡聚糖酶产生受大麦β-葡聚糖的诱导作用。
[1]赵斌,何绍江.微生物学实验[M].北京:科学出版社,2002.
[2]周德庆.微生物学实验手册[M].上海:上海科学技术出版社,1986.
[3]杨汝德,现代工业微生物学[M].广州:华南理工大学出版社,2001,157-158.
[4]万平平,丁爱云,李安娜,黄玉杰. 产β-葡聚糖酶链霉菌菌株的筛选及其酶特性研究[J].烟台师范学院学报(自然科学版)2004,20(1),58-61.
[5]孙玉英,王瑞明,刘庆军.局限曲霉产β-葡聚糖酶发酵培养基和发酵条件的优化[J].饲料工业,2004, 25(1): 29-30.
[6]孙玉英,王瑞明,刘庆军.局限曲霉产β-葡聚糖酶发酵培养基和发酵条件的优化[J].饲料工业,2004, 25(1): 29-30.

