微泡造影剂结合超声介导绿色荧光蛋白质粒转染大鼠移植静脉的实验研究*
胡 敏 张凯伦 项飞翔
华中科技大学同济医学院附属协和医院 1心脏外科 2超声影像科,武汉 430022 3华中科技大学同济医学院附属同济医院心胸外科,武汉 430030
静脉桥再狭窄是影响冠状动脉旁路移植(coronary artery bypass graft,CABG)术后远期疗效的主要因素。目前研究表明,血管平滑肌细胞的增殖、移行是血管再塑和重排,并最终导致移植静脉再狭窄或闭塞的细胞学基础[1]。基因治疗作为一种在分子水平干扰和纠正疾病的治疗手段,在移植静脉桥再狭窄的防治上有良好的应用前景。研究表明超声辐照结合微泡造影剂可促进裸质粒进入细胞中[2-3]。本研究运用微泡造影剂结合超声辐照介导增强型绿色荧光蛋白质粒(pEGFP)转染移植静脉,探讨该方法的有效性、可行性,为临床预防CABG术后再狭窄的基因治疗提供新的思路。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 健康SD大鼠40只,清洁级,体重200~250 g,雄性,由华中科技大学同济医学院实验动物学部提供,许可证号:SCXK(鄂)2004-0007。
1.1.2 质粒提取 pEGFP菌液由华中科技大学同济医学院附属同济医院妇科肿瘤实验室朱涛博士提供,pEGFP经大肠埃希菌扩增后,按质粒大量抽提试剂盒(美国Qiagen公司)说明提取。提取纯化的pEGFP酶切电泳鉴定,紫外分光光度计测定其浓度为 1 mg/mL,A260/A280>1.8。
1.1.3 微泡造影剂 微泡造影剂Sono Vue(意大利Bracco公司产品),主要成分为六氟化硫(SF6)气体和白色冻干粉末。使用时将5 mL生理盐水注入Sono Vue药瓶中,用力振荡使药物混合均匀,微泡造影剂浓度为(1~2)×109微泡/mL,微泡直径2~6 μ m 。
1.1.4 超声照射系统 美国ACUSON公司的Sequoia 512,选用15L8W探头。特制辐照容器:聚乙烯管,长约1.5 cm,直径2 cm,表面以聚乙烯薄膜封口。
1.1.5 荧光显微镜 Nikon 80i荧光显微镜:激发波长490 nm,接收波长530 nm。
1.2 实验方法
1.2.1 动物分组和模型建立 动物随机分4组(10只/组),即A 组:单纯质粒浸泡组;B组:质粒+微泡造影剂组;C组:质粒浸泡+超声辐照组;D组:质粒+微泡造影剂+超声辐照组。饲养环境:室温18~25℃,湿度65%~70%,自由饮水进食。动物模型建立:大鼠以10%水合氯醛水溶液0.3 mL/100 g腹腔注射麻醉,同时腹腔注射肝素10 U/100 g,作右侧颈部纵切口,取颈外静脉段约2.0 cm,以间断缝合法间置植于颈总动脉,建立颈外静脉颈总动脉旁路移植模型。术后当天肌肉注射青霉素20万单位,常规饲养。
1.2.2 质粒与微泡造影剂混合液的配制 一次性注射器抽取5 mL生理盐水,注入Sono Vue微泡造影剂安瓿中,充分摇匀备用;取pEGFP溶液1 mL(质粒浓度1 mg/mL),将其加入上述造影剂安瓿中,摇匀后4℃下静置30 min,使pEGFP充分粘附于微泡的外壳。
1.2.3 超声辐照 取大鼠颈外静脉段长约 2.0 cm,将静脉段置入含有相应液体的特制辐照容器中,小心以聚乙烯薄膜封口,尽量不留可见气泡,给予超声辐照或仅将探头置于容器上不开启超声仪器(超声探头与聚乙烯薄膜之间以耦合剂密闭)。辐照参数:探头频率固定为10 MHz,机械指数为1.9,辐照时间为10 min。动物随机分为上述4组各10只,将处理后的静脉段间置吻合于颈总动脉,建立颈外静脉颈总动脉旁路移植模型。待大鼠苏醒后送回动物房常规饲养7 d。
1.2.4 观察报告基因的表达 转染 pEGFP 7 d后,取出移植静脉段,经固定剂固定15 min后置于恒冷箱切片机冻台上行冷冻切片,将组织横切为厚度为7 μ m的薄片。使用Nikon 80i荧光显微镜在490 nm波长紫外光激发下观察报告基因在静脉组织中的表达。每张切片随机取5个视野,每个视野取3个荧光强度最亮的区域作荧光强度比较。数据采集由NIS-Elements BR(Nikon)软件完成。
1.3 统计学分析
2 结果
2.1 荧光显微镜观察报告基因pEGFP的表达
转染pEGFP质粒7 d后,D组可见明显特异性绿色荧光,主要位于血管平滑肌层,C组也有少量的表达;而A组和B组则无表达(图1)。同时对各组血管组织进行了苏木精-伊红染色,没有发现任何形式的坏死出现(图2)。

图1 荧光显微镜观察报告基因pEGFP的表达Fig.1 The expression of pEGFP in vascular smooth muscle cells examined by fluorescence microscopy
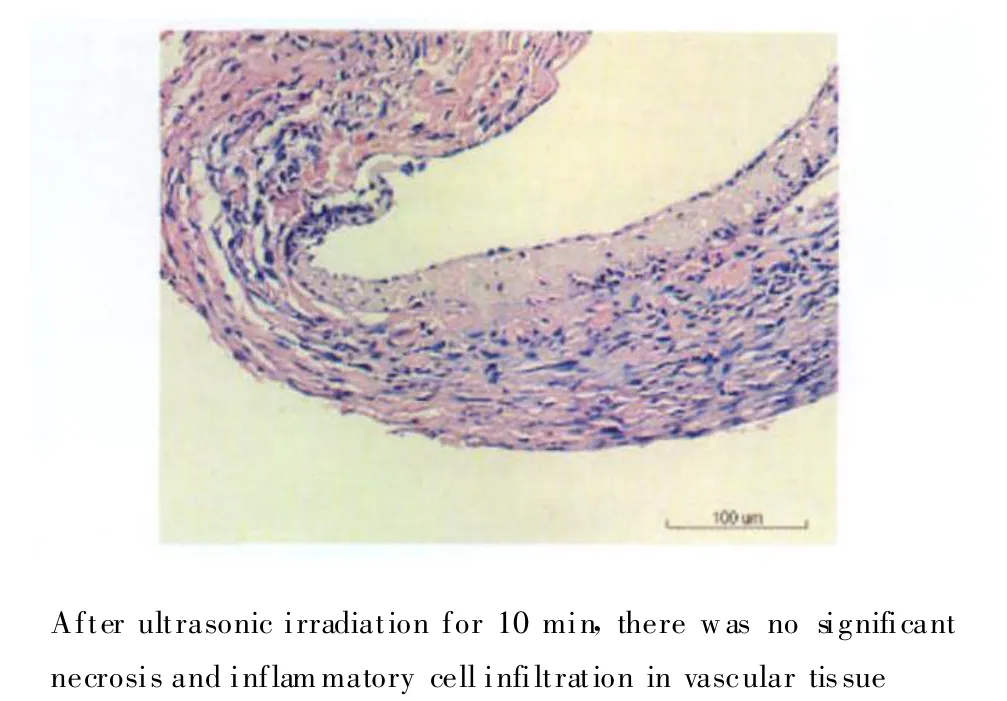
图2 质粒+微泡造影剂+超声辐照组血管组织苏木精-伊红染色(×200)Fig.2 Vascular tissue hematoxy lin-eosin(HE)staining in plasmid+microbubble contrast agents+irradiation group(g roup D)(×200)
2.2 各组绿色荧光强度比较
A组荧光强度为(2.20±0.25),B组为(3.35±0.73),C组为(13.23±1.55),D组为(45.78±5.81)。D组pEGFP的荧光强度显著高于其他各组(均 P<0.05)。见图3。

图3 各组间荧光强度比较Fig.3 Comparison of fluo rescence intensity among the four groups
3 讨论
CABG是目前治疗缺血性心脏病的重要手段,人体大隐静脉(human saphenous vien,HSV)具有取材容易、长度充分、口径大易吻合等优点,目前仍是冠状动脉搭桥术中常用的一种血管材料。然而HSV的远期通畅率却较动脉桥低,其术后第1年阻塞率为15%,之后阻塞率逐年递增1%~4%,10年通畅率仅60%左右[4]。CABG术后静脉桥再狭窄是影响冠心病治疗效果的一个决定性因素。控制内膜和平滑肌增生、防治血管损伤后再狭窄是当今世界多个学科共同研究的重要课题。CABG手术中,患者的大隐静脉被暂时性取出体外,为有效的靶向基因治疗提供了一个独特的时机。如何将外源基因高效地转入静脉组织中是目前基因治疗研究的一个热点。
目前将外源性基因转染入靶细胞的方法主要有病毒载体转染与非病毒载体转染两大类,前者具有较高的转染效率,但存在免疫反应、细胞毒性与安全性等问题;而后者具有安全、简单的优势,但存在转染效率低的弱点。超声微泡型造影剂由于其特殊的构造,能有效吸附基因载体。国内外近年的研究表明,微泡造影剂可以作为一种新型的基因载体,具有减少降解、具备靶向性,并兼有明显提高透膜转染率的特点[5-6]。其基本原理为:声场内的超声波破坏微泡造影剂后,其产生的空化和机械效应一方面引起微循环结构改变,导致血管内皮细胞间隙增宽,另一方面可导致短暂的细胞多孔化,使细胞膜通透性增加[7-8]。有研究显示:微泡强化的空化作用可显著提高体外培养细胞的基因转染水平约300倍[9]。
本研究以Sono vue作为EGFP基因载体,结合靶组织的超声辐照,荧光显微镜下显示移植静脉桥组织细胞内EGFP明显多于质粒浸泡+超声辐照组;而单纯pEGFP组及单纯质粒+微泡组不进行超声辐照时未见EGFP表达,这2组间差异无统计学意义,说明单纯微泡本身在基因转染中并不发挥直接作用,而是结合了超声辐照才可有效增加细胞膜的通透性,提高基因的转染效率。同时对辐照后的血管组织进行了苏木精-伊红染色,没有发现任何形式的坏死出现,这提示在此条件下的超声辐照及其破坏微泡所产生的各种效应并未对血管组织产生致死性损伤,这为将来此种方法的临床应用提供了安全的保证。
本研究表明超声辐照结合微泡造影剂能有效提高基因在移植静脉中的转染,且相对安全,有望在为移植静脉再狭窄的基因防治中发挥作用。但本研究仅以报告基因为研究对象,欲真正实现基因治疗尚须大量细致的研究。
[1] Higman D J,G reenhalgh R M,Powell J T.Smoking impairs endothelium-dependent relaxation of saphenous vein[J].Br J Surg,1993,80(10):1242-1245.
[2] Miller D L,Song J.T umor growth reduction and DNA transfer by cavitation enhanced high-intensity focused ultrasound in vivo[J].Ultrasound M ed Biol,2003,29(3):887-893.
[3] Nishida K,Diota M,Takada T,et al.Sustained transgene expression in intervertebral disc cells in vivo mediated by microbubble enhanced ultrasound gene therapy[J].Spine,2006,31(2):1415-1419.
[4] Akowuah E F,Sheridian P J,Cooper G J,et al.Preventing saphenous vein g raft failure:does gene therapy have a role?[J].Ann Thorac Surg,2003,76(3):959-966.
[5] Khanna S,Hudson B,Pepper C J,et al.Isothiocynate-dex tran uptake by chinese hamster ovary cells in a 1.5 mhz ultrasonic standing wave in the presence of contrast agent[J].Ultrasound Med Biol,2006,32(2):289-295.
[6] Korosoglou G,Hardt S E,Bekeredjian R,et al.Ultrasound exposure can increase the membrane permeability of human neutrophil granulocytes containing microbubbles without causing complete cell destruction[J].Ultrasound M ed Biol,2006,32(2):297-303.
[7] Rahim A A,Taylor S L,Bush N L,et al.Spatial and acoustic pressure dependence of microbubble mediated gene delivery targeted using focused ultrasound[J].J Gene Med,2006,8(11):1347-1357.
[8] 王芬,李开艳.造影剂、超声波介导的基因治疗技术[J].医学分子生物学杂志,2007,2(2):185-188.
[9] Lawrie A,Brisken A F,Francis S E,et al.Microbubble-enhanced ultrasound for vascular gene delivery[J].Gene T her,2000,7(23):2023-2027.

