经门静脉途径输注骨髓细胞后大鼠小肠移植的排斥反应及细胞因子相关改变*
熊 俊 宋自芳
华中科技大学同济医学院附属协和医院肝胆外科,武汉 430022
小肠组织富含淋巴细胞,肠黏膜上皮大量表达主要组织相容性抗原,导致小肠移植术后极易发生严重的排斥反应,且一般的免疫抑制药物难以控制,这也是临床开展小肠移植的主要障碍[1]。本研究通过门静脉途径输注适量的供体骨髓细胞,制造混合嵌合体,观察大鼠小肠移植排斥反应,并分析其细胞因子的改变与病理学改变之间的关系,为进一步研究奠定基础。
1 材料与方法
1.1 实验材料
1.1.1 实验动物及分组 实验动物系北京医学动物中心提供的近交系健康清洁级雄性BN大鼠30只,雌性Lewis大鼠30只,体重260~300 g,饲养条件符合SPF级标准。随机分3组:①对照组:BNLewis组(n=10),异位小肠移植受体Lewis雌性大鼠;②FK506组:BN-Lewis+FK506组(n=10),异位小肠移植受体Lewis雌性大鼠+口服FK506;③PV组:BN-Lewis+BM(P.V.injection)+FK506组(n=10),异位小肠移植受体Lewis雌性大鼠+经门静脉注入供体BN雄性大鼠的骨髓细胞+口服FK506。上述分组中,BN雄性大鼠为异位小肠移植物的供体来源,Lewis雌性大鼠为异位小肠移植的受体。
1.1.2 主要实验药品及试剂 FK506,商品名为普乐可复,临床常用免疫抑制剂,购自日本藤泽公司。IL-2、IL-10的 ELISA试剂盒购自美国 BioSource公司。
1.2 实验方法
1.2.1 大鼠异位节段小肠移植模型的制备 采用肠系膜上动脉-腹主动脉端侧吻合以及门静脉-左肾静脉套管吻合重建供肠血管,远端肠管腹壁造瘘,制备小肠移植动物模型[2]。
1.2.2 供体骨髓细胞的提取、体外处理及受体体内注入 ①供体骨髓细胞的提取:提取供体骨髓细胞,将其调整为2.5×108个/mL。操作结束将细胞悬液置于4℃冰箱。②骨髓细胞活性检测:用锥虫蓝染色3 min后,直接在光学显微镜下计数,确保活性细胞的比例大于95%。③向受体Lewis雌性大鼠注入供体BN雄性大鼠的骨髓细胞:受体小肠移植完毕关腹前,取1 mL骨髓细胞悬液(约2.5×108个细胞),经门静脉缓慢注入受体大鼠体内。
1.2.3 异位小肠移植受体 Lewis雌性大鼠的FK506喂服 术后0~5 d按1 mg/(kg·d)经口灌服FK506悬液。
1.2.4 测定各组异位小肠移植受体Lewis雌性大鼠术后生存时间 分别测定对照组,FK506组,PV组受体大鼠存活时间。
1.2.5 各时间段移植供肠的排斥反应检测及评分各实验组分别于术后第7、14、30天及实验终点时间用乙醚麻醉受体大鼠,通过腹部造瘘口切除0.5 cm的移植肠管,固定、切片,进行移植供肠苏木精-伊红染色。参照Schaefer等[3]的小肠移植排斥反应标准计分:0分为无排斥反应,1分为轻度急性排斥反应,2分为中度急性排斥反应,3分为重度急性排斥反应,4分为慢性排斥反应。
1.2.6 ELISA法测定血清 IL-2、IL-10水平ELISA法测定异位小肠移植受体雌性 Lewis大鼠不同时间段血清中IL-2、IL-10的含量,具体检测操作步骤按试剂盒说明书进行。
1.3 统计学方法
所有资料建成数据库,采用t检验及单因素方差分析,用SPSS 12.0软件进行统计学分析,以P<0.05为差异有统计学意义。
2 结果
2.1 异位节段性小肠移植受体Lewis雌性大鼠生存时间分析
各实验组小肠移植受体Lewis雌性大鼠生存时间分析显示,与对照组(76 d)、FK506组(81 d)相比,PV组(121 d)受体大鼠存活时间明显延长(P<0.01)。
2.2 不同时间点异位节段小肠移植受体Lewis雌性大鼠移植小肠病理变化及排斥反应评分
术后第7天(图1A),对照组腹壁造瘘口外观无水肿,黏膜血运良好,组织病理学苏木精-伊红染色显示黏膜下较多单核细胞侵润,少量黏膜上皮细胞脱落。重度急性排斥现象在术后第14天可观察到,造瘘口黏膜水肿明显,分泌物减少,光镜下(图1B)小肠黏膜绒毛增粗、部分黏膜破坏严重伴溃疡形成,血管周围有大量单核细胞侵润。术后第30天对照组实验大鼠可见到慢性排斥反应现象,造瘘口肠壁增厚、光泽消失、分泌物少且黏稠,光镜下(图1C)小肠黏膜明显萎缩,绒毛平坦,黏膜下见纤维组织增生,可见闭塞的血管。死亡后解剖发现:移植小肠明显扩张,管腔内有大量黏稠的内容物无法排出并压迫正常小肠,供肠管壁增厚质硬,失去柔韧感,呈铅管样改变。与对照组相比较,FK506组严重急性排斥反应的时间推迟至术后30 d,黏膜的破坏程度也没有对照组严重(图1D)。而PV组术后第30天小肠黏膜基本完好(图1E),少数几只实验大鼠可见轻、中度排斥反应。术后3个月,PV组移植小肠也可见不同程度的扩张,肠壁增厚僵硬,绒毛低平,黏膜下可见明显的纤维组织增生(图1F)。对小肠移植受体Lewis雌性大鼠不同时间段排斥反应评分结果见表1。
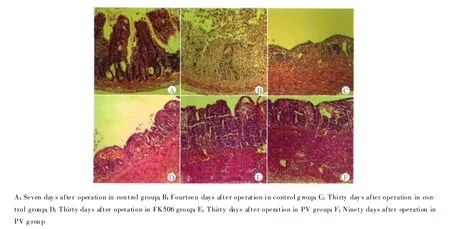
图1 受体大鼠移植小肠病理变化(苏木精-伊红染色,×400)Fig.1 Histopathological change of recipient's bowel(HE,×400)
表1 异位节段性小肠移植Lewis雌性大鼠不同时间段排斥反应评分(±s,n=10)Table 1 Scores of acute rejection of recipients following heterotopic small bowel transplantation(±s,n=10)

表1 异位节段性小肠移植Lewis雌性大鼠不同时间段排斥反应评分(±s,n=10)Table 1 Scores of acute rejection of recipients following heterotopic small bowel transplantation(±s,n=10)
*P<0.01 vs control g roup;△P<0.01 vs FK506 group
Groups 7 d 14 d 30 d Control 0.40±0.00 2.40±0.55 3.60±0.55 FK506 0.20±0.45* 1.20±0.45* 3.00±0.71*PV 0* 0.20±0.45*△ 0.60±0.89*△
2.3 异位小肠移植受体雌性Lewis大鼠不同时间点血清中IL-2的含量
各组移植后受体大鼠血清IL-2浓度均增加,但PV组的IL-2增高幅度明显低于对照组和FK506组(P<0.01),见表2。
2.4 异位小肠移植受体雌性Lewis大鼠不同时间点血清中IL-10的含量
各组移植后受体大鼠血清IL-10浓度也均增加,但 PV组 IL-10升高幅度明显大于对照组和FK506组(P<0.01)。见表3。
表2 异位小肠移植 Lewis雌性大鼠不同时间点血清中IL-2水平(pg/mL,±s,n=10)Table 2 Serum IL-2(pg/mL)levels of recipients following heterotopic small bowel transplantation(±s,n=10)
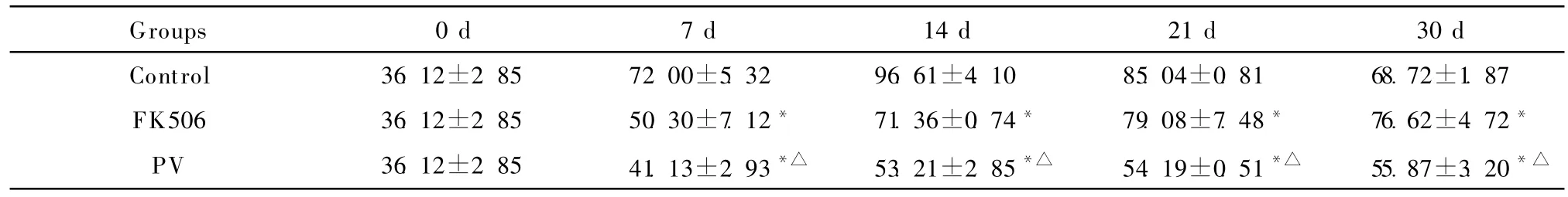
表2 异位小肠移植 Lewis雌性大鼠不同时间点血清中IL-2水平(pg/mL,±s,n=10)Table 2 Serum IL-2(pg/mL)levels of recipients following heterotopic small bowel transplantation(±s,n=10)
*P<0.01 vs control g roup;△P<0.01 vs FK506 group
Groups 0 d 7 d 14 d 21 d 30 d Control 36.12±2.85 72.00±5.32 96.61±4.10 85.04±0.81 68.72±1.87 FK506 36.12±2.85 50.30±7.12* 71.36±0.74* 79.08±7.48* 76.62±4.72*PV 36.12±2.85 41.13±2.93*△ 53.21±2.85*△ 54.19±0.51*△ 55.87±3.20*△
3 讨论
小肠移植是治疗终末期小肠功能衰竭的最后手段,但由于小肠生理结构的特殊性,导致术后排斥反应的发生率极高,急性排斥反应发生率高达90%,移植后9个月仍有1/3的患者发生排斥反应,慢性排斥反应的发生率也高达30%~50%,严重制约了小肠移植的临床应用[3-5]。虽然近年来免疫抑制药物的快速发展使小肠移植排斥反应有所缓解,但总体情况仍不容乐观。由于免疫抑制药对受体免疫系统多为非选择性的广泛抑制,常导致受体出现多种并发症,比如感染、肿瘤、淋巴细胞增生紊乱等[6]。
表3 异位小肠移植 Lewis雌性大鼠不同时间点血清中IL-10水平(pg/mL,±s,n=10)Table 3 Serum IL-10(pg/mL)levels of recipients following heterotopic small bowel transplantation(±s,n=10)
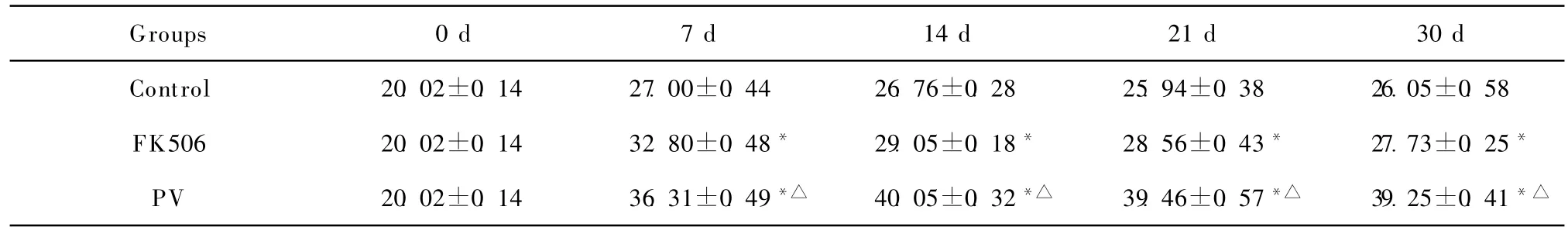
表3 异位小肠移植 Lewis雌性大鼠不同时间点血清中IL-10水平(pg/mL,±s,n=10)Table 3 Serum IL-10(pg/mL)levels of recipients following heterotopic small bowel transplantation(±s,n=10)
*P<0.01 vs control g roup;△P<0.01 vs FK506 group
Groups 0 d 7 d 14 d 21 d 30 d Control 20.02±0.14 27.00±0.44 26.76±0.28 25.94±0.38 26.05±0.58 FK506 20.02±0.14 32.80±0.48* 29.05±0.18* 28.56±0.43* 27.73±0.25*PV 20.02±0.14 36.31±0.49*△ 40.05±0.32*△ 39.46±0.57*△ 39.25±0.41*△
因此,如何成功地诱导移植物产生特异性免疫耐受,同时将免疫抑制药物的毒副作用降至最低是当前小肠移植所面临的重要挑战[7]。
本研究通过使用MHC完全不同的成年BN雄性大鼠作为供体、Lewis雌性大鼠作为受体建立同种异位节段性小肠移植模型,同时输注供体骨髓细胞造成混合嵌合体,依据实时PCR检测受体体内Y染色体特异性序列Sry基因含量的方法,探讨了嵌合体与小肠移植免疫耐受的关系[8]。
本实验研究结果显示,对照组Lewis雌性大鼠术后发生严重的急性排斥反应,腹腔内移植段小肠呈慢性肠梗阻表现,肠腔极度扩张,大量黄色非常黏稠的分泌物瘀积;肠管管壁呈铅管样改变,质硬伴纤维增生明显;光镜下黏膜皱褶变平,小肠绒毛消失,固有层大量纤维组织及肉芽组织增生。而骨髓细胞输注组(PV组)术后恢复较快,供肠造瘘口的肠壁柔软,有光泽,小肠黏液分泌正常。病理检查结果也证实无明显的急性排斥反应发生。并且PV组的生存时间明显长于对照组及 FK506组(P<0.01)。综上所述,提示通过骨髓细胞输注可能造成混合嵌合体状态,可减少或消除小肠移植的急性排斥反应,延长移植物的存活时间,但与慢性排斥反应[9]的相关性还需进一步探讨。
本实验结果显示,与对照组相比较,FK506可降低受体体内IL-2的浓度,延缓急性排斥反应发生的时间,但在生存时间上未见明显的延长,与以往的报道不同[10]。探讨其可能原因如下:①本实验所采用的FK506是口服制剂,受到不同个体胃肠道吸收率影响,可能直接造成实验结果的差异。②本实验给予受体的FK506的剂量是1mg/(kg·d),分别在术后0~5 d给予灌服,这种方案免疫抑制药维持的时间相对较短,可能尚无法达到显效的治疗药物浓度,今后将通过进一步的实验按不同剂量、不同维持时间加以分层研究。
本实验结果还显示,对照组移植术后第7天受体血清IL-2的浓度急剧增高,第14天达到最高峰[(96.61±4.10)pg/mL]。而血清中IL-10浓度术后只出现轻度平缓的升高。术后各时间点受体血清中IL-2浓度变化趋势与供肠黏膜的苏木精-伊红染色观察结果相平行,随着急性排斥反应的发生,血清中IL-2水平急剧升高,IL-10浓度却未见明显变化。而骨髓细胞输注组(PV组)正相反,移植术后14 d开始,血清中IL-10的浓度一直维持很高的水平,而在移植术后30 d内,血清中IL-2浓度却仅轻度升高,供肠病理活检也缺乏急性排斥反应发生的证据。由此可见:对照组血清中IL-2浓度升高相对IL-10浓度的变化更加显著,Th1细胞的功能明显增强,Th1/T h2的平衡向Th1细胞方向倾斜,导致急性排斥反应的发生。而在骨髓细胞输注组(PV组),在同样的时间点受体血清中 IL-10浓度升高相对于IL-2浓度的变化更加显著,Th1/Th2的平衡向Th2细胞方向倾斜,导致免疫耐受的发生[11]。
与临床肝移植不同的是,肝移植术后通过检测转氨酶的变化就能及时地发现急性排斥反应的发生,临床上小肠移植急性排斥的诊断还主要依靠病理检查,缺乏相关灵敏的血清学指标进行早期诊断。而且由于临床上不可能如动物实验那样随时手术切取肠管进行病理活检,仅靠在内镜下取得的少量小肠黏膜组织来诊断急性排斥反应,其诊断的阳性率则更低。因此,当病理组织切片诊断为排斥反应时,大多已经失去最佳的治疗时期。本实验结果显示,从术后第7天开始,对照组受体血清中IL-2浓度就已经成倍上升,IL-10浓度基本恒定,而病理上的典型表现则需要推迟到第14天,甚至要到第21天才能出现。同样,FK506组急性排斥反应病理诊断亦需到术后第30天左右才出现,而其血清中IL-2的浓度于术后第14天就已经明显升高,IL-10的浓度反而轻度下降。相反,在骨髓细胞输注组中,血清IL-2水平一直没有太大的变化,反而IL-10水平明显升高,与此相平行,术后30天内病理组织切片检查也未发现排斥反应的证据。由此可见:急性排斥反应发生时血清中IL-2变化明显早于组织病理的变化。因此,在临床上是否可尝试将受体外周血清IL-2、IL-10浓度共同测定作为监测小肠移植术后排斥反应发生以及调整免疫抑制药物剂量的依据[3,12-13],有待进一步的研究。
综上所述,本实验初步证实了骨髓细胞经门静脉输注能明显延长移植物的存活时间,外周血清IL-2、IL-10浓度变化与小肠移植后急性排斥反应相关。
[1] Cobianchi L,Zonta S,Vigano J,et al.Experimental small bowel transplantation from non-heart-beating donors:a largeanimal study[J].Transplant Proc,2009,41(1):55-56.
[2] 游燊,何晓顺,熊俊,等.成功建立大鼠异位节段小肠移植模型细节分析[J].中华实验外科杂志,2007,24(11):1430-1432.
[3] Schaefer N,Tahara K,Websky M V,et al.Acute rejection and the muscularis propria after intestinal transplantation:the alloresponse,inflammation,and smooth muscle function[J].Transplantation,2008,85(10):1465-1475.
[4] Giovanelli M,Gupte G L,Sharif K,et al.Chronic rejection after combined liver and small bowel transplantation in a child with chronic intestinal pseudo-obstruction:a case report[J].Transplant Proc,2008,40(5):1763-1767.
[5] Li M,Ji G,Feng F,et al.Living-related small bowel transplantation for three patients with short gut syndrome[J].Transplant Proc,2008,40(10):3629-3633.
[6] Schaefer N,Tahara K,Pech T,et al.Inducible nitric oxide synthase ex pression in the intestinal muscularis mediates severe smooth muscle dysfunction during acute rejection in allogenic rodent small bowel transplantation[J].J Surg Res,2008,150(2):159-168.
[7] Starzl T E.Immunosuppressive therapy and tolerance of organ allografts[J].N Engl J M ed,2008,358(4):407-411.
[8] 熊俊,舒晓刚.输注供体骨髓细胞诱导大鼠小肠移植基因嵌合的研究[J].中华实验外科杂志,2009,26(10):1343-1345.
[9] 宋自芳,郑启昌,李伟,等.骨髓细胞参与移植物动脉硬化的作用研究[J].华中科技大学学报:医学版,2007,36(5):620-624.
[10] Mitsuoka N,Iwagaki H,Ozaki M,et al.T he impact of portal infusion with dono r-derived bone marrow cells and intracellular cy tokine expression of graft-infiltrating lymphocytes on the g raft survival in rat small bowel transplant model[J].T ranspl Immunol,2004,13(3):155-160.
[11] Hubbard V M,Eng J M,Ramirez-Montagut T,et al.Absence of inducible costimulator on alloreactive T cells reduces g raft versus host disease and induces T h2 deviation[J].Blood,2005,106(9):3285-3292.
[12] Spahn T W,Ross M,von Eiff C,et al.CD4+T cells transfer resistance against citrobacter rodentium-induced infectious colitis by induction of T h1 immunity[J].Scand J Immunol,2008,67(3):238-244.
[13] Schaefer N,Tahara K,von Websky M,et al.Role of resident macrophages in the immunologic response and smooth muscle dysfunction during acute allograft rejection after intestinal transplantation[J].Transpl Int,2008,21(8):778-791.

