血浆游离FHIT基因杂合性缺失在非小细胞肺癌中的临床意义*
王 敏 徐钏铭 黄 磊 刘卫硕 敖启林△
1华中科技大学同济医学院附属同济医院病理研究所,同济医学院病理学系,武汉 430030
2湖北省黄冈市黄州区人民医院,黄冈 438000
3武汉市中心医院,武汉 430014
肺癌是目前严重危害人类健康的常见恶性肿瘤之一,其发病率和死亡率都很高。如何实现肺癌的早期诊断,以及建立与疗效和预后相关的监测指标一直是临床研究的热点问题。现已发现一些早期肺癌患者的外周血中有循环肿瘤脱氧核糖核酸(DNA)[1],提示:检测肺癌患者外周血中的肿瘤DNA,对肺癌患者的诊断、分期和预后的判断等可能具有重要价值,脆性组氨酸三联体(fragile histidine triad,FHIT)基因为近年来发现的新的候选抑癌基因,与大多数肿瘤发生密切相关,且是肺癌最常见的变异基因之一[2]。因此我们抽提肺癌和良性肺疾病患者组织及血清中的DNA,通过聚合酶链式反应(polymerase chain reaction,PCR)-银染法检测血浆和组织标本FHIT基因的3个微卫星位点D3S1300、D3S1234、D3S4103的杂合性缺失(loss of heterozygosity,LOH),并进行比较;同时对相应的组织病理切片进行FHIT蛋白的免疫组化染色,旨在探讨循环核酸FHIT基因突变检测对肺癌的生物学行为估计、诊断及预后监测的参考价值。
1 材料和方法
1.1 标本来源
收集华中科技大学同济医学院附属同济医院胸外科2006年6月至2007年5月间未接受放、化疗的69例原发性非小细胞癌(non-small cell lung cancer,NSCLC)住院患者,采集患者手术麻醉前和术后4~5 d的静脉血标本(所取标本均获得患者或家属知情同意),并收集其手术切除肿瘤组织的石蜡标本。患者年龄36~78岁,组织学分型以病理诊断为确诊依据,其中鳞癌34例,腺癌22例,其他13例,根据1997年国际抗癌联盟(International Union Against Cancer,UICC)修订的C-TNM标准行TNM 分期:ⅠB期29例,Ⅱ期9例,Ⅲ期 26例,Ⅳ期5例(骨转移2例,肝转移 2例,肝和脑转移1例);淋巴结转移阳性38例,阴性31例。另选取15例良性肺疾病(机化性肺炎3例,炎性假瘤7例,支气管扩张5例)患者手术切除的肺组织并取静脉血标本,及5例健康人静脉血作为对照。所有患者均排除糖尿病、系统性红斑狼疮和类风湿关节炎等自身免疫性相关性疾病。
1.2 取材方法
69例NSCLC患者术前1 d,术后4~5 d各抽取外周静脉血6~8 mL。术后2 h内在癌中心无明显出血坏死区取直径1~2 cm的组织,置-70℃冰箱保存备用。同时收集15例良性肺疾病患者外周静脉血及组织标本,5例健康志愿者的外周静脉血标本。
1.3 DNA抽提
取静脉血6~8 mL置于未添加抗凝剂的真空管内,室温静置1~2 h吸取上层,取淡黄色清亮液至无菌EP管中,立即于4℃条件下以2 500 r/min的速度离心10 min后吸取上层清亮血清。取当次实验所需血清量,余置于-20℃以备用。分离得到血清后按照血浆基因组DNA快速抽提试剂盒说明提取血浆DNA。新鲜组织标本亦按照组织基因组DNA快速抽提试剂盒说明进行DNA的提取。该试剂盒均购于上海飞捷生物公司。所提取的DNA标本经紫外分光光度计定量,吸光度(A)值>1.75。可疑标本重新提取。
1.4 PCR扩增-银染及LOH分析
3对微卫星位点见表1,来自Genome数据库,均由上海英骏生物技术有限公司合成。在30 μ L PCR反应体系中加入基因组DNA 2 μ L,2.5 μ L 10×PCR缓冲液,dNT P 200 μ mol/L,每对引物各 1 μ L,TaqDNA 聚合酶0.4 μ L。循环条件为:94℃预变性5 min,94℃变性45 s,61~65℃45 s,72℃1 min,35个循环后72℃延伸7 min。将PCR扩增产物进行聚丙烯酰胺凝胶电泳,电泳后PCR产物经1.5%琼脂糖电泳检测特异性后,取5 μ L用同体积的甲酰胺变性示踪液(95%去离子甲酰胺、0.5%二甲苯氰蓝、0.5%溴酚蓝、20 mmol/L EDTA、5 mmol/L NaOH、25%蔗糖)稀释,95℃变性 10 min后电泳。含7 mol/L尿素、8%变性聚丙烯酰胺凝胶电泳先在恒流50 mA下预电泳1 h,随后上样。恒流5~10 mA电泳3~4 h。取下凝胶,去离子水洗1遍后,用固定液(10%乙醇、0.5%冰乙酸)固定20 min,去离子水洗2遍;染色液(1.5%硝酸银)染15 min,去离子水洗3遍(<5 s/遍);显色液(1.5%NaOH,0.4%甲醛)显色至条带清晰,用等体积定影液(0.5%Na2CO3)定影 5 min,水洗2遍 。用保鲜膜包裹,室温下干胶,永久保存。与自身白细胞对比,癌组织DNA PCR扩增产物带消失或相对密度减少50%以上时判为 LOH,异常病例需经再次PCR电泳证实。
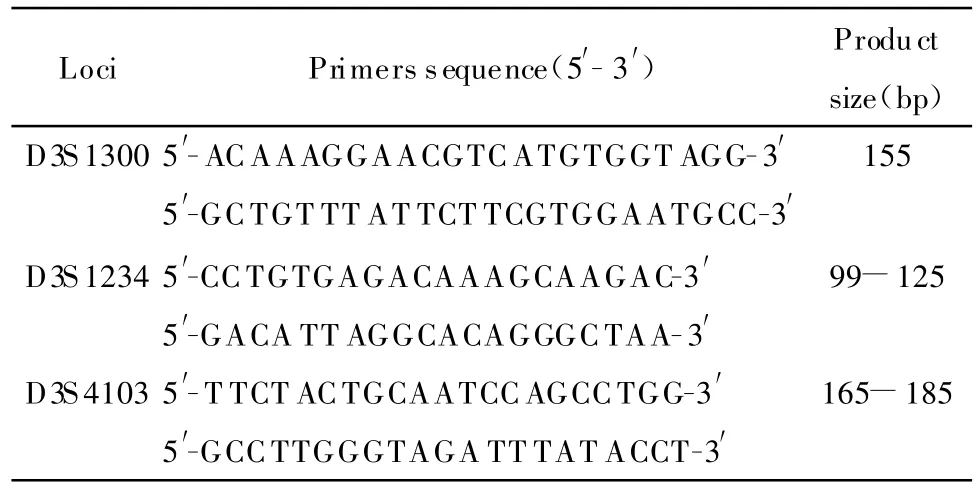
表1 FHIT基因LOH 3个微卫星位点扩增序列Table 1 T he amplified sequence of 3 microsatellite loci of LOH at FHIT gene
1.5 免疫组织化学染色检测FHIT蛋白的表达
石蜡切片采用常规0.01 mol/L柠檬酸盐缓冲液微波抗原修复及LSAB法(亲和素蛋白-生物素酶标免疫组化方法)进行免疫组织化学(IHC)染色。一抗为兔抗人FHIT单克隆抗体(即用型),SP试剂盒和DAB显色试剂盒购于北京中杉生物技术有限公司。实验步骤按试剂盒说明书进行,FHIT基因表达产物定位于细胞质,呈棕黄色颗粒状。每张切片在400倍镜下随机选定10个视野,每个视野计数100个肿瘤细胞,共计1 000个细胞。对阳性细胞所占百分比(<5%计为1;5%~50%计为2;>50%计为3)及染色强度(无色计为0;浅黄色计为1;黄色计为2;棕黄色计为3)进行评分。二者相乘,乘积<3为FHIT蛋白表达显著减少或缺失,即FHIT蛋白表达阴性;≥3为FHIT蛋白表达阳性。每次实验均设对照:以肺癌组织表达阳性切片为阳性对照,以正常肺组织作阴性对照,以TBS替代一抗作空白对照。
1.6 统计学分析
所有数据均使用SPSS 12.0软件进行统计学分析,LOH与各临床指标间的关系采用行×列表χ2
检验和(或)Fisher精确概率检验,NSCLC组织、血浆FHIT的LOH比较用χ2检验,以 P<0.05为差异有统计学意义。
2 结果
2.1 肺癌组织与血浆中FHIT基因LOH的特点及与临床病理的相关性
PCR-银染法检测结果显示:FHIT基因的LOH分布于3个微卫星位点D3S1300、D3S1234和D3S4103(图1),肺癌组织中共有50例标本被检出阳性,总突变率72.5%(50/69例),其中D3S1300位点 LOH 31例,D3S1234位点 LOH 28例,D3S4103位点LOH 20例,同时2个以上位点LOH为29例。50例LOH阳性的组织标本中,其对应血浆中有 37例检测到相同的 LOH,一致性为74.0%;有4例未发生LOH的组织标本其对应血浆中检测到LOH,肺良性病变组织和血浆及健康人血浆均未检测到LOH。3个微卫星位点编号、具体LOH例数及百分率见表2。
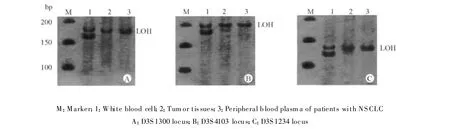
图1 NSCLC患者组织及血浆中FHIT基因LOH图谱Fig.1 The LOH map of tissues and plasma at FHIT gene in NSCLC patients
肺鳞状细胞癌患者血浆FHIT基因发生 LOH为61.8%(21/34),腺癌患者为 54.5%(12/22),差异无统计学意义(P=0.5917)。肺癌患者术前血浆LOH在TMN临床分期中出现的频率(至少1个位点发生LOH)为Ⅰ期 51.7%(15/29),Ⅱ期44.4%(4/9),Ⅲ期57.7%(15/26),Ⅳ期60.0%(3/5),差异无统计学意义(P=0.9262);术后同一患者血浆LOH检测情况:Ⅰ期0例,Ⅱ期11.1%(1/9),Ⅲ期46.2%(12/26),Ⅳ期60.0%(3/5),差异有统计学意义(P=0.0263)。无淋巴结转移组术前血浆的LOH阳性率32.3%(10/31),有局限性淋巴结转移组(肺内、肺门和/或纵隔淋巴结发现转移)LOH阳性率为71.1%(27/38),差异有统计学意义(P=0.0348);同一患者术后血浆LOH检测情况:无淋巴结转移组的LOH阳性率3.2%(1/31),有局限性淋巴结转移组LOH阳性率为47.4%(18/38),差异有统计学意义(P=0.0276)。

表2 肺癌组织与血浆中FHIT基因LOH分布特点Table 2 The characteristic of LOH at FHIT gene in plasma and tumor tissues of patients with NSCLC
2.2 FHIT蛋白免疫组化染色与组织FHIT基因LOH表达的关系
15例作为对照的正常或非肿瘤肺组织中FHIT蛋白染色均为阳性,FHIT蛋白表达产物定位于细胞质,呈棕黄色颗粒状(图 2)。在 69例NSCLC肿瘤组织中54例(78.3%)有FHIT蛋白表达缺失(图3),其中有39例(72.2%)存在1个或 2个FHIT基因位点的 LOH;前文肺癌组织50例FHIT基因 LOH的病例中 37例(74.0%)存在FHIT蛋白低表达,两者相关性有统计学意义(P=0.0417)。

图2 FHIT在肺良性病变组织中的免疫组化染色呈强阳性表达(SP法,×200)Fig.2 The strong expression of FHIT immunohistochemical staining in lung tissues of benign lesions(SP method,×200)

图3 FHIT在肺鳞状细胞癌中的免疫组化染色呈阴性表达(SP法,×200)Fig.3 The negative expression of FHIT immunohistochemical staining in squamous cell carcinoma of lung(SP method,×200)
3 讨论
肺癌是目前全球发病率和死亡率最高的癌症,5年存活率仅13.9%[3]。其发生发展与多种基因异常有关,至今尚缺乏有效的早期诊断和监测疗效及预后的方法。早在1996年Sozzi等[4]首次报道约80%小细胞肺癌和40%非小细胞肺癌存在FHIT基因的mRNA转录异常,76%存在FHIT等位基因的杂合性缺失。不仅如此,在肺癌癌前病变中也有FHIT基因的缺失和转录表达的异常[5],提示FHIT基因异常可能是肺癌发生的早期分子事件及肺癌发生的关键因素之一。虽然其抑制肿瘤的分子机制尚不清楚,按照Deng等[6]的推测可能是FHIT基因参与细胞周期和细胞凋亡调控。FHIT基因缺失可导致其功能蛋白质表达的缺失,蛋白抑制细胞增殖和(或)促进的功能丧失,从而引起组织细胞异常增生而致使机体肿瘤的发生。
循环DNA是存在于人体外周血或者体液中的游离DNA。恶性肿瘤患者血浆/血清中存在高浓度游离DNA,且有研究表明在外周血中循环核酸与肿瘤核酸的结构或功能上的某些特异变化存在一致性,研究证实,肿瘤患者外周血循环DNA主要来源于肿瘤细胞的坏死或凋亡、循环肿瘤细胞或微转移灶的裂解和增殖旺盛肿瘤细胞的释放[7],并且具有肿瘤DNA的某些特征性改变,如p53基因突变[8]、k-ras基因突变、p16ink4过甲基化等。在NSCLC患者的血浆循环DNA,许多学者也检测到了上述肿瘤DNA的特征性变化[9],但关于FHIT基因LOH的检测,血浆循环DNA与肿瘤组织共同报道不多。在本研究中,我们发现NSCLC患者血浆FHIT基因发生LOH者占癌组织阳性病例的74.0%,说明血浆与NSCLC原发灶的LOH具有较高的一致性;本实验中作为对照的5例正常健康人外周血中未检测到LOH,表明血浆LOH的检测具有较强的特异性。
既往研究表明,肿瘤患者血浆和组织LOH变异的发生并非完全一致[10]。本研究也发现4例血浆FHIT发生了LOH,其对应肿瘤组织未检测到LOH,分析可能原因有:组织中正常细胞如间质细胞掩盖了肿瘤细胞的LOH;血浆中肿瘤循环DNA浓度太低PCR无法扩增而出现的“人工假像”,也可能是肿瘤细胞存在异质性克隆[11]。另外,研究中还有部分病例组织标本发生了LOH,而其对应血浆中却未有相同的改变,其原因可能是:仅有少数或无肿瘤DNA释放至外周血;正常DNA污染,血浆DNA污染主要源于慢性炎症或自身免疫性疾病等,如糖尿病、系统性红斑狼疮和类风湿关节炎等,故选择病例时需排除之;另血浆FHIT发生LOH检出率低于组织中,还可能与血浆中DNA浓度较低、提取方法或检测方式的敏感性等因素有关,有待于进一步探索更为敏感的检测方法。
血浆FHIT基因的 LOH与病理类型、临床分期的关系目前尚无研究。本研究发现肺鳞状细胞癌和肺腺癌患者阳性率差异无统计学意义;Ⅰ~Ⅳ期(TMN分期)的阳性率略有差异但无统计学意义(P=0.5917)。由于Ⅰ期即有51.7%的阳性率,提示有较强的早期诊断意义。
既往研究证实有淋巴结转移组与无淋巴结转移组在血浆中游离DNA的含量上有显著的差异[12]。本研究发现没有转移的肺癌,其血浆FHIT的LOH阳性率为32.3%,有淋巴结转移为71.1%,差异有统计学意义(P<0.05),说明血浆FHIT基因的 LOH检测对于发生了转移的肺癌的诊断敏感性更高。
本研究还对所有NSCLC患者术后外周血进行LOH的检测,发现Ⅲ~Ⅳ期、有局限性淋巴结转移患者LOH的检出率明显高于Ⅰ~Ⅱ期、无局限性淋巴结转移患者,因此本研究认为手术前后FHIT基因的LOH检测在NSCLC的预后判断上也具有潜在价值。鉴于临床上缺少简单可靠的预后判断指标,进一步研究血浆FHIT的LOH检测在预后判断上的意义亦有很大的价值(如治疗效果、随访观察等方面)。
比较NSCLC肿瘤组织FHIT基因LOH与蛋白表达的关系,发现72.2%的FHIT蛋白表达减弱或缺失的病例存在FHIT基因LOH,而存在LOH的病例中74.0%FHIT蛋白低表达。癌组织FHIT蛋白低表达与FHIT基因LOH之间有密切的相关性(P<0.05),表现为DNA水平和蛋白水平改变的一致性,提示LOH是FHIT基因表达下调的重要机制。本组15例NSCLC肿瘤组织FHIT蛋白低表达但未检测到LOH,说明LOH并不是导致FHIT表达下调的唯一机制。
Zochbauer-Muller等[13]研究发现FHIT基因启动子甲基化在肺癌和乳腺癌中是频发事件,启动子甲基化是否参与FHIT表达下调还有待研究。另外,本研究只检测了3个发生LOH频率最高位点的情况,不排除在其他位点也存在LOH的可能性。
综上,NSCLC患者血浆与组织FHIT基因的LOH的一致性表达,开辟了应用外周血微创性地进行分子生物学及分子流行病学研究的新途径。展望未来,NSCLC血浆循环DNA的基础及临床研究将成为倍受瞩目的热点。
[1] Sozzi G,Conte D,Mariani L,et al.Analysis of circulating tumor DNA in plasma at diagnosis and during follow-up of lung cancer patients[J].Cancer Res,2001,61(12):4675-4678.
[2] Pekarsky Y,Palamarchuk A,Huebner K,et al.FHIT as tumor suppressor:mechanisms and therapeutic opportunities[J].Cancer Biol T her,2002,1(3):232-236.
[3] Molina J R,Yang P,Cassivi S D,et al.Non-small cell lung cancer:epidemiology,risk factors,treatment,and survivorship[J].Mayo Clin P roc,2008,83(5):584-594.
[4] Sozzi G,Veronese M L,Negrini M,et al.The FHIT gene at 3p14.2 is abnormal in lung cancer[J].Cell,1996,85(1):17-26.
[5] Fong K H,Biesterveed E J,Virmani A,et al.FHIT and FRA3B 3p14.2 allele loss are common in lung cancer and preneoplastic bronchial lesions and are associated with cancer-related FHIT cDNA spicing aberrations[J].Cancer Res,1997,57(11):2256-2267.
[6] Deng W G,Nishizaki M,Fang B,et al.Induction of apoptosis by tumor suppressor FHIT via death receptor signaling pathway in human lung cancer cells[J].Biochem Biophys Res Commun,2007,355(4):993-999.
[7] Jahr S,Hentze H,Englisch S,et al.DNA fragments in the blood plasma of cancer patients;quantitations and evidence for their origin from apoptotic and necrotic cells[J].Cancer Res,2001,61(4):1659-1665.
[8] 刘卫硕,高思海,王敏,等.非小细胞肺癌患者外周血及组织中P53基因突变的研究[J].华中科技大学学报:医学版,2008,37(5):587-591.
[9] Paci M,Maramotti S,Bellesia E,et al.Circulating plasma DNA as diagnostic biomarker in non-small cell lung cancer[J].Lung Cancer,2009,64(1):92-97.
[10] Alan J M,Hardie I D,Briggs J A,et al.Genetic alterations in bronchial mucosa and plasma DNA from individuals at high risk of lung cancer[J].Int J Cancer,2001,91(3):359-365.
[11] Utting M,Werner W,Dahse R,et al.Microsatelite analysis of free tumor DNA in urine,serum,and plasma of patients:a minimally invasive method for the detection of bladder cancer[J].Clin Cancer Res,2002,8(1):35-40.
[12] Depierre A,Lagrange J L,Theobald S,et al.Standards,options and recommendations for the management of non-small cell lung carcinoma patients[J].Bull Cancer,2003,90(2):151-166.
[13] Zochbauer-Muller S,Fong K M,Maitra A,et al.5CpG island methylation of the FHIT gene is correlated with loss of gene ex pression in lung and breast cancer[J].Cancer Res,2001,61(9):3581-3585.

