功能型微泡材料的研究进展
聂新斌,张德浩,颜伟城
(江苏大学化学化工学院,江苏镇江 212013)
引 言
中空结构材料因其特殊的结构而具有良好的反射回波性能。微泡(直径在微米尺度的气泡)是一种典型的中空结构的材料,具有尺寸小、易功能化改性的特点,其制备方法多种多样,可被用作增强医学造影成像的辅助材料(超声造影剂)[1-4]。目前传统的制备方法主要有超声空化法、吸附法、机械法和冷冻干燥法等[5-6]。传统方法的局限性较大,微泡形成过程的不可控使得所制备的微泡尺寸分布范围较宽,限制了其应用。为了解决这一局限,近年来一些制备微泡的新型技术也相继出现。例如,微流体技术法[7-10]、电流体动力技术法[11-13]等。当前关于微泡的研究主要聚焦于实现微泡力学性能、强度和寿命的提高以及个性化功能的设计[14-15]。此外,多领域的研究应用(例如,药物控释[16]、食品行业[17]、水处理[18]、养殖工业[19]等)进一步提高了其研究价值。从良好的制备工艺到可控的形貌尺寸,从单一的功能特性到多功能的设计,微泡逐渐成为了一种基础的功能型载体材料。
关于微泡材料功能化的研究可简单地概述为两方面:一方面是微泡本身稳定性的研究;另一方面是具有特定功能的微泡设计。研究者通过建立相应的数值模型从理论上探讨了微泡的稳定机制,为微泡材料的稳定性优化提供了可行的解决方案。具有特定功能微泡的研究主要集中在功能型物质(如纳米颗粒、药物分子、基因等)的引入和负载。例如,纳米颗粒的诸多性能[20]使得改性后的微泡展现出多样化功能(例如靶向功能、存活时间提升等)。这些功能化物质的引入使得微泡材料从单一载体进一步发展到具有特定功能的微泡材料(如靶向药物载体)[21]。一方面,纳米颗粒的引入可提高微泡的稳定性和存活寿命[22-23];另一方面,经过纳米颗粒改性的微泡在靶向功能和成像能力方面均有所提升[24-25]。这种一石二鸟的研究策略吸引了众多研究者的关注,因此,以微泡材料为载体,纳米颗粒等功能化物质为热点的研究体系成为了微泡材料应用研究领域的一大特色。而功能化研究的深入,也使得微泡从单一的成像助剂材料朝着具有高附加值的功能型载体发展。
本文围绕功能型微泡材料的研究进展,首先介绍了微泡材料的相关基础概念和一些制备方法,随后对微泡功能化改性研究进行了综述,最后论述了微泡材料的相关应用以及未来发展的趋势;归纳整理了目前有关微泡材料功能化研究的现状和需要关注的焦点问题,以期指导后续有关微泡材料的研究设计和功能化改性。
1 微泡的基本结构与材质
从微泡结构出发,可将微泡材料简单归类为三种:第一种是气体在液相中分散,形成无壳膜包裹型微泡,如图1(a)所示。通过控制气体的种类,可形成含有不同气核的微泡材料,这也是提升微泡材料稳定性的重要手段之一。第二种是有壳膜包裹型微泡,如图1(b)所示,选用不同的壳膜材料可制得具有不同功能的微泡(例如,脂质体微泡可用于亲水型药物的封装)。第三种是功能物质引入型微泡,如图1(c)所示,根据功能物质引入方式的不同可分为外膜附着型、内膜附着型和壳膜嵌入型三种。除了结构的不同,根据微泡壳膜物质的不同可将微泡材料分为蛋白质类微泡、表面活性剂类微泡、脂质类微泡、聚合物类微泡以及聚电解质类微泡等[1]。不同壳膜的微泡,其性能也是大不相同(如表1所示),通过不同壳膜材料的优化,功能型物质(如纳米颗粒、药物分子、DNA、siRNA等生物大分子等)的引入可进一步拓宽微泡材料的应用发展[26-27]。

表1 不同壳层材质微泡的比较[1]Table 1 Comparison of microbubbles in different shell materials[1]

图1 微泡的基本结构Fig.1 Structure of microbubbles
2 微泡的制备方法
2.1 传统的制备方法
制备微泡的方法随着研究的深入也逐渐更新换代,传统的制备方法主要有超声空化法、吸附法、机械法和冷冻干燥法等。超声空化法制备微泡主要是对某些低浓度且具有一定黏度的溶液进行超过空化阈值强度的超声处理,这样液体中会形成许多瞬时负压气核,从而产生微泡[5,15]。然而,采用超声空化法制备微泡的声振过程中会产生大量的热[28],这种高密度的热量对于制备药物负载型微泡是极为不利的。吸附法一般用于糖类材料的微泡制备,王巍等[5]指出,吸附法制备微泡的基本原理在于:任何气体饱和的液体中气泡首先在液体中的一些固体表面形成(如容器表面,分散在液体中固体粉末位点等)。相较于前述两种微泡制备方法,采用机械振荡的制备工艺相对简单,且更容易控制,所制得的微泡也更稳定,工艺重现性更好。谭开彬等[29]通过改装机械振荡仪-胶囊式调合器,采用机械振荡的方法来大批量制备微泡。尽管机械法更加适合规模化生产,但是对于精准调控微泡尺寸和控制其尺寸分布而言,机械法就显得捉襟见肘。
冷冻干燥法作为一种辅助性工艺手段,在制备微泡时实际上是与其他制备方法结合起来的,对已制备好的微泡材料进一步通过冷冻干燥处理,与未经过冷冻干燥的微泡材料相比,经过冷冻干燥处理的微泡材料性能更优越。Cho等[30]结合超声法和冷冻干燥的方法制备了脂质/表面活性剂混合的微泡材料,研究发现:经过冷冻干燥处理的样品中微泡数量更多,处理后微泡的表面张力明显优于未经冷冻干燥处理的微泡。此外,Bjerknes等[31]利用高聚合物和牛血清蛋白经过有机相析出,再通过冷冻干燥处理得到尺寸分布范围较窄的微泡。
这些传统的制备工艺在经济性和应用的广泛性方面展现出了一定的优势,但是随着研究的深入,技术要求和材料要求的不断提高使得这些传统的制备方法表现出了较大的局限。因此,寻求新型的制备工艺成为了微泡研究领域的重要分支。目前有关微泡制备的新型技术主要有两种:微流体技术和电流体动力技术,这两种技术为精准调控微泡形成过程和功能化设计提供了新方向。
2.2 微流体技术法
自1992年Manz等[32]报道了有关微型分析系统的概念以来,芯片集成化的微通道技术不断发展,至今微流体技术已经成为了一门全新的工艺技术,在材料合成、药物封装、多孔纳米材料、金属有机框架(MOF)等微纳米材料的高效合成中应用广泛。微流体技术制备微泡是利用一个微小孔道(图2),通过外部的注射装置(注射泵)将液相材料和气相物质注入微通道中(一般为T型结构),这样可制得尺寸均匀的气泡(图3),且制得的微气泡大多呈单分散分布。微流体技术法制备微泡材料的关键在于特定尺寸微通道芯片的制作以及微通道内部流体传输的方式。一般选用被动传输,即在微通道进口处连接上一个注射泵,通过外力的推动来让流体通过微通道,最后由收集口处收集所制备的微泡。Wan等[33]利用流聚式和T型结式的两种微通道制备油水乳剂型微泡材料,研究指出可通过控制流体几何形状来控制微泡的大小以及壳膜的厚度。Xu等[35]在微流体装置中采用横向流动断裂技术制备单分散的微泡,所制得的微泡分散指数为2%,有效地降低了奥斯特瓦尔德熟化效应。Yasuno等[34]以十二烷基硫酸钠(SDS)和脱水山梨糖醇单月桂酸酯(Tween 20)为主要的表面活性剂,以牛血清蛋白(BSA)为主要的微泡壳膜材料,采用微流体技术制备出了尺寸分布在33.6~51.1μm范围内的微泡。此外,一些复合式的制备工艺在连续生产微泡方面展现出相对优势,如Chen等[23]提出了一种结合微流体技术和超声过程的方法(图4),可通过参数的改变来控制微泡尺寸,为微泡的生产提供了极大的便利。这种复合式的创新思路也进一步推动着微泡制备工艺朝着更加简易化、智能化的方向发展[36]。值得注意的是,微流体技术虽然是一种制备单分散微泡的理想方法,操作简单,工艺过程可控,但是其设备精度要求高,同时存在微通道容易被堵塞的问题。
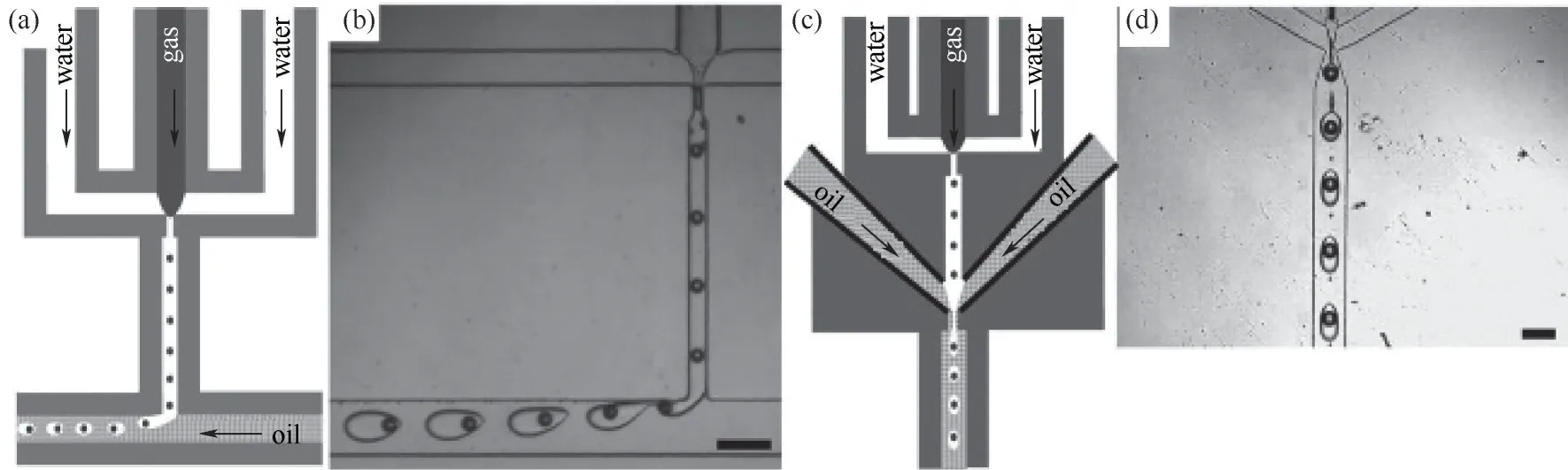
图2 油水乳剂型微泡的实验装置。在聚焦流动的T型结微流体设备(FFT)中封装微泡的水滴的实验图像(比例尺:200 mm)[(a),(b)]。在双流聚焦微流体设备(DFF)中封装微泡的水滴的实验图像(比例尺:150 mm)[(c),(d)]。整个实验过程中水相中含有质量分数为2%的十二烷基硫酸钠(SDS)[33]Fig.2 Experimental setups used to generate gas-in-water-in-oil emulsions.Illustration(a)and experimental(b)image of water droplet encapsulating microbubbles in a flow-focusing then T-junction microfluidic device(FFT).Scale bar:200 mm.Illustration(c)and experimental(d)image of water droplet encapsulating microbubbles in a double flow-focusing microfluidic device(DFF).Scale bar:150 mm.There is 2%(mass)SDSin the water phase for all experiments[33]

图3 采用微流体技术在不同连续相下形成的单分散微泡图[34]Fig.3 Images of monodispersed microbubbles formed using microfluid under different continuous phases[34]
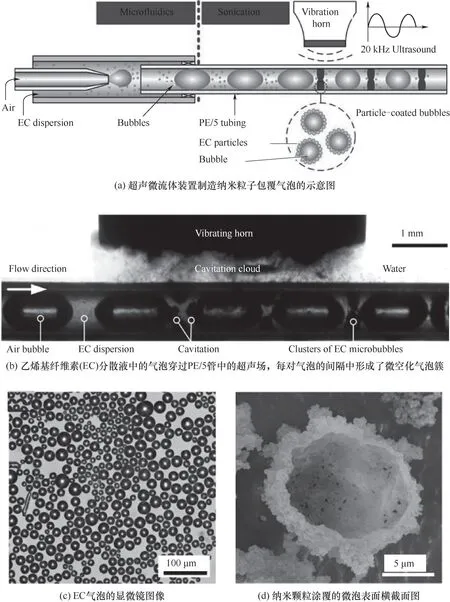
图4 超声-微流体技术制备微泡[23]Fig.4 Sonication-microfluidics for microbubbles fabrication[23]
2.3 电流体动力技术法
电流体动力技术[37-39]也称为电喷技术,随着研究者对同轴喷嘴针头研究的推进[38,40-41]。利用该技术进行微泡制备成为了可能。基于传统的电喷设备,将喷嘴改换成同轴针,便可形成制备壳核结构液滴的简易装置(图5)。其核心器件主要包括内核材料、外壳材料的注射泵(图5中pump1、pump2),高压电源发生装置,同轴针喷嘴和接地收集台。利用该装置制备微泡材料时只需要将内核材料置换为气体,外壳材料置换为微泡壳膜材料。通过调节气体和液体注射的速率、操作电场强度、同轴针内径和外径的大小可控制气泡的形成速率和尺寸大小。2007年,Farook等[37,42]首次报道了利用电流体动力技术进行微泡制备的方法,因为所用喷嘴是同轴针,因此也称之为同轴针电流体动力技术(CEHDA)。采用该方法,Farook等成功地制备出了甘油-空气体系的微泡。同时,Farook等通过与微流体技术法对比指出:微流体技术法制备微泡对于微泡尺寸控制的关键在于微通道的大小,而电流体动力技术法的核心在于喷嘴孔径的大小和操作过程中电压的高低。相比于微流体技术,电流体动力技术法从生产规模上提升了几个数量级。此外,通过控制电压的大小,气液两相物质注射通量的大小以及制备材料导电性的改善都可从不同程度上提高电流体技术制备微泡的稳定性[14,43]。另外,由于对不同的微泡材料而言,其最优的操作条件千差万别,因而,利用同轴针电流体动力技术进行微泡制备的主要研究兴趣也逐渐变为对不同材质微泡最优操作条件的研究[14,43]。

图5 CEHDA工艺生产均匀核-壳结构材料装置示意图。区域A代表同轴喷嘴和收集器。区域B代表喷嘴尖端附近的区域。同轴喷嘴由具有不同的内径和外径的核层和壳层毛细管组成,尺寸以毫米为单位[40]Fig.5 CEHDA processfor producing uniformcomposite core-shell structured.Domain A consists of the coaxial nozzle and the collector.Domain Bconsists of the region near the nozzle tip.The coaxial nozzle consists of core and shell capillaries with inner and outer diameters as indicated above,and the dimensions are given in millimeters[40]
电流体动力技术法制备微泡的出现,引起了许多研究者对于微泡的研究兴趣。Parhizkar等[44]基于电流体动力学的基础原理,对微流体技术和电流体动力技术进行优化整合(如图6所示),对一个T型结的微流体装置进行了改进,研究表明随着施加电压的增大,微气泡的尺寸能够减小到毛细管直径的25%左右,且微泡单分散性良好(分散性指数约为1%)。电流体动力技术通过控制电场来精准控制微泡尺寸,相比于微流体法减小微泡的尺寸只能通过重新定制更小尺寸的微通道芯片实现(往往尺寸越小的微通道芯片的制作难度极大)而言,电流体动力技术的开发一定程度上弥补了微流体技术的缺陷。

图6 电场辅助式微流体T型结微泡制备实验装置图[44]Fig.6 Experimental setup of T-junction with electric field assisted for microbubble preparation[44]
2.4 其他方法
为了满足不同的应用需求,研究者们往往通过一些制备工艺的组合或者改进来达到理想的效果。一些新奇的制备方法诸如薄膜水化法[45]、加速旋压法[46]、界面纳米沉淀法[47]、多通道陶瓷膜法[48]等随之出现。不同的制备工艺在生产微泡材料中都展现出了独特的优势,例如Chen等[23]提出了基于超声微流体技术的纳米微泡制备方法,与传统的超声方法相比,这种超声微流体连续流方法具有无限的气核,可连续产生泡沫,且停留时间更短。然而,其中有些方法只适合于实验室的研究,难以进行工业化发展。虽然多样化的制备方法给微泡的生产提供了不同的研究路径和方向,但是切实可行的微泡制备工艺仍旧是基于传统工艺的延伸发展。在传统工艺上的整合改进,则有利于研发具有优势的新型复合型工艺技术。
3 微泡材料的功能化
本文将微泡材料的功能化研究归纳为两个方面:一方面是提升微泡材料的存活时间(稳定性);另一方面是进行功能型物质的引入。稳定性的提升主要通过壳膜材料的优化或者气核材料的优化来降低气体的溶解扩散,从而延缓微泡的消融/破碎行为。功能型物质的引入则可使得微泡具有特定功能(例如可进行药物包埋、可实现靶向定位、具有磁响应功能等)。
3.1 微泡材料的稳定性
微泡材料的稳定性是限制其应用的主要难点,为了得到性能稳定的微泡,研究者从微泡本身的破碎机制出发进行了相应的研究。就制备材料本身而言,由于气泡在液体中缺乏稳定性,因此会迅速溶解,故而微气泡必须用外壳封装,外壳一般是由脂质或蛋白质封装而成的[1]。目前常见的微泡的制备原材料就集中在脂质、蛋白质以及一些合成的聚合物大分子之间。总的来说,微泡材料的稳定性提升一般可通过降低其表面张力或者采用不同的内充气体来实现。
为全面了解微泡的溶解机理,研究者进行了多种数值模型的验证,其中具有代表性的有Duncan等[49]的微管技术,Borden等[50]的层流灌注方法以及Kabalnov等[51]所使用的声造影衰减持续性定性测量溶解时间等方法,为了获得更具普适性的溶解机理,Kwan等[52]研究了脂质微气泡在多气氛系统中的稳定机理,经模型验证指出当表面张力是动态时,微泡的溶解行为可以用单层膜的破裂、塌陷和堵塞来解释。这也进一步说明,单分子层作用对微泡的稳定性和尺寸分布有着至关重要的影响。
脂质类微泡一般都满足Epstein-Plesset模型的生长机理,根据经典的Epstein-Plesset模型理论可知:液滴的溶解速率可以描述为液滴半径(R)随时间(t)的变化:

式中,D为溶质(液滴)在溶剂介质中的扩散系数;ρ为溶质的密度;f为初始溶解浓度与液滴周围介质饱和时的浓度比(f=C0/Cs),Cs为液滴处于饱和状态的物质浓度,C0为液滴初始溶解浓度。这个微分方程与时间有关,忽略了界面张力。此外,Duncan等[49]还指出,如果R≪Dt且R由式(2)所确定(假设达到稳定状态是一个快速过程),则式(1)中的稳态部分的暂态方法可以忽略。

但是,上述两个微分方程在验证溶解速率时都忽略了液体表面的界面张力,经典的Laplace方程认为微泡的大小与界面张力(σ)有关,由式(3)所确定:

式中,ΔP为微泡的压差;R为液滴的半径。压差与微泡半径R呈反比关系,在界面张力σ一定时,越小的微泡就有着越大的压差,越大的内外压差也就意味着微泡越容易破碎。故而在控制微泡尺寸的同时,降低微泡壳膜材料的表面张力(界面张力)便是提高微泡稳定性的重要手段之一,为此研究者指出制备性能稳定的微泡可通过添加表面活性剂的方式来实现[53-54]。
除了利用表面活性剂来进行微泡稳定性的优化,其他物质的引入也有利于微泡稳定性的提升。Mørch等[55]发现负载有Fe@Fe3O4(core@shell)纳米颗粒的微泡在制备后的8个月里,其稳定性依然良好。Ma等[56]报道了一种利用Traut试剂对蛋白质进行单步表面处理来稳定蛋白类微泡的方法,制得的蛋白类微泡的稳定性远优于未经改性的微泡。Mohamedi等[22]在微泡表面负载了一层金纳米颗粒,与仅涂覆表面活性剂的微泡进行比较,发现负载有金纳米颗粒的Au@DSPC微泡的稳定性有了极大的提高,其保存时间最长可达到3 d(图7)。除了负载纳米颗粒,研究者发现通过选用性能更加稳定的气体作为微泡内部的气核也能一定程度上增强微泡的稳定性能[57-58]。Yan等[14]研究发现将常用的空气换成SF6气体可增加微泡的稳定性。相比于同条件下空气作为内部充气,利用SF6气体作为内部充气制得的微泡的寿命明显优于空气填充的微泡(图8)。
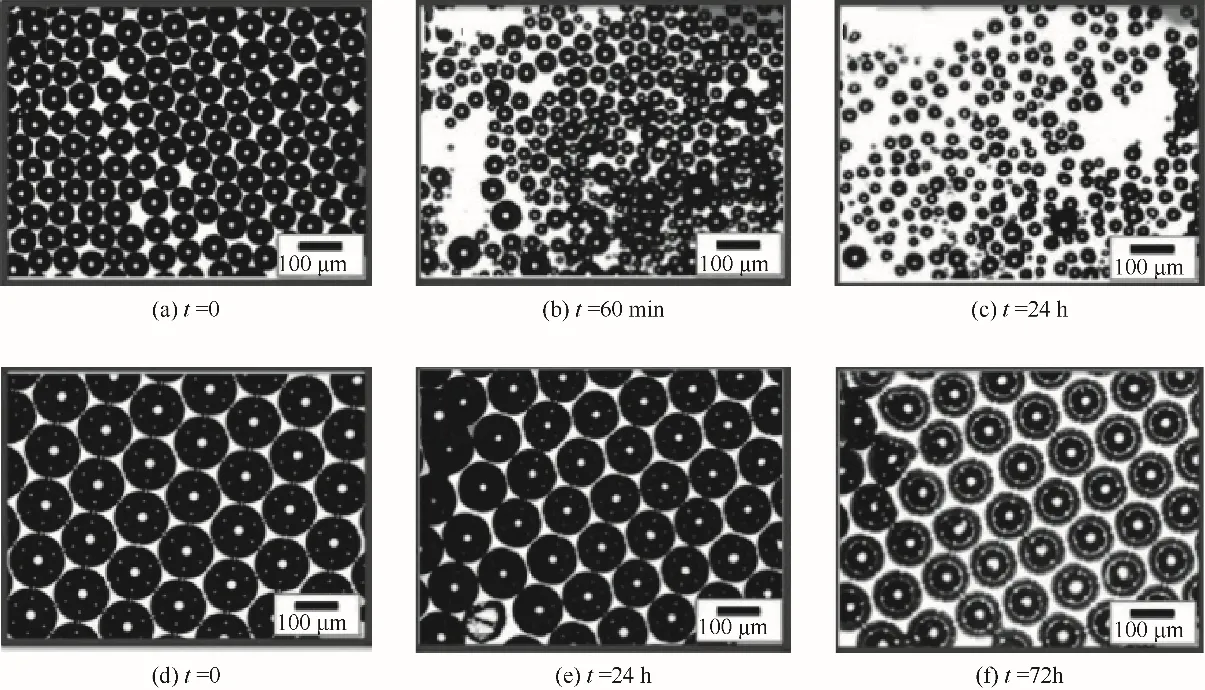
图7 不加金纳米颗粒[(a)~(c)]和添加金纳米颗粒[(d)~(f)]的微泡稳定性比较[22]Fig.7 Comparison of the stability of surfactant coated microbubbles without[(a)~(c)]and with the addition of gold nanoparticles[(d)~(f)][22]

图8 空气和SF6填充的脂质MB的平均数密度(a)和平均直径(b)[14]Fig.8 Mean number density(a)and diameter(b)of air and SF6 filled lipid MBs over a span of one hour[14]
关于微泡材料稳定性优化的研究大多是基于降低微泡壳膜材料的表面张力和抑制微泡中气体溶解的原理出发[22,59]。此外,有研究者从微泡尺寸和壳膜的相对比率出发,证明了通过控制微泡半径和壳膜厚度在一个临界比(0.042)之上将有利于提升微泡的稳定性[60-61]。
3.2 微泡材料的功能化物质的引入
纳米颗粒是一种应用广泛的功能化改性材料,已经在生物医学和制药方面表现出广阔的应用前景[20,62]。纳米颗粒的引入是微泡功能化的主要方式之一,无论是金纳米颗粒还是氧化铁纳米颗粒的负载都成功地表明:通过纳米颗粒的装载,微泡不仅在尺寸分布上变窄,同时可使得微泡展现出新性能[63-65]。Brismar等[63]用磁性纳米颗粒对微泡进行改性,改性后的微泡可用于多模态的医学造影成像。Mørch等[55]在利用纳米颗粒改性的基础上对微泡表面进行PEG(聚乙二醇)涂覆,制备得到的微泡在超声介导条件下,其多模态成像功能更为显著。
除功能性纳米颗粒的引入,其他功能性物质的负载也可拓展微泡的性能。例如,Oeffinger等[53]将纤连蛋白肽片段与表面活性剂偶联在超声造影微泡上,得到了具备靶向和成像功能的造影剂。Ke等[66]在其研究工作中指出,通过量子点对微泡材料进行修饰可增强其双模成像功能。随着造影成像的应用发展和功能化药物的引入,利用微泡进行药物的局部控释也成为了微泡研究的热点之一,Yan等[43]利用磷脂基微泡和牛血清蛋白(BSA)微泡,制备了负载有治疗缺血性中风的药物纤溶酶原激活物(tissue plasminogen activator,tPA),将微泡材料拓展到功能化药物载体方面。Xiong等[67]认为聚合物微泡在造影和载药方面有着极具优势的发展前景,但由于聚合物分子在体内的作用关系尚不明确,其在体内的安全性很难被保证,因此聚合物基微泡材料目前还难以实现医学临床应用[31]。
目前对于微泡功能化改性的方法主要以纳米材料或者功能化药物的负载来实现,经过功能化改性的微泡所携带的物质对于制备过程有着不同程度的要求,特别是进行药物负载型微泡的制备时,相关功能化药物的包埋与保存对制备工艺提出了新的要求,因此进行普适化和个性化的微泡制备工艺探究是极为必要的。
4 功能微泡的应用
4.1 超声造影剂
超声造影剂是微泡的主流应用,其在不同超声强度下展现出不同的回声行为。在低强度的超声环境中微泡随着全身的血液循环沿着血管流动;高强度的超声条件下微泡会随着超声强度的变化而破碎。基于这一特性,研究者将一些药物嵌入微泡壳膜中来实现药物靶向运输的目的,再结合造影成像以达到诊疗一体化的治疗手段[16,68-69]。
超声造影微泡发展至今可概括为三个阶段:无壳膜包裹的CO2气核型;壳膜包裹的空气核型;壳膜包裹的惰性气核型(例如氟化烷基气体)[70]。进行超声成像时,相比于周围组织的不可压缩性,微泡造影剂的气核表现出理想的可压缩性。可压缩性使得微泡材料相比于固体或者液体材料有着较高的反向散射信号[1],因此微泡材料会表现出更加良好的造影成像能力。超声介导下的微泡表现出的回应行为主要有两种:反向散射和惯性空化。反向散射主要用于造影成像,惯性空化主要用于药物或者基因的控释。图9详细展示了微泡在不同强度的超声条件下的回应行为。如图9(a),中低压力的超声场中气核的振荡产生一种可探测的反向反射信号,此外,液体在微泡周围的流动产生剪切力可促进微泡对药物的释放和附近细胞对药物的吸收;如图9(b),在较高压力的超声场下微泡会随之破碎;如图9(c)、(d),在适当的超声压力下当其低于破碎阈值时,微泡的气核会逐渐溶解,微泡的尺寸也随之逐渐变小;如图9(e),在低频率和高压力的超声条件下会造成微泡的惯性空化,微泡周围会产生振荡波和卷曲射流;如图9(f),低压条件下,附近的微泡共振会产生辐射力,使得微泡朝着远离超声源的方向移动。

图9 超声介导下的微泡行为[1]Fig.9 Useful ultrasound-mediated effects of microbubbles[1]
Qin等[68]探索了微泡成像模式、微泡振荡模型和微泡与内皮细胞的相互作用,并指出微泡膨胀和坍塌的速率取决于微泡直径以及超声脉冲中静息微泡的频率、相位和振幅等(详情如图10所示)。提高稀疏峰值压力,降低超声频率和静息微泡的尺寸会增加微泡的膨胀和破碎的可能性。此外,超声造影用微泡对于其尺寸有着特定的要求,Unnikrishnan等[24]指出用作超声造影剂的微泡平均直径为几微米。

图10 微泡在两个周期正弦信号下的相对膨胀。在2.25 MHz,稀疏峰值压力(peak rarefactional pressure,PRP)310~1200 kPa(a);PRP为800 kPa(b)[68]Fig.10 Relative expansion of microbubbles during insonation with a two-cycle sinusoid at 2.25 MHz with a PRPranging from 310 kPa to 1200 kPa(a);with a PRPof 800 kPa(b)[68]
4.2 药物载体
进行药物的负载运输是目前微泡的最新研究热点之一。将药物附着在脂质、蛋白质或者聚合物分子的微泡壳膜材料中再结合微泡在超声介导中的流变性能实现药物的定向运输和控制释放对于功能化靶向药物载体的研究有着指导性的研究意义。Deelman等[71]在2010年的综述成果中详细介绍了利用载药微泡在超声介导下对肾脏进行靶向治疗的研究报道,包括微泡的声学性能到药物局部释放的机理(如图11所示)以及微泡在肾脏中可能存在的危害。载药微泡的出现有望改善相关疾病的治疗效果,为解决由血脑屏障、脊髓屏障等体自身的排斥反应造成药物利用率低下的问题提供了可行的思路。Otani等[72]利用内酰胺对微泡进行表面修饰可增强与糖蛋白Ⅱb/Ⅲa的结合,是功能性靶向定位的典型代表之一。Yan等[43]制备出负载治疗中风的药物tPA且具有超声响应触发释放性能的微泡,基于超声碎泡的靶向定位机理,实现了靶向功能的可调控性。Tayier等[73]将气泡作为非病毒基因载体,借助超声空化将基因有效导入肿瘤细胞的报道,所合成的气泡为图像引导和高效基因传递提供了强有力的工具。进行载药微泡的研究,一方面可提高药物的利用率,另一方面可实现疾病的个性化定位治疗,因此能进一步强化相关疾病治疗手段。

图11 载药微泡进行靶向运输的机理示意图(以肾脏为靶向区域)[71]Fig.11 Schematic diagramdemonstrating local delivery of drugs to the kidney using microbubbles and ultrasound[71]
4.3 其他应用
医药领域是微泡大规模应用的优势点,实际上,微泡材料在水处理、食品工业[74-75]等中都有着较大的应用潜力。Wright等[76]报道了微泡在水处理工业曝气过程中的作用,表明了微泡的引入会增强反应器中的一些大分子物质的分散,进一步提高氧化分解的过程。此外,最近还报道了一种利用微泡处理来对鲤科泥鳅进行浸浴免疫以达到接种效果[19]的研究。不同行业领域的应用还需要进一步的研究和大胆尝试,以实现功能型微泡材料的创新应用和产业化的转型发展。
5 总结与展望
诸多研究表明功能微泡有着极大的市场潜力,不同分支的研究主要朝着制备工艺的优化及精准可控和微泡功能化手段的发展推进。传统制备工艺的局限在于所产微泡的尺寸分布范围较宽,对于尺寸要求较高的医用微泡而言,需要经过二次筛选工艺。尽管可精准控制尺寸和功能化的微泡制备方法(如微流体技术、电流体动力技术等)逐渐兴盛起来,由于研究深度的欠缺(特别是进行工业化的扩展研究少有报道),微泡制备工艺仍然存在诸多挑战。因此,进行微泡制备工艺的简易化、智能化研究仍需进一步发展。医药领域是微泡的主流应用领域,也是高附加值微泡研究的潜力所在,在保留微泡原有的良好声学性能的同时,经过功能化改性后的微泡还需兼具特定的功能是医用微泡的重要特点。此外,医用微泡的安全性仍然需要考虑,相比于尺寸安全性的考量,医用微泡在生物体内部的协同作用机制的研究也是必不可少的。

