混合离子液体催化反应精馏合成乙酸正己酯
宋振兴,崔现宝,张缨,张雪梅,何杰,冯天扬,王纪孝
(天津大学化工学院,化学工程联合国家重点实验室,天津 300350)
引 言
乙酸甲酯(MeOAC)是生产PVA(聚乙烯醇)过程中的副产物,工业上乙酸甲酯的应用十分有限,因此常常通过酯交换反应将乙酸甲酯转化为高附加值的酯[1-4]。乙酸正己酯(HeAC)是一种重要的溶剂[5],通过乙酸甲酯和正己醇进行酯交换反应,可得到乙酸正己酯产品,同时获得的甲醇是生产PVA的原料,能够进行循环利用。
酯交换反应的传统催化剂是无机酸,例如H2SO4、HF和H3PO4等,而无机酸具有较强的腐蚀性,难以回收,容易造成一系列的环境问题。为了解决这些问题,在酯交换反应中开始选用分子筛、离子交换树脂等固体催化剂[6-11]。但是固体催化剂存在容易失活、装填困难以及热稳定性差等问题[12]。离子液体作为一类同时具备优良溶剂性能与催化活性的新兴绿色催化剂,在各类反应中有着广泛的应用[13]。Zhang等[14]报道了离子液体在催化酯交换生成生物柴油领域的应用,Deshmukh等[15]进行了离子液体催化碳酸二甲酯和苯酚酯交换反应的研究。混合离子液体,又称“复盐离子液体”[16-17],通过离子液体的混合来调控离子液体的密度、黏度、电导率以及溶解性,为离子液体的设计拓宽了渠道[18-22]。Larriba等[23]进行了混合离子液体萃取的研究,Taige等[24]报道了混合离子液体在电化学中的应用,Yang等[25]报道了单一和混合离子液体催化乙酸甲酯酯交换反应的动力学研究。将混合离子液体作为酯交换反应的催化剂,不仅起到调控催化剂物理性质的作用,还可以加快化学反应速率。离子液体由于具有极低的饱和蒸气压,仅通过简单蒸馏过程便可回收重复利用,节省分离过程中的能耗,同时避免环境污染。
离子液体催化反应精馏是一种新型的反应分离集成方法,它结合了反应精馏和离子液体各自的优势。反应精馏中反应过程和分离过程相互促进,且离子液体仅采用闪蒸分离便可回收,从而节省设备投资并降低能耗[26-27]。Peng等[26]报道了离子液体[Hpy][HSO4]催化反应精馏合成乙酸异丁酯。Yang等[28]研究了离子液体催化酯交换反应精馏合成异丙醇。至今未发现有关混合离子液体催化乙酸甲酯和正己醇(HeOH)的反应精馏研究。
本文从5种具有不同阴、阳离子结构的质子酸离子液体中筛选出1-丙基磺酸-3-甲基咪唑三氟甲烷磺酸盐([PSO3HMIm][OTf])作为乙酸甲酯和正己醇酯交换反应的催化剂,采用离子液体1-辛基-2,3-二甲基咪唑双(三氟甲烷磺酰)亚胺盐([OMMIm][Tf2N])与其混合获得混合离子液体催化剂。测定了混合离子液体催化乙酸甲酯酯交换生成乙酸正己酯的反应动力学数据,拟合实验数据得到反应动力学方程。在反应动力学研究基础上,建立乙酸甲酯酯交换反应精馏工艺流程,通过模拟计算探究了催化剂用量、回流比、持液量、反应段塔板数、进料位置及理论板数对混合离子液体反应精馏过程的影响,获得了优化的操作和设备参数。
1 实验部分
1.1 实验试剂
实验中所用的试剂如表1所示。所有试剂不需进一步处理,直接使用。所用离子液体的含水量均小于0.0002(经卡尔-费休滴定法测定)。

表1 实验试剂Table 1 The reagents used in experiment
1.2 实验装置和实验步骤
酯交换反应在一个带有机械搅拌装置以及装有温度计和冷凝器的四口圆底烧瓶中进行,通过恒温水浴来控制反应体系的温度,精度为±0.01 K。采用循环冷冻水进行冷却,冷凝器的作用是确保挥发出来的反应组分冷凝并回流至反应体系中。实验过程中从取样口进行取样分析。
实验步骤:将称量好的正己醇和催化剂加入四口烧瓶中进行预热,相应量的乙酸甲酯加入单口烧瓶中预热,待预热温度均达到设定温度时,将单口烧瓶中的乙酸甲酯迅速加入四口烧瓶中,同时开始计时。实验过程中间隔一定时间便进行取样分析,当四口烧瓶内各个组分浓度趋于恒定值时该反应体系达到平衡,计时结束。
1.3 分析测试方法
实验样品采用气相色谱仪(SP-1000)分析,采用修正面积归一法定量。气相色谱检测条件为:FID检测器,采用Wel-30毛细色谱柱,规格为50 m×0.32 mm×0.5μm。进样器、柱箱、检测器温度分别为383.15、473.15、503.15 K。载气氮气、氢气、空气流量分别为30、30、300 ml/min。离子液体在气相色谱中不出峰,因此气相色谱得到的是扣除离子液体后各组分含量,根据这些数据计算乙酸甲酯转化率。由于反应是液相反应,反应过程中体积变化很小,反应液的体积采用初始投料体积,离子液体的浓度采用式(1)计算:
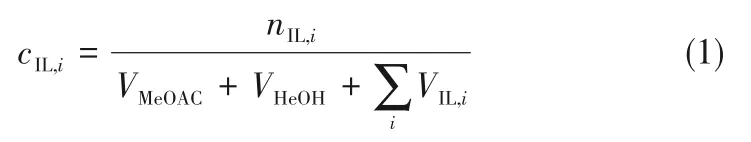
式中,c为离子液体浓度;n为离子液体物质的量;V为初始投料组分的体积。
2 离子液体催化性能和反应动力学研究
通过实验评估,搅拌速率(100~300 r/min)对酯交换反应速率几乎没有影响,因此以下所有实验的转速值均设定为200 r/min。
2.1 单一离子液体催化剂的筛选
设定反应温度为323.15 K,催化剂浓度为0.2 mol/L,反应物乙酸甲酯和正己醇初始摩尔比为1。磺酸功能化Brönsted酸性离子液体由于合成路线简单得到了广泛的应用[29-30],在酯交换反应中表现出良好的性能[25],因此本文选择五种不同阴阳离子结构的磺酸功能化Brönsted酸性离子液体,考察其对该酯交换反应的影响,结果见图1。
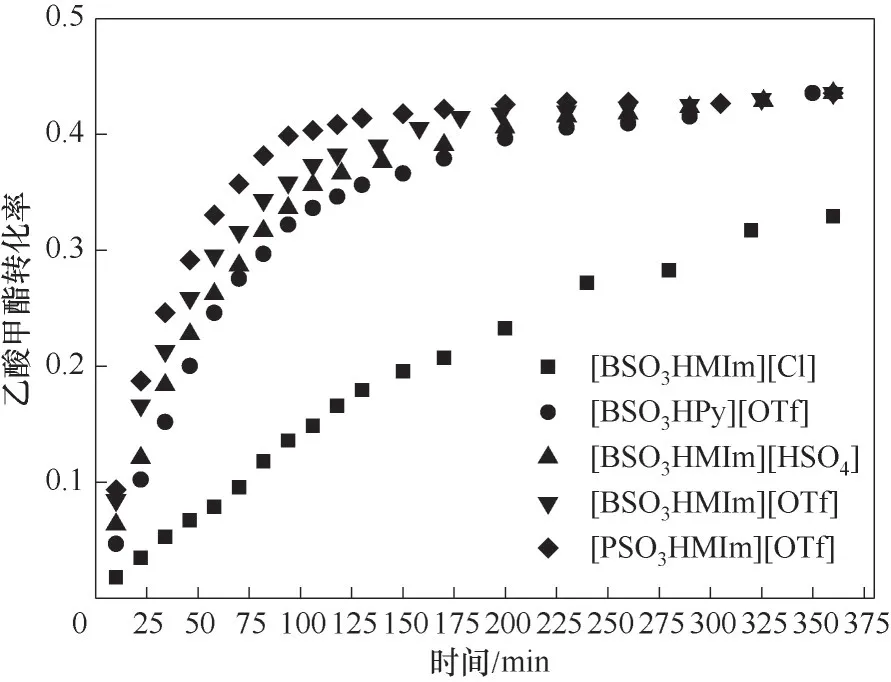
图1 不同离子液体催化剂对酯交换反应的影响Fig.1 Effects of different ionic liquid catalysts on transesterification
由图1可以看出,不同结构的离子液体具有不同的催化活性,催化活性由大到小是:[PSO3HMIm][OTf]>[BSO3HMIm][OTf]>[BSO3HMIm][HSO4]>[BSO3HPy][OTf]>[BSO3HMIm][Cl]。一般来说,质子酸离子液体催化剂的活性与酸性强弱有关,以上五种离子液体的酸性由大到小依次是:[BSO3HMIm][HSO4]>[PSO3HMIm][OTf]>[BSO3HMIm][OTf]>[BSO3HPy][OTf]>[BSO3HMIm][Cl][25,31-33]。这五种离子液体催化剂的催化活性顺序和酸性强弱顺序并不完全相同,主要原因是这五种离子液体均不能完全溶解于反应体系当中,其催化活性不仅和催化剂的酸性强弱有关,也和催化剂与反应体系的溶解度相关[34]。离子液体[PSO3HMIm][OTf]酸性较强且与反应体系相溶性较好,呈现出最高的催化活性,因此选择它为后续反应催化剂。
2.2 混合离子液体催化的研究
如2.1节所述,离子液体催化性能受到其在反应体系中溶解性的制约,[PSO3HMIm][OTf]不能够完全溶解于反应体系中。因此,选用极性较弱和黏度较低的离子液体[OMMIm][Tf2N][35]与其混合来提高催化剂在反应体系中的溶解度。设定反应温度为323.15 K,初始反应物摩尔比为1,催化剂的浓度为0.15 mol/L。[OMMIm][Tf2N]和[PSO3HMIm][OTf]的摩尔比由0.5∶1变化到2∶1,考察不同混合比对乙酸甲酯酯交换反应的影响,结果见图2。
由图2可知,添加[OMMIm][Tf2N]对该反应的反应速率产生影响。当[OMMIm][Tf2N]和[PSO3HMIm][OTf]的摩尔比从0变化到1∶1时,乙酸甲酯酯交换的反应速率逐渐增大,而再增大摩尔比时,反应速率基本维持不变。离子液体[OMMIm][Tf2N]虽然不能够解离出H+,不能起到催化作用,但是它可以促进催化剂[PSO3HMIm][OTf]在反应体系中的溶解,因此适当增加[OMMIm][Tf2N]的含量反应速率会增大。当[OMMIm][Tf2N]和[PSO3HMIm][OTf]的摩尔比达到1∶1时,催化剂[PSO3HMIm][OTf]能完全溶解于反应物系,因此再增加离子液体[OMMIm][Tf2N]的量时,反应速率不再增大。因此,选用摩尔比为1∶1的[OMMIm][Tf2N]和[PSO3HMIm][OTf]混合离子液体作为后续乙酸甲酯和正己醇酯交换反应的催化剂。另外需要说明的是,质子酸离子液体催化剂黏度一般很高,使用不便,混合离子液体不仅能够提高催化活性,也起到降低催化剂体系黏度的作用。
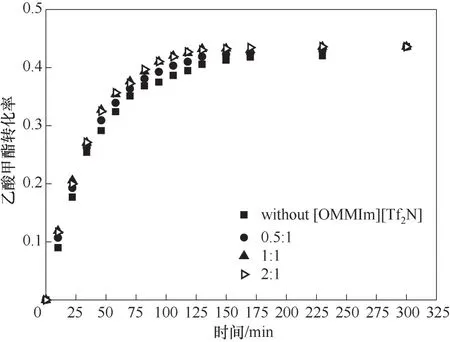
图2 不同[OMMIm][Tf2N]∶[PSO3HMIm][OTf]摩尔比对酯交换反应的影响Fig.2 Effect of different molar ratio of[OMMIm][Tf2N]∶[PSO3HMIm][OTf]on transesterification
2.3 混合离子液体催化合成乙酸正己酯反应动力学
为方便起见,本节中设定混合离子液体催化剂浓度为0.145 mol/L,维持[OMMIm][Tf2N]和[PSO3HMIm][OTf]的摩尔比为1∶1,反应温度为323.15 K,初始乙酸甲酯和正己醇摩尔比为1∶1作为参比反应条件。当研究其中一个参数的影响时,其他参数值的设定与参比反应条件保持一致。
2.3.1 催化剂浓度的影响 催化剂浓度是影响反应速率的一个重要因素,因此实验分别测定了催化剂浓度为0.06、0.10、0.145、0.20、0.25 mol/L条件下的反应转化率变化曲线。如图3所示,随着催化剂浓度的升高,该反应体系达到平衡的时间缩短,由于催化剂不影响反应平衡,因此,不同浓度下的乙酸甲酯平衡转化率维持不变。
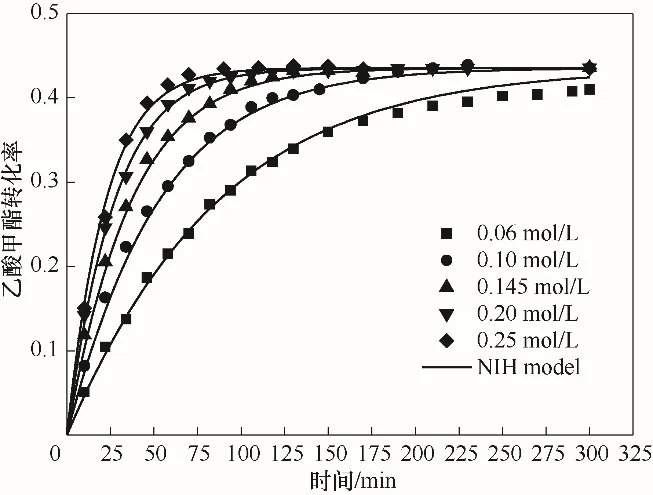
图3 催化剂浓度对酯交换反应的影响Fig.3 Effects of catalyst concentration on transesterification
本节研究了初始反应速率与催化剂浓度的关系,通过拟合初始反应速率和催化剂浓度关系方程,可以确定动力学方程中催化剂浓度的指数参数[36]。初始反应速率与催化剂浓度关系由式(2)表达,拟合得到该方程中的模型参数为E=0.3474 min-1,F=1。拟合结果如图4所示。
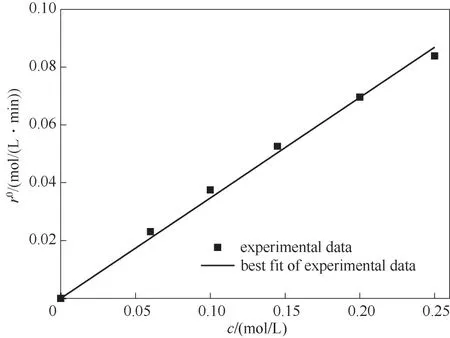
图4 初始反应速率与催化剂浓度关系Fig.4 Initial reaction rate versus IL catalyst concentration
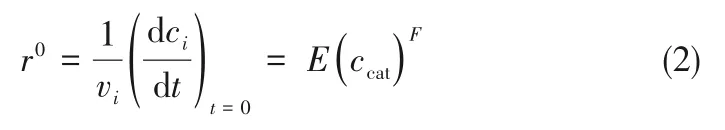
式中,r0为初始反应速率,mol/(L·min);ci为组分i浓度,mol/L;vi为组分i化学计量系数;ccat为催化剂[PSO3HMIm][OTf]的浓度,mol/L。
2.3.2 反应温度对酯交换的影响 选取313.15、318.15、323.15、327.65、333.15 K共5个温度来考察反应温度对乙酸甲酯反应速率和转化率的影响,结果如图5所示。
由图5可知,温度对该反应的影响明显,温度越高,反应达到平衡的时间越短,反应速率越大。温度对反应速率的影响可以由Arrhenius方程来解释:温度升高造成分子运动更加剧烈,因此发生了更多的有效碰撞使得反应速率加快。然而,由图5可以看出,温度对乙酸甲酯和正己醇酯交换反应的平衡转化率影响较小,这主要是因为该反应的反应焓较低,因此受温度影响较小。

图5 反应温度对酯交换反应的影响Fig.5 Effects of reaction temperature on transesterification
2.3.3 反应物摩尔比的影响 乙酸甲酯和正己醇酯交换是一个可逆反应,因此反应物初始摩尔比(正己醇∶乙酸甲酯)是影响反应的一个重要因素。本节考察了醇酯摩尔比0.25~4下的乙酸甲酯转化率随时间变化关系,结果如图6所示。
从图6中可以看出,反应物初始摩尔比对平衡转化率有着显著的影响,乙酸甲酯的平衡转化率随着初始醇酯摩尔比R0的增大而增大,此现象产生主要是由于正己醇的过量会造成化学平衡向右移动,因此乙酸甲酯的转化率会升高。
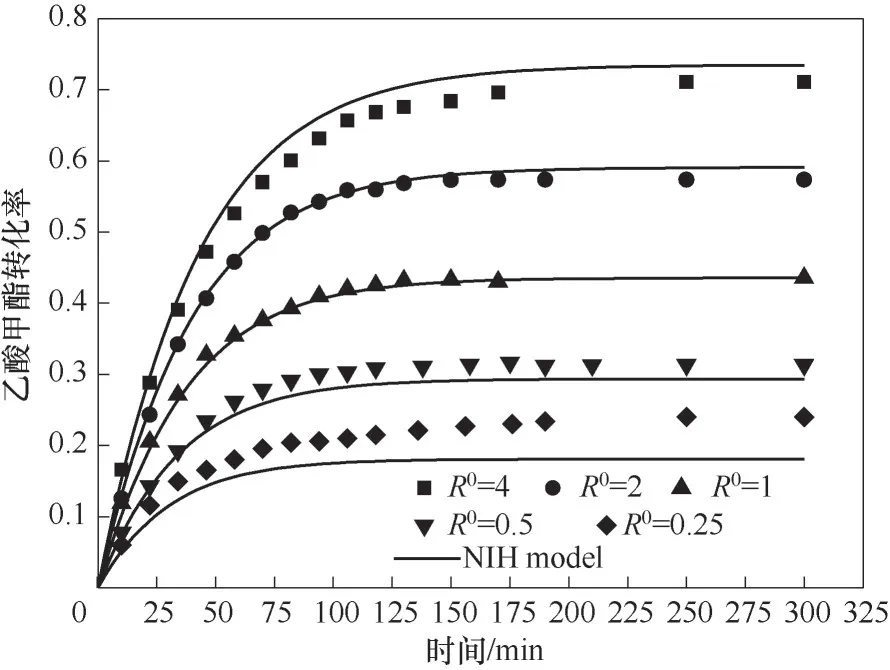
图6 正己醇和乙酸甲酯初始摩尔比对酯交换反应的影响Fig.6 Effect of initial molar ratio of n-hexanol to methyl acetate on the transesterification
2.4 离子液体催化剂的回收
对于离子液体催化酯交换反应来说,离子液体的可重复使用性能是至关重要的。因此,为了探究离子液体的复用性,设定反应条件为:反应温度323.15 K,混合离子液体催化剂浓度0.25 mol/L,醇酯比1∶1。混合离子液体催化剂回收采取真空简单蒸馏方法,由于离子液体的饱和蒸气压几乎可以忽略,[OMMIm][Tf2N][35]和[PSO3HMIm][OTf][37]热分解温度较高,可以通过简单蒸馏将反应体系的反应物和生成物去除以得到原来的催化剂。真空简单蒸馏回收条件为:压力500 Pa,温度180℃。将催化剂重复回收5次进行实验测定,结果如图7所示,实验证明催化剂在重复使用五次后活性无明显降低,证明了离子液体催化剂具有良好的复用性能。
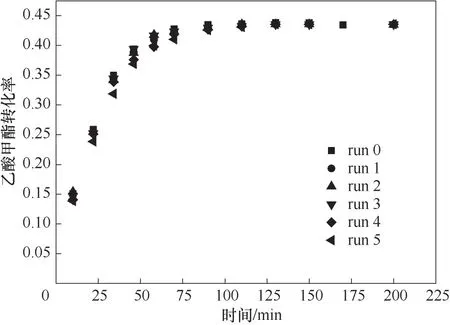
图7 混合离子液体催化剂的回收性能Fig.7 Performance of recovered mixed ionic liquid catalyst
2.5 化学平衡的研究
在动力学参比反应条件下分别测定了313.15、318.15、323.15、327.65、333.15 K 5个温度下的化学平衡常数(Ka),乙酸甲酯和正己醇进行酯交换反应的化学平衡常数计算公式为:

化学平衡常数由反应物和生成物的摩尔分数(x)和活度系数(γ)计算得到。其中,活度系数可由NRTL方程计算得到:
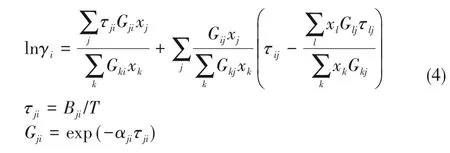
式中,Bij为二元交互作用参数;αij为非随机参数;T为温度。乙酸甲酯与甲醇、甲醇与正己醇的模型参数来源于Aspen数据库,[OMMIm][Tf2N]与乙酸甲酯和甲醇的模型参数来源于文献值[38],COSMOSAC模型能够较为准确地预测活度系数[39-40],并在离子液体精馏研究中被广泛应用[27,41],因此其余缺失的NRTL模型参数通过COSMO-SAC模型预测得到。所用到的NRTL方程参数见表2。
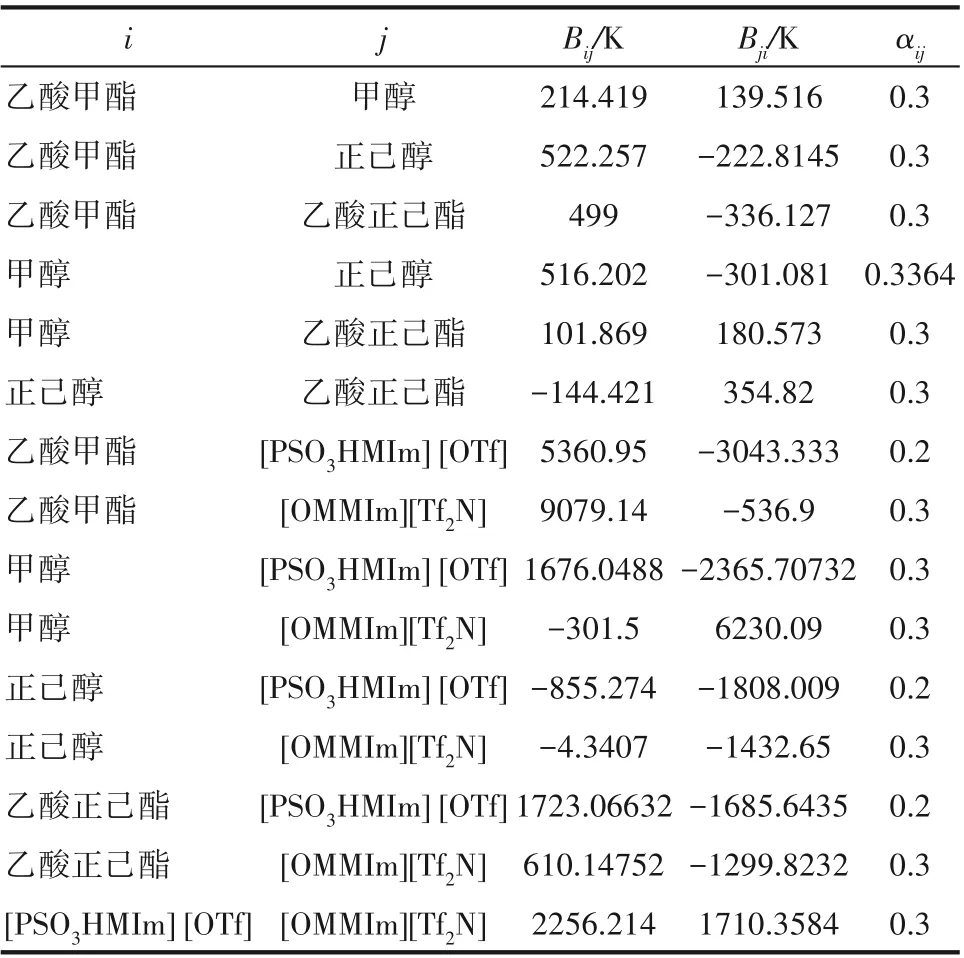
表2 NRTL模型参数Table 2 NRTL model parameters
根据van’t Hoff等压方程[式(5)],对Ka和温度T进行拟合便可以得到ΔrH0,拟合结果如式(6)和图8所示。

图8 反应温度对化学平衡常数的影响Fig.8 Effect of reaction temperature on chemical equilibrium constant
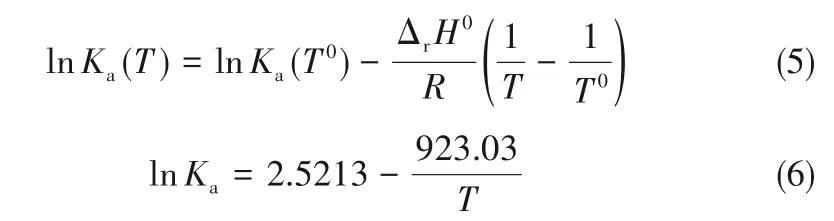
通过式(5)和式(6)的对比,可以得出ΔrH0的拟合值,标准反应焓ΔrH0也可以由反应体系四种物质的标准生成焓ΔfH0计算得到。四种物质的ΔfH0数值来源于NIST数据库,计算和实验两种方法得到的值列于表3中。由表3可知,乙酸甲酯和正己醇进行的酯交换反应为吸热反应,且反应焓的数值较小。

表3 标准反应焓计算结果Table 3 Calculation results of standard reaction enthalpy
2.6 反应动力学的拟合
本课题组已有多篇文献报道离子液体催化酯交换反应动力学[12,42-43],酯交换反应属于二级反应,乙酸甲酯和正己醇酯交换反应动力学采用非理想拟均相模型(NIH)描述为:

式中,ρ为反应体系的摩尔密度,ρ=n/V;α为对应物质的活度;k+、k-分别为正反应速率常数和逆反应速率常数,可以通过计算Arrhenius方程得到:
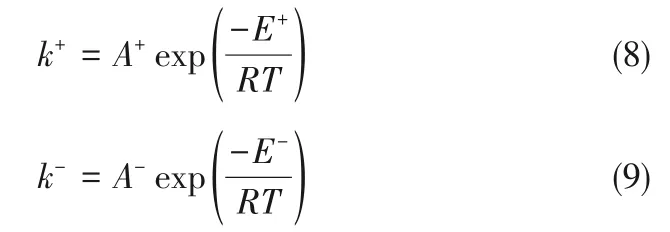
式中,A+、A-分别为正反应指前因子和逆反应指前因子;E+、E-分别为正反应活化能和逆反应活化能;R为气体常数,8.314 J/(mol·K);T为反应温度,K。
根据动力学NIH模型,将实验测得的转化率随时间变化的数据点采用非线性最小二乘法回归拟合得到反应动力学参数,拟合中的目标函数为乙酸甲酯转化率的平均相对偏差(MRD):

式中,XMeOAC,cal,i为计算出的转化率;XMeOAC,exp,i为实际转化率;N为数据点数。最终得到混合离子液体催化乙酸甲酯和正己醇酯交换反应的动力学方程(MRD为0.0312):
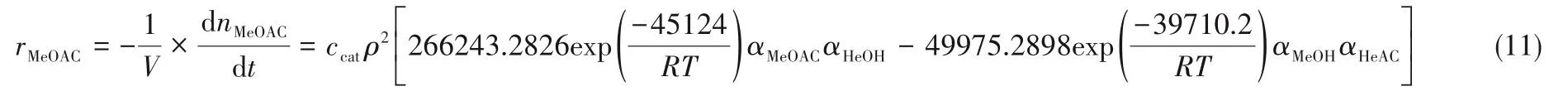
3 反应精馏过程模拟
3.1 工艺流程设计及参比条件的选择
本文采用Aspen Plus中的RadFrac模块和Flash模块对整个工艺流程进行计算,RadFrac模块采用平衡级模型,反应动力学方程见式(11)。由于Aspen Plus数据库中没有离子液体的物性参数,需要采用Aspen的物性估算系统(PCES)根据离子液体的分子结构进行估算,其中离子液体的理想气体热容参数由Aspen Plus软件采用Joback方法进行估算,气相焓采用理想气体热容模型进行计算,离子液体的饱和蒸气压采用Extended Antoine饱和蒸气压模型进行计算,离子液体的临界性质TC、PC、VC、ZC采用基团贡献法进行预测得到。物性方法选用NRTL,涉及的模型参数见表2。
由于反应物系中存在乙酸甲酯和甲醇的共沸物[44],因此采用双塔流程。整个反应精馏流程如图9所示(纯度为摩尔分数),包括一个反应精馏塔(T2)和一个普通精馏塔(T1)。反应精馏塔是乙酸甲酯和正己醇进行化学反应和分离反应物系的场所,普通精馏塔的主要作用是分离出纯度较高的产品甲醇,闪蒸罐主要是将催化剂和产品乙酸正己酯进行一次闪蒸分离,回收催化剂重复使用。
整个流程的进料流股和初步模拟结果如图9所示。接近共沸组成的乙酸甲酯和甲醇混合物从T1塔的第10块板进料,混合离子液体和正己醇分别从T2塔的第5和第10块板进料。T1塔分离得到的接近共沸组成的乙酸甲酯和甲醇混合物进入T2塔的第50块板,T2塔顶分离出的混合物返回T1塔的第20块板。各设备的操作条件分别是:T1常压操作,回流比2,总理论板数30;T2常压操作,总理论板数60,回流比3,持液量110 L;闪蒸罐温度设定为180℃,压力为500 Pa。通过模拟计算,分别在T1塔底和闪蒸罐得到纯度为98.7%的甲醇和98.1%的乙酸正己酯。
反应精馏塔T2是整个流程的核心,因此单独研究了反应精馏塔的操作和设备参数对产品乙酸正己酯纯度和塔底乙酸正己酯收率的影响。选取图9中T2塔和闪蒸罐标示出的进料条件和初步模拟结果作为参比条件,当改变其中一个参数作为变量时,保持其他参数值不变。
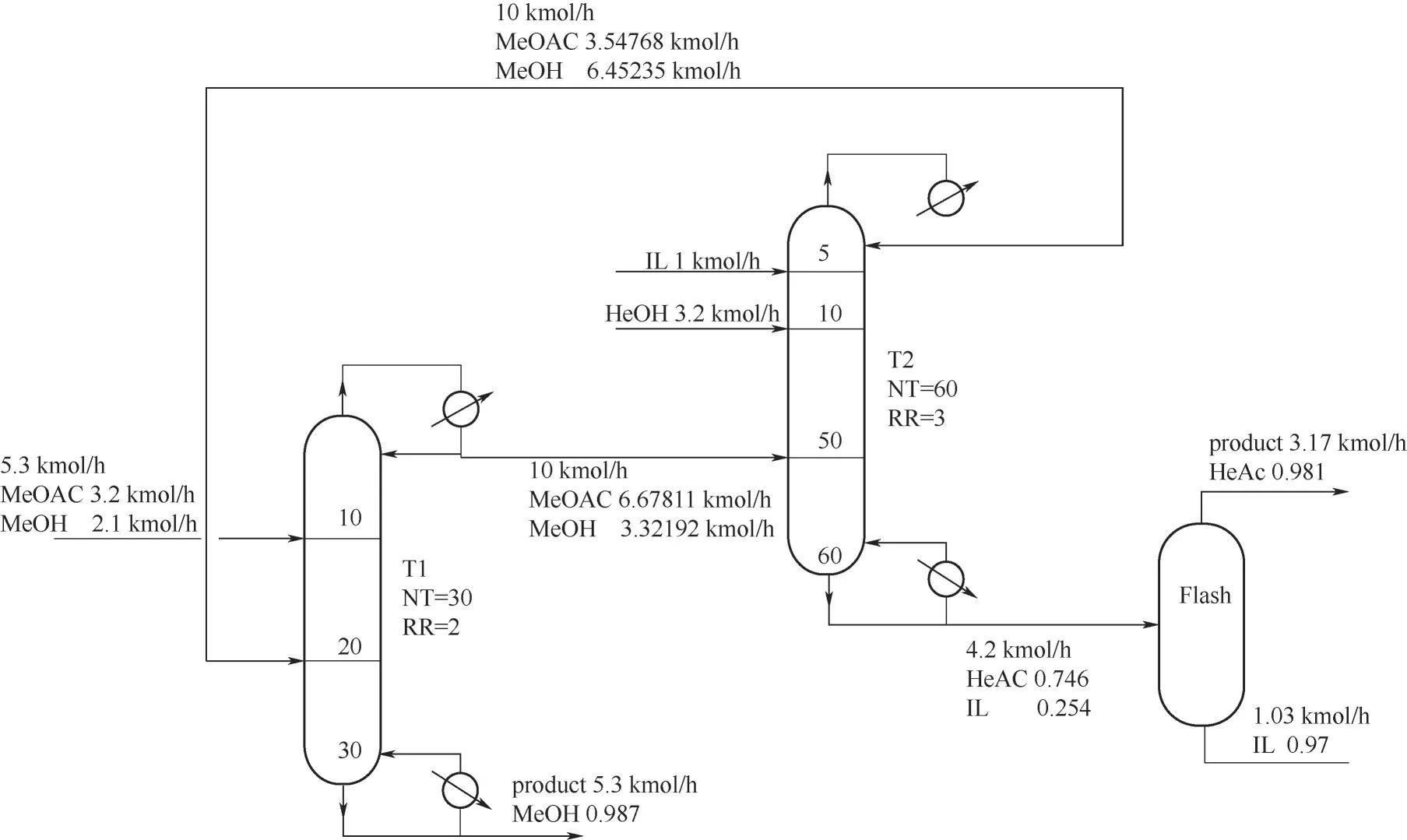
图9 催化反应精馏流程图Fig.9 Flow chart of catalytic reactive distillation
3.2 催化剂用量的影响
混合离子液体催化剂[OMMIm][Tf2N]和[PSO3HMIm][OTf](比例为1∶1)的用量对模拟结果的影响如图10所示。从图10中可以看出,乙酸正己酯的纯度随着催化剂用量的不断增加呈现先增大后减小的趋势。当催化剂用量小时,反应速率较低,反应物转化不完全,因此正己醇转化率较低,乙酸正己酯纯度较低。当催化剂用量过大时,反应速率高,但是混合离子液体催化剂能够增大乙酸甲酯相对于甲醇的相对挥发度(图11),造成反应精馏塔塔顶馏出物中乙酸甲酯含量增加、甲醇含量减少,不利于反应平衡向产物方向移动,从而也造成反应不完全。反应精馏是反应过程和精馏过程的耦合过程,当催化剂用量小时化学反应为控制步骤,产品纯度随着催化剂用量变大而增大。但随着催化剂用量变大,精馏分离成为控制步骤,因此该过程存在一个最佳的催化剂用量,其值为1 kmol/h。

图10 催化剂用量的影响Fig.10 The effect of catalyst flow rate
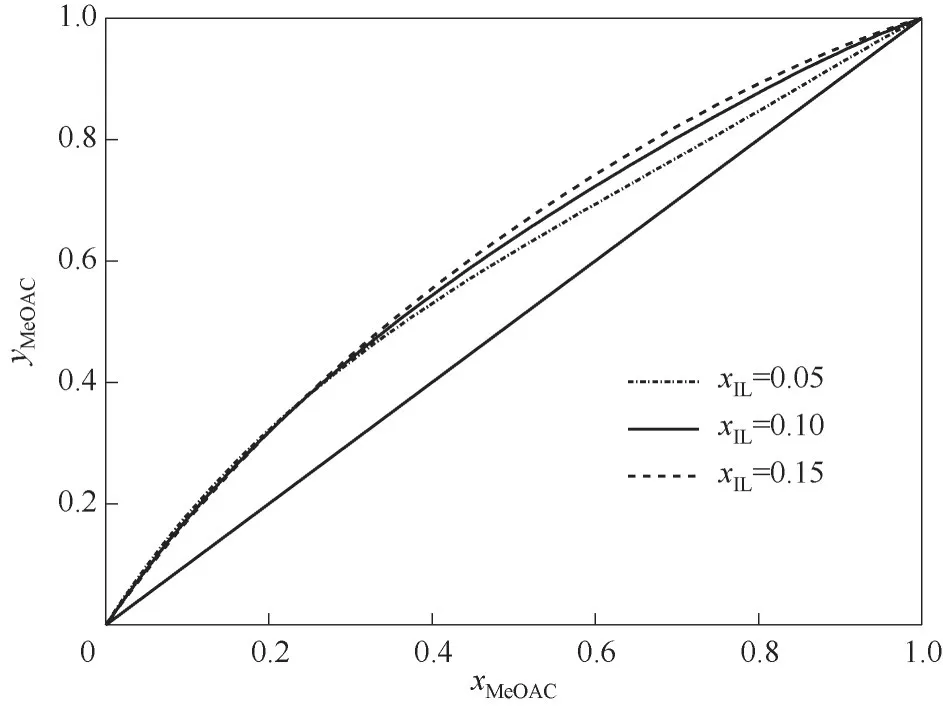
图11 混合离子液体催化剂不同浓度下乙酸甲酯-甲醇体系的y-x相图Fig.11 The y-x phase diagram of methyl acetate methanol system with different concentrations of mixed ionic liquid catalyst
3.3 理论板数的影响
理论板数是精馏中的重要参数,理论板数过小则达不到分离要求,过大会造成设备投资费用的增加,因此,选择合适的理论板数是精馏塔设计中重要的一环。理论板数对反应精馏塔T2的影响如图12所示。从图12中可以看出:乙酸正己酯收率和产品纯度随着理论板数的增加而增加,当理论板数达到66后基本维持不变。因此,合适的理论板数为66。

图12 理论板数的影响Fig.12 The effect of theoretical plates
3.4 反应段塔板数和进料位置的影响
反应精馏塔可以分成三段:正己醇进料位置以上为精馏段,主要作用是进行甲醇浓缩;正己醇和乙酸甲酯进料位置之间为反应段,主要作用是进行酯交换反应;乙酸甲酯混合物进料位置之下的部分为提馏段,主要作用是浓缩乙酸正己酯。本节探究了不同进料位置和反应段塔板数(乙酸甲酯混合物与正己醇进料之间的塔板数)对反应精馏的影响,分别考察了10种不同进料位置的情况,结果如表4所示。
从表4中可以看出,反应段塔板数的增加会使得乙酸正己酯收率增大和产品纯度增加,这主要是由于反应段塔板数增加,意味着反应体积增加,单位时间产物的生成量增加,反应更完全。因此选择适宜的反应段塔板数为40。混合离子液体和正己醇无论是从不同塔板进料还是混合后从一块板进料,对乙酸正己酯收率和纯度几乎没有影响。若维持反应段塔板数为40不变,从表4中可以看出,当正己醇进料位置从第6块理论板移动到第10块理论板时,精馏段理论板数增加,反应段下移,提馏段理论板数减小,而乙酸正己酯收率和纯度升高,但是当正己醇进料位置继续下移时,乙酸正己酯收率和纯度开始降低,因此反应物存在最佳进料位置。正己醇和乙酸甲酯混合物的最佳进料位置是第10和50块板。
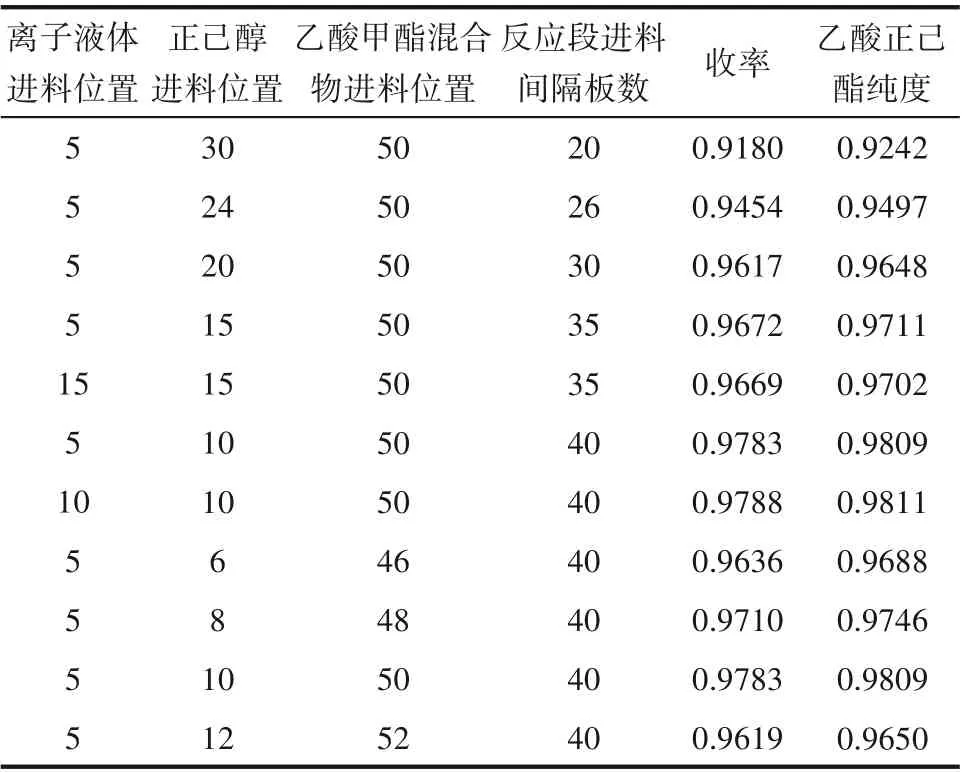
表4 混合离子液体和反应物的进料位置及间隔板数的影响Table 4 The effect of feeding position and number of spacer plates
3.5 回流比的影响
对于普通精馏塔,回流比的增加能够提高塔顶或塔底产品的纯度。但是对于反应精馏来说,由于化学反应和精馏分离是同时进行的,回流比的变化对结果产生较为复杂的影响。本节研究了回流比(0.8~5.5)对反应精馏塔的影响,结果如图13所示。从图13中可以看出,该反应精馏过程存在一个最佳的回流比,这主要是因为在回流比较小时,塔顶正己醇和乙酸正己酯得不到彻底的分离,而当回流比太大时,催化剂被稀释,反应速率减小,导致了产品收率降低。因此,最佳的回流比选3.75。

图13 回流比的影响Fig.13 The effect of reflux ratio
3.6 持液量的影响
塔板是化学反应的场所,因此塔板持液量的大小是影响反应精馏的一个重要因素。反应精馏塔持液量一般要求较大,为了保证反应精馏过程所需持液量,可以采用板式塔,例如筛板塔,塔板持液量可以在设计时调节溢流堰高度进行调整。持液量(60~126 L)对模拟结果的影响如图14所示,从图14中可以看出,乙酸正己酯收率和产品纯度随着持液量的增大而增大,并慢慢趋于平稳。这主要是因为随着持液量的不断增加,反应精馏的控制步骤由反应过程向精馏过程过渡,因此持液量的影响最终趋于稳定,该工艺条件下合适的持液量为120 L。
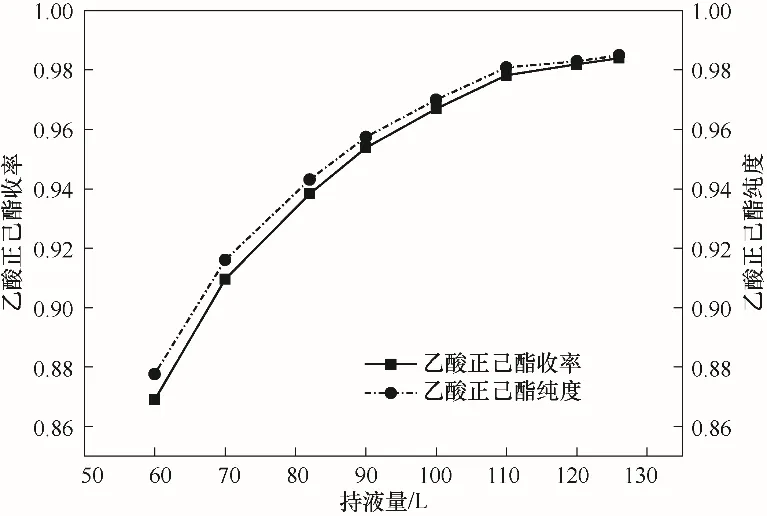
图14 塔板持液量的影响Fig.14 The effect of liquid holdup of tray
3.7 优化条件及模拟结果
根据上述对各个操作和结构参数分析和优化,得到了反应精馏塔的操作条件如下:混合离子液体[OMMIm][Tf2N]和[PSO3HMIm][OTf](比例为1∶1)用量为1 kmol/L,总理论塔板数为66,回流比为3.75,离子液体、正己醇和乙酸甲酯混合物分别从第5、10和50块板进料(进料流量如图9所示),塔板持液量为120 L。经过模拟得到乙酸正己酯收率为0.9991,乙酸正己酯的纯度为0.9993,塔内液相各个组分随塔板分布如图15所示。
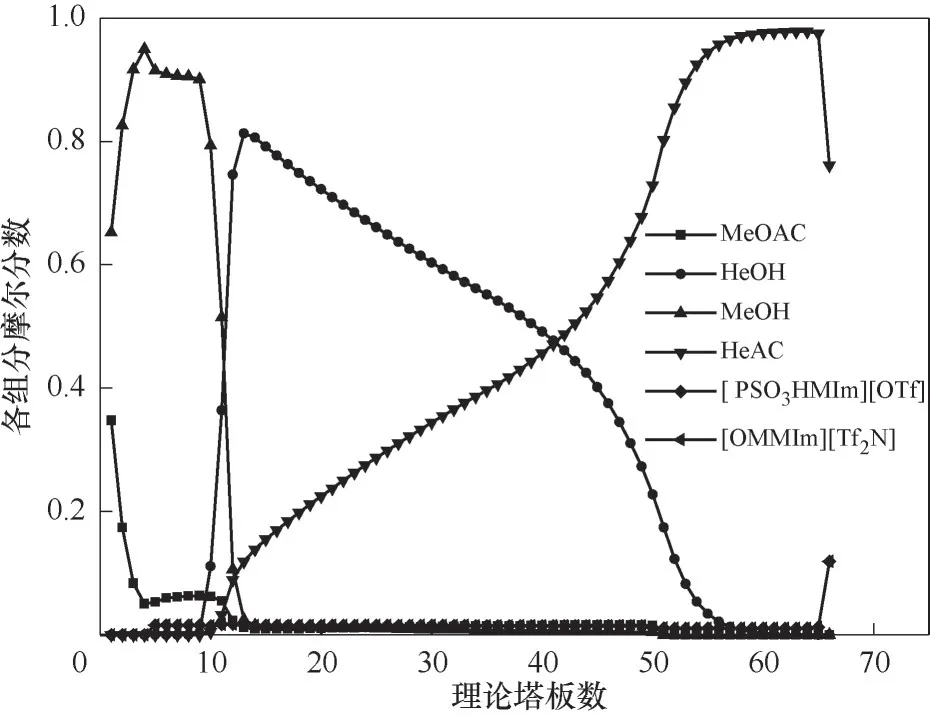
图15 反应精馏塔中各组分液相浓度分布Fig.15 Liquid concentration profiles in the reactive distillation column
4 结 论
通过乙酸甲酯和正己醇酯交换反应催化剂的筛选、反应动力学的研究以及反应精馏流程的设计和稳态模拟,得到如下结论。
(1)5种具有不同结构的离子液体[PSO3HMIm][OTf]、[BSO3HPy][OTf]、[BSO3HMIm][HSO4]、[BSO3HMIm][OTf]和[BSO3HMIm][Cl]均能催化乙酸甲酯与正己醇的酯交换反应,其中[PSO3HMIm][OTf]呈现最高的催化活性。[OMMIm][Tf2N]和[PSO3HMIm][OTf]形成的混合离子液体催化剂的催化活性比单一离子液体催化剂[PSO3HMIm][OTf]高。混合离子液体催化剂在循环使用五次后活性并无明显降低。
(2)测定了乙酸甲酯与正己醇酯交换反应的动力学数据,建立了乙酸甲酯与正己醇的酯交换反应动力学模型,拟合得到反应动力学模型参数。
(3)进行了反应精馏流程模拟计算并对反应精馏塔的影响因素进行了分析。乙酸正己酯收率和纯度随着理论板数、反应段板数、持液量的增大而增大,反应精馏过程存在最佳的回流比和催化剂用量。在优化操作条件下,乙酸正己酯的收率为0.9991,乙酸正己酯的纯度为0.9993。

