TAT-N24穿膜融合多肽的表达与鉴定*
王桂华 孙 黎 邓 豫 李小兰 曹小年来森艳 陶德定 胡俊波△
华中科技大学同济医学院附属同济医院 1分子医学中心 2肿瘤科,武汉 430030
磷脂酰肌醇3-激酶(phosphoinositide 3-kinase,PI3K)是生长因子调控信号转导通路中的重要分子,在细胞生长、增殖、分化、抑制凋亡、糖代谢等方面发挥着非常重要的作用[1]。它由催化亚基和调节亚基组成,不同的调节亚基和催化亚基结合介导着不同的PI3K通路[1-3]。p55PIK是PI3K的一个调节亚基,能够同PI3K的110 kD催化亚基形成稳定的复合物,有研究表明p55PIK同肿瘤的发生发展密切相关[4-5]。p55PIK区别于PI3K其他调节亚基最大的不同在于其末端存在独特的24个氨基酸残基(N24),在我们的前期研究中证实利用质粒或腺病毒载体在细胞内外源性表达N24能够有效地抑制多种人类肿瘤细胞增殖[6-11],但是利用外源性手段表达N24在肿瘤治疗中的应用受到了广泛的限制,寻找新的N24应用手段成为将N24开发成有效抗肿瘤药物亟待解决的问题。本研究通过体外表达并纯化具有跨膜功能的TAT-N24,并证实了TATN24的有效生物学活性。
1 材料和方法
1.1 试剂材料
DH5α和BL21大肠埃希菌为本研究室保存菌种,IPTG购自Sigma公司,K pnⅠ、XhoⅠ限制性内切酶和T4连接酶购自NEB公司,携带N24片段的N24-GFP质粒和pTAT-HA空质粒由美国夏献民教授惠赠,anti-HA鼠单克隆抗体购自Sigma公司,羊抗鼠FITC荧光抗体购自DAKO公司,结肠癌HT29细胞由本研究室传代培养,DMEM高糖培养液购自Gibco公司,质粒测序委托Invitrogen公司完成,流式细胞仪FACSort为美国Becton Dickson公司产品。
1.2 pTAT-HA-N24质粒的构建及测序鉴定
取N24-GFP质粒和pTAT-HA空质粒常规转化感受态DH5α大肠埃希菌,挑取单克隆摇菌,菌液送Invitrogen公司测序确定正确后碱裂解法大提质粒。将大提质粒分别取4 μ L以KpnⅠ和XhoⅠ限制性内切酶37℃双酶切1 h,酶切产物凝胶电泳后回收DNA片段,将回收的线性pTAT-HA质粒同N24片段以T4连接酶16℃连接过夜,连接产物常规转化感受态DH5α大肠埃希菌,挑取单克隆,摇菌送Invitrogen公司测序。
1.3 TAT-N24融合多肽的表达和纯化
将测序正确的pTAT-HA-N24质粒转化到感受态BL21大肠埃希菌中,挑取单克隆摇菌,获得表达菌株并测序鉴定菌株正确。取含有pTAT-HAN24质粒的BL21菌种100 μ L置10 mL含1∶500氨苄青霉素的LB培养液中37℃摇菌过夜,取1 mL菌液置1 L含1∶500氨苄青霉素的LB培养液中37℃摇菌,待细菌浓度吸光度(A)值达到0.5~0.7时加入IPTG诱导表达,终浓度为1 mmol/L,继续培养3 h后收集细菌。采用镍螯合柱(Qiagen)纯化TAT-N24蛋白,纯化方法依据镍柱使用说明。
1.4 TAT-N24穿膜能力和基本物理性质测定
将纯化后的 TAT-N24加入细胞爬片培养的HT29细胞中,置37℃含5%CO2温箱中培养12 h后,免疫细胞化学染色,荧光显微镜下观察TAT-N24是否入胞及入胞效率。SDS凝胶电泳确定TAT-N24的分子量,采用不同溶剂溶解TAT-N24,蛋白质浓度测定TAT-N24在不同溶剂中的溶解度。
1.5 TAT-N24生物学活性检测
将纯化后的 TAT-N24作用培养的结肠癌H T29细胞,以AD-N24-GFP为对照,比较 TATN24和 AD-N24-GFP对细胞产生的影响。以TAT-N24融合多肽处理结肠癌HT29细胞24 h后收取细胞,用PBS洗1遍,80%冷乙醇或100%甲醇固定后-20℃过夜。取部分固定后细胞用PBS洗1遍 ,室温 、避光下 PI染色(PI 50 μ g/mL,RNase 100 μ g/mL,0.1%triton)至少 30 min后上样,流式细胞仪检测,Modfit 3软件分析细胞周期结果。
1.6 统计学分析
2 结果
2.1 pTAT-HA-N24质粒的构建及测序鉴定
pTAT-HA-N24质粒构建后Invitrogen公司测序结果显示序列正确,已经成功将N24片段克隆进入pTAT-HA质粒。
2.2 TAT-N24结构模式图
TAT-N24融合多肽表达纯化后由4部分功能域组成,4部分分别实现了TAT-N24的生物活性、穿膜、纯化和标记等功能。如图1所示,其中N24部分为活性部位,抑制细胞异常增殖;穿膜肽(TAT)具有穿过细胞膜能力;6×寡聚组氨酸用于重组多肽的纯化;HA-tag用于多肽检测。

图1 TA T-N24多肽结构示意图Fig.1 T he schematic diagram of TAT-N24 polypeptide
2.3 TAT-N24融合多肽的表达和纯化
经过3次重复实验,TAT-N24经过Ni+螯合树脂纯化后可以获得纯度较高的 TAT-N24融合多肽,图2示纯化后的 TAT-N24分子量约 10 kD,SDS凝胶电泳未见明显杂蛋白。
2.4 TAT-N24穿膜能力和基本理化性质测定
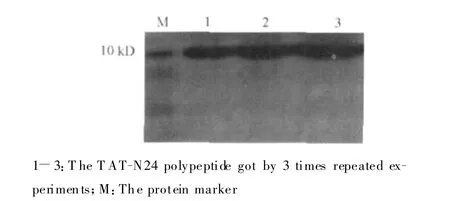
图2 SDS凝胶分析纯化后的T AT-N24融合多肽Fig.2 T he analy sis of TAT-N24 polypeptide by SDS-page af-
将纯化而得的TAT-N24分别溶解于6 mol/L尿素,DMSO,PBS中,测 TAT-N24在 3种不同类型溶剂中的溶解度分别为(25.00±1.05)、(20.00±0.56)、(1.00±0.04)mg/mL。将纯化后的TAT-N24短肽加入培养的HT29细胞,12 h后可见>90%细胞均有TAT-N24短肽的进入,TATN24穿膜能力较强(图3)。

图3 T AT-N24穿膜能力检测Fig.3 The detection of TAT-N24-penetrating ability
2.5 TAT-N24的生物学活性检测
TAT-N24融合多肽处理HT29细胞24 h后,流式细胞仪分析TAT-N24对H T29细胞周期的影响,以Ad-N24-GFP为阳性对照。结果提示相对空白对照组而言,Ad-N24-GFP和TAT-N24均能有效诱导结肠癌 HT29细胞细胞周期阻滞(P<0.05),TAT-N24诱导细胞周期阻滞能力较腺病毒表达N24显著增强(P<0.05)(图4)。
3 讨论
PI3K是生长因子调控的信号转导通路中连接细胞外信号的一个重要分子,PI3K的调节亚基没有酶活性,但它能促使催化亚基定位到细胞内特异位置并调控其催化活性,PI3K功能的特异性发挥是由其调节亚基决定的[1-4]。p55PIK是Pons等[4]发现的PI3K的一个调节亚基,p55PIK区别于PI3K其他调节亚基(p85PIK、p50PIK)的最大不同就是其氨基端存在的24个氨基酸,美国John Hopkins大学Xia等研究发现p55PIK可通过其氨基端这24个氨基酸(N24)同Rb蛋白特异性结合,参与Rb蛋白对细胞周期的调控。在我们的前期研究中利用腺病毒在结肠癌细胞中高表达N24能够有效地抑制结肠癌H T29细胞生长,诱导细胞周期阻滞,在体内有效地抑制结肠癌裸鼠移植瘤的生长,提示N24具备开发成为有效抗肿瘤药物的潜能[12]。但是利用腺病毒高表达N24治疗肿瘤存在生物安全性和腺病毒本身毒性的影响,使Ad-N24-GFP很难走向临床。
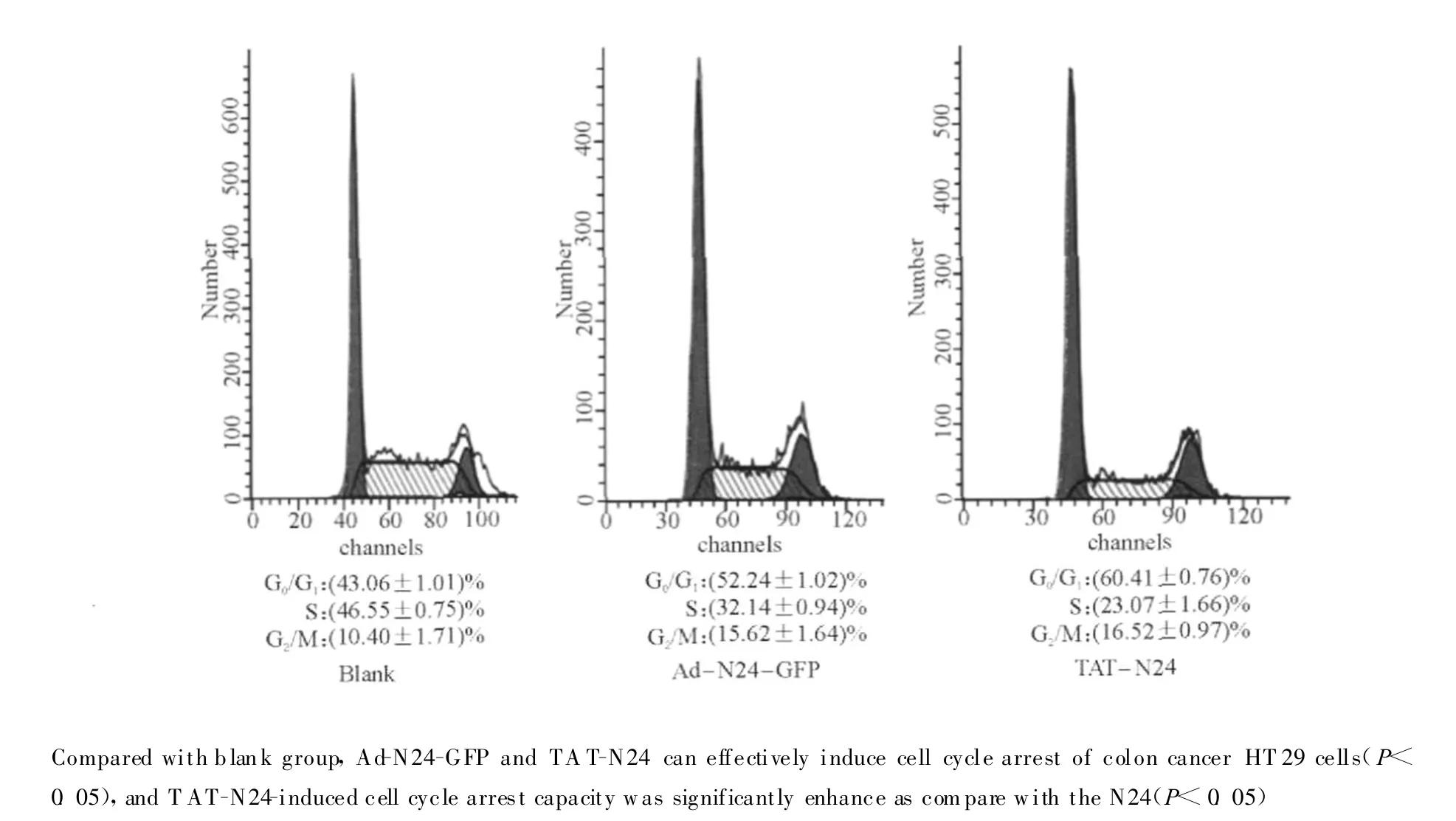
图4 流式细胞仪分析细胞周期Fig.4 Flow cytometry analysis of cell cycle
近年来,人们发现了一系列自然存在或人工合成的能帮助生物大分子穿透细胞膜的分子(protein/peptide transduction domain,PTD),PTD能将与其连接的多肽或其他生物大分子导入几乎所有的组织和细胞,转导效率较高而且对细胞没有损伤,可以解决多肽/蛋白质进行分子治疗的入胞难题[13]。其中,来自 HIV病毒的 Tat蛋白质中的 PTD(TAT)被广泛应用在帮助其他生物大分子穿透细胞膜的研究中,但是,很少有成功将该片段应用于体内投送具有治疗作用的生物大分子的报告。本研究利用分子生物学和蛋白质技术构建并表达了N24融合蛋白 TAT-N24,纯化后得到的融合蛋白具有较高的纯度和有效穿膜能力,同时纯化后的TATN24融合蛋白保留了N24的生物学活性,能够有效地诱导细胞周期阻滞。通过本研究有效地解决了将N24送入胞内的难题,为N24开发成为有效的肿瘤生物治疗药物奠定了基础,但本研究未在动物实验中进一步证实TAT-N24的抗肿瘤作用,这将是下一步研究的重点。
[1] Vivanco I,Sawyers C L.The phosphatidy linositol 3-kinase AK T pathway in human cancer[J].Nat Rev Cancer,2002,2(7):489-501.
[2] Vanhaesebroeck B,Waterfield M D.Signaling by distinct classes of phosphoinositide 3-kinases[J].Exp Cell Res,1999,253(1):239-254.
[3] Wymann M P,Marone R.Phosphoinositide 3-kinase in disease:timing,location,and scaffolding[J].Curr Opin Cell Biol,2005,17(2):141-149.
[4] Pons S,A sano T,G lasheen E,et al.The structure and function of p55PIK reveal a new regulatory subunit for phosphatidylinositol 3 kinase[J].M ol Cell Biol,1995,15(8):4453-4465.
[5] Zhang L,Huang J,Yang N,et al.Integrative genomic analysis of phosphatidylinositol 3'-kinase family identifies PIK3R3 as a potential therapeutic target in epithelial ovarian cancer[J].Clin Cancer Res,2007,13(18 pt 1):5314-5321.
[6] 刘双又,王晶,胡俊波,等.磷脂酰肌醇3-激酶上的一段多肽对Jurkat细胞的周期阻滞作用[J].中华血液学杂志,2005,26(12):758-759.
[7] 王晶,刘双又,胡俊波,等.N24p55γ PI3K靶向抑制胃癌细胞增殖的研究[J].中华实验外科杂志,2006,23(10):1221-1223.
[8] 高霞,龙浩成,刘双又,等.信号传导途径p55PI3K-Rb在胃肠道肿瘤中的表达及意义[J].华中科技大学学报:医学版,2006,35(6):761-763.
[9] 孙黎,袁响林,王桂华,等.磷脂酰肌醇-3-激酶调节亚基 N末端24个氨基酸对肝癌增殖的抑制[J].华中科技大学学报:医学版,2009,38(4):430-432,437.
[10] Hu J B,Liu S,Wang J,et al.Overexpression of the N-terminal end of the p55γregulatory subunit of phosphatidylinositol 3-kinase blocks cell cycle progression in gastric carcinoma cells[J].Int J Oncol,2005,26(5):1321-1327.
[11] Hu J B,Xia X,Cheng A,et al.A peptide inhibitor derived from p55PIK phosphatidylinositol 3-kinase regulatory subunit:a novel cancer therapy[J].Mol Cancer Ther,2008,7(12):3719-3728.
[12] 王桂华,胡俊波,龚建平,等.磷脂酰肌醇-3激酶N末端的24个氨基酸抑制结肠癌细胞增殖的作用[J].癌症,2007,27(10):1034-1038.
[13] 陶站华,王淑静,刘兴汉.蛋白质转导技术及其应用[J].医学分子生物学杂志,2005,2(2):199-122.

