子痫前期患者胎盘骨桥蛋白的表达及意义*
夏俊霞 乔福元 苏放明 龚 洵 李小恒
1华中科技大学同济医学院附属同济医院妇产科,武汉 430030
2暨南大学第二临床医学院深圳市人民医院产科,深圳 518020
3深圳市疾病预防控制中心分子生物学研究室,深圳 518020
子痫前期(preeclampsia,PE)是妊娠期特有的原因不明的多系统疾病,迄今仍然是导致孕产妇及围生儿死亡的重要原因,其发病的中心环节目前认为与滋养细胞侵袭力下降密切相关[1]。骨桥蛋白(osteopontin,OPN)是一种多功能的细胞因子和黏附蛋白,在介导细胞分化、黏附、增殖与迁移、免疫调节、信号转导、炎症及对感染性疾病的免疫能力等方面有着重要的作用[2]。研究发现[3-4]OPN是影响子宫-胚胎微环境的重要因素,其在滋养细胞、胎盘上都有表达,通过与整合素受体结合,调节绒毛侵入、介导细胞迁移和胎盘形成,参与母胎界面的免疫调节,与子痫前期的发病关系密切。本研究通过比较OPN蛋白及mRNA在子痫前期患者胎盘组织中的表达水平变化,探讨其在子痫前期发病机制中的作用。
1 资料与方法
1.1 临床资料
选取深圳市人民医院产科 2008年 11月至2009年10月住院分娩的PE患者25例,其中轻度PE患者10例(轻度PE组),重度PE患者15例(重度PE组)及正常孕妇20例(对照组),均为单胎妊娠。轻度PE组、重度PE组和对照组的年龄分别为22~ 34(29.8±4.1)岁、21~37(30.3±4.1)岁 、20~36(28.9±4.2)岁;孕周分别为 34+3~41+3(37.8±1.8)周、34+1~41+2(37.6±2.0)周、36~41+5(38.3±1.5)周,3组年龄、孕周差异均无统计学意义(均P>0.05)。PE的诊断标准参照全国高等医学院校教材《妇产科学》第6版[5],排除有高血压、糖尿病、心脏病、免疫系统疾病、肝肾疾病等慢性疾病史的孕妇。
1.2 标本处理
胎盘娩出后迅速取胎盘中央绒毛丰富部位母体面胎盘组织3~4块,避开出血、坏死、钙化的部位,每块大小约1.0 cm×1.0 cm×1.5 cm(深度达到1 cm以上),用生理盐水冲洗后,迅速置于液氮中,所有操作5 min内完成。过夜后转入-80℃冰箱保存备用。另取新鲜胎盘约1.0 cm×1.0 cm×1.5 cm小块置于4%多聚甲醛中固定,用于免疫组化测定。
1.3 方法
1.3.1 免疫组织化学方法(SP法)检测胎盘组织OPN蛋白的表达 将4%多聚甲醛固定的胎盘组织小块予以常规组织脱水、透明、石蜡包埋后切片,片厚5 μ m,每个组织块取3张,用于以下SP法免疫组织化学染色。主要步骤为:鼠抗OPN单克隆抗体(1∶400,Santa Cruz,美国)室温孵育切片过夜;生物素化兔抗鼠IgG(1∶200,北京中山)室温孵育1 h;以DAB/H2O2显色。苏木精轻度复染。用抗体稀释液替代一抗进行阴性对照,反应呈阴性。在光学显微镜下随机选取5个高倍视野(×400)观察照相,运用Image-Pro Plus Version 5.1彩色图像分析系统,对每张切片的OPN免疫反应产物进行吸光度值测定,并进行半定量统计分析。
1.3.2 Western blot方法检测胎盘组织OPN蛋白的表达水平 约100 mg胎盘组织加入1 mL细胞裂解液匀浆,离心15 min取上清,电泳分离蛋白样品,将蛋白质转膜到NC膜上,行免疫印迹反应。用鼠抗OPN单克隆抗体(1∶1 000,Santa Cruz,美国)4℃过夜,同时以鼠抗β-actin单克隆抗体(1∶2 000,Santa Cruz,美国)作为内参照;辣根过氧化物酶(HRP)标记的兔抗鼠IgG(1∶2 000,北京中山)室温孵育2 h;NC膜用DAB/H2O2显色,扫描仪上扫描结果。运用生物电泳图像分析系统(复日Smartview2001,S/N:SV-0002202,日本)对条带进行吸光度值分析。以目的条带与内参照β-actin的平均吸光度的比值表示目的蛋白水平。
1.3.3 胎盘组织RNA的提取与半定量逆转录聚合酶链反应(RT-PCR) 100 mg胎盘组织按Trizol法(试剂盒购自 Invitrogen,美国)提取总 RNA。OPN mRNA水平通过 RT-PCR方法检测。用βactin作为内参照同时扩增。引物均根据GenBank登录的人目的基因cDNA序列,由上海英骏公司设计并合成。OPN:上游引物 5′-CGA CGA TGA TGA CGA TGA TGA T-3′;下 游引 物 5′-CTG GCT T TG GAA CTT GCT TGA C-3′;β-actin:上游引物 5′-TCA CCA T TC GGA TGA GTC TG-3′;下游引物 5′-ACT TGT GGC TCT GAT GT T CC-3′。扩增产物大小分别为498 bp和 386 bp。PCR扩增产物用1%琼脂糖凝胶进行电泳,运用凝胶成像系统(复日 Smartview2001 S/N:SV-0002202,日本)对条带进行吸光度值分析。以目的基因与内参照β-actin的平均吸光度的比值表示OPN mRNA水平。
1.4 统计学处理
2 结果
2.1 胎盘组织中OPN免疫反应性的表达
OPN蛋白在对照组和PE各组胎盘组织中均有表达,可见到OPN免疫反应阳性产物为棕褐色颗粒状或点状,主要表达定位于胎盘绒毛滋养细胞的胞质和胞膜中,并且胎盘毛细血管内皮细胞中也有大量的表达。OPN免疫反应产物吸光度测定分析结果如下:对照组(0.99±0.08),轻度 PE组(0.63±0.06),重度PE组(0.34±0.06)。与对照组相比,PE各组胎盘组织中OPN的免疫阳性染色均明显变浅,平均吸光度值减小(均P<0.05),即PE各组胎盘组织中OPN蛋白表达降低,差异有统计学意义。而重度PE组与轻度PE组相比,OPN的免疫阳性染色更浅(P<0.05),即重度PE组胎盘组织OPN的蛋白表达低于轻度PE组,差异有统计学意义(图1)。
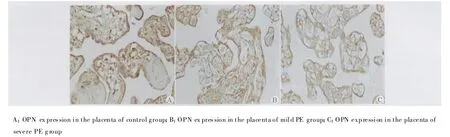
图1 OPN在各组胎盘组织中免疫反应性的表达分布(SP法,×400)Fig.1 Distribution of OPN immunoreactivity in placenta(SP method,×400)
2.2 对照组和PE各组胎盘组织OPN蛋白表达水平比较
OPN和β-actin的蛋白分子量分别为45 kD和42 kD,以β-actin为内参照,对各组条带的吸光度值进行校正后分析。Western blot检测各组胎盘组织OPN蛋白表达结果如下:对照组(1.65±0.11),轻度PE组(1.19±0.15),重度 PE组(0.61±0.10)。单因素方差分析结果表明,PE各组胎盘组织OPN的蛋白表达量均明显低于对照组,差异有统计学意义(均P<0.05),同时重度PE组的OPN的蛋白表达量较轻度PE组显著降低(P<0.05)。见图2。

图2 Western blot分析显示胎盘组织OPN蛋白表达水平Fig.2 Detection of the OPN protein expression in placenta by Western blot
2.3 对照组和PE各组胎盘组织OPN mRNA水平比较
OPN和β-actin的mRNA扩增片段长度分别为498 bp和386 bp,条带清晰。以β-actin作为内参照,对各组条带的吸光度值进行校正后分析。各组胎盘组织OPN mRNA水平RT-PCR分析结果如下:对照组(1.01±0.08),轻度 PE组(0.71±0.07),重度PE组(0.39±0.06)。与对照组相比,PE各组胎盘组织OPN mRNA表达明显降低,差异均有统计学意义(均P<0.05),其中重度PE组OPN mRNA表达显著低于轻度PE组(P<0.05)。见图3。

图3 RT-PCR分析显示胎盘组织OPN mRNA水平Fig.3 T he expression of OPN mRNA in placenta detected by RTPCR
3 讨论
3.1 子痫前期(PE)的相关病因及病理生理研究
PE是妊娠期特有的危害母婴健康的多系统疾病,发病率约为5%,是导致围生期死亡的主要并发症。临床上,PE表现为母体综合征(高血压、蛋白尿伴或不伴有多器官系统的损伤),可伴有胎儿综合征(胎儿生长受限、胎儿窘迫、围产儿患病率及死亡率增高等)[1,6]。近百年来国际医学界形成了PE病因的多种学说,如:滋养层浅表植入学说、胎盘血管损伤学说、免疫学说、凝血与纤溶系统失调学说、基因遗传学说、肾素-血管紧张素-醛固酮学说、前列腺素系统学说等等。近年来,越来越多的学者倾向于认同滋养层浅表植入学说,即滋养细胞功能障碍导致PE发生。病理生理学研究表明[1,6]:滋养细胞分化异常导致浸润表浅,螺旋动脉重铸失败和胎盘浅着床;血管内皮细胞损伤;过度的炎性反应是PE重要的特征性病理生理变化。虽然滋养细胞分化异常导致浸润表浅,螺旋动脉重铸失败被认为是PE起始性的病理生理变化,但引起滋养细胞分化异常原因和机制尚不清楚。这也是PE病因至今不能明确的主要原因。学者们推测母胎界面的免疫失衡或滋养细胞基因的异常表达是导致滋养细胞分化异常的根本原因[1,6]。新近的研究提示,滋养细胞与蜕膜免疫细胞信号传递异常与滋养细胞的浸润异常、胎盘浅着床有关[7]。
3.2 骨桥蛋白(OPN)的分子生物学特征及功能
OPN是一种重要的细胞外基质结构组分,是一种富含精氨酸-甘氨酸-天冬氨酸(Arg-Gly-Asp,RGD)三肽序列的分泌型钙结合磷酸化糖蛋白,广泛存在于各种组织和体液中,具有多种生物学活性[3-4]。
目前已知OPN分子中存在有凝血酶和部分基质金属蛋白酶(MMPs)的作用位点。OPN能够通过活化的κ B抑制蛋白酶/κ B抑制蛋白酶激酶(Iκ Ba/IKK)信号途径促进MMP-2前体的活化[8]。MMPs与其组织抑制物(TIMPs)系统的动态平衡在人体内许多涉及细胞外基质(ECM)降解和重建的生理、病理过程中,如炎症、胚胎发生和着床、胎盘血管床的重塑、血管形成、肿瘤侵袭转移、滋养细胞侵入等发挥重要作用[9]。OPN主要的生物学功能有:①介导细胞与细胞、细胞与细胞外基质的相互作用;②介导细胞的趋化、聚集、黏附、增殖和迁移;③参与细胞免疫调节。细胞免疫应答过程中,OPN是最重要的也是最早起作用的细胞因子,故OPN曾被称为早期T淋巴细胞活化因子1(Eta-1)[10];④刺激钙转运,参与钙质沉积;⑤激活磷脂酰肌醇激酶-3,并激活多种MMPs;⑥影响组织生物矿化与重建;⑦促进血管生成;⑧控制炎症的发生与发展;⑨参与神经发育;⑩参与癌细胞浸润和转移[11-12]等过程。
近年生殖医学领域的研究[3-4]表明,OPN是子宫和胎盘免疫细胞的产物并可调节它们的活动和细胞因子的生成,是子宫-胎盘微环境的重要组成部分;OPN不仅参与母胎界面黏附,调节信号转导过程,调节绒毛的侵袭,亦参与母胎界面免疫调节。故OPN几乎参与了生殖的全过程。
3.3 OPN在PE发病机制中的可能作用
近年研究发现[13-15]在PE患者胎盘组织中多种参与细胞内信号转导的胞质蛋白和细胞骨架蛋白如OPN 、Src、paxillin、Crb2、Cas、PI-3K 及 STAT 等表达异常,蛋白表达量或活性较正常胎盘组织显著下降。本研究结果显示,OPN蛋白在对照组和PE组胎盘组织中均有表达,OPN表达主要定位于胎盘绒毛滋养细胞的胞质和胞膜中,并且在胎盘毛细血管内皮细胞中亦有大量的表达。PE组胎盘组织中OPN的蛋白表达量和mRNA水平均明显低于对照组,且随PE病情加重,OPN的蛋白表达量和mRNA水平进一步显著降低,与我们前期的研究结果一致[13]。Batorfi等[16]研究指出在正常妊娠,OPN对滋养层生长和侵入的调节是一个复杂的过程,妊娠相关疾病(如子痫前期、胎儿生长受限、自然流产、葡萄胎等)中这种调节被改变,其发病机制可能与OPN的下调有一定关系。Raffetto等[17]研究表明PE的发生与MMPs/T IMPs系统失衡密切相关,而OPN可通过多种机制调节MMPs/T IMPs系统的动态平衡。由此我们推测胎盘组织中OPN的低表达在PE发病机制中发挥重要的作用,OPN的表达降低改变了子宫-胎盘微环境及信号转导途径,引发母胎界面免疫失衡,导致滋养细胞侵袭力不足及浅浸润,螺旋动脉重铸失败,胎盘浅着床,从而引发PE;OPN的低表达还可能通过打破MMPs/T IMPs间的平衡,参与过度的炎症反应,以及其它未知途径诱导PE的发生。但是OPN在PE发病机制中的具体作用,及其究竟是PE的原因还是疾病的结果,均有待深入研究。
[1] Redman C W,Sargent I L.Latest advances in understanding preeclampsia[J].Science,2005,308(5728):1592-1594.
[2] Blom T,Franzé n A,Heinegä rd D,et al.Comment on“T he influence of the proinflammatory cytokine,osteopontin,on autoimmune demyelinatingdisease”[J].Science,2003,299(5614):1845.
[3] Johnson G A,Burghardt R C,Bazer F W,et al.Osteopontin:roles in implantation and placentation[J].Biol Reprod,2003,69(5):1458-1471.
[4] Briese J,Oberndorfer M,Patschenik C,et al.Osteopontinis colocalized with the adhesion molecule CEACAM1 in the extravillous trophoblast of the human placenta and enhances invasion of CEACAM1-expressing placental cells[J].Clin Endocrinol Metab,2005,90(9):5407-5413.
[5] 乐杰.妇产科学[M].第6版.北京:人民卫生出版社,2004:97-106.
[6] Sibai B,Dekker G,Kupferminc M.Preeclampsia[J].Lancet,2005,365(9461):785-799.
[7] Hiby S E,Walker J J,O'Shaughnessy K M,et al.Combination of maternal KIR fetal HLA-C genes influence the risk of preeclampsia and reproductive success[J].Exp Med,2004,200(8):957-965.
[8] Philip S,Kundu G C.Osteopontin induces nuclear factor kappa B-mediated promatrix metalloproteinase-2 activation through I kappa B alpha/IKK signaling pathways,and curcumin(diferuloly lmethane)down-regulates these pathways[J].Biol Chem,2003,278(16):14487-14497.
[9] Ferretti C,Bruni L,Dangles-Marie V,et al.Molecular circuits shared by placental and cancer cells,and their implications in the proliferative,invasive and migratory capacities of tropho-blasts[J].Hum Reprod Update,2007,13(2):121-141.
[10] A shkar S,Weber G F,Panoutsakopoulou V,et al.Eta-1(osteopontin):an early component of type-1(cell-mediated)immunity[J].Science,2000,287(5454):860-864.
[11] Angelucci A,Festuccia C,D'Andrea G,et al.Osteopontin modulates prostate carcinoma invasive capacity through RGD-dependent upregulation of plasminogen activators[J].Biol Chem,2002,383(1):229-234.
[12] 宋前流,李学军.骨桥蛋白与肿瘤转移[J].医学分子生物学杂志,2005,2(1):57-60.
[13] Xia J,Qiao F,Su F,et al.Implication of expression of osteopontin and its receptor integ rin alphanubeta3 in the placenta in the development of preeclampsia[J].Huazhong Univ Sci Technol[M ed Sci],2009,29(6):755-760.
[14] Anteby E Y,Ayesh S,Shochina M,et al.Growth factor receptor-protein bound 2(GRB2)upregulation in the placenta in preeclampsia implies a possible role for ras signaling[J].Obstet Gynecol Reprod Biol,2005,118(2):174-181.
[15] Corvinus F M,Fitzgerald J S,Friedrich K,et al.Evidence for a correlation between trophoblast invasiveness and STAT 3 activity[J].Reprod Immunol,2003,50(4):316-321.
[16] Batorfi J,Fulop V,Kim J H,et al.Osteopontin is down-regulated in hydatidiform mole[J].Gynecol Oncol,2003,89(1):134-139.
[17] Raffetto J D,Khalil R A.Matrix metalloproteinases and their inhibitors in vascular remodeling and vascular disease[J].Biochem Pharmacol,2008,75(2):345-359.

