缺氧对细胞滋养细胞MMP9/TIMP1基因表达及细胞侵袭力的影响
罗健英 乔福元
华中科技大学同济医学院附属同济医院妇产科,武汉 430030
滋养细胞在母胎界面执行着复杂的生物学功能,其增殖、分化、侵袭是胎盘形成中的基本生物学行为。细胞滋养细胞(cytotrophoblast,CTB)的侵袭能力对于早期胚胎植入及胎盘形成至关重要。已有资料表明,在早孕阶段,宫腔及子宫内膜的氧分压较低,使得胚泡期的细胞滋养细胞处于相对缺氧的状态[1],而这种生理性缺氧可反馈性刺激滋养细胞分泌多种酶原并被激活,促进细胞滋养细胞进一步浸润,并重铸子宫螺旋动脉,使胎盘血管呈高容低阻,以满足胎儿生长发育的需要[2]。基质金属蛋白酶9(matrix metalloproteinases 9,MMP9)是参与细胞外基质降解的关键酶,基质金属蛋白酶9与其特异性抑制物1(tissue inhibitor of metalloproteinases,TIMP1)的协调平衡在滋养细胞对子宫的适度侵袭中起重要作用,其平衡失调可导致病理妊娠的发生。为了研究CTB的特性,国外多采用物理缺氧法模拟妊娠早期的缺氧环境,但该方法需要有特殊的设备,且价格较贵。本实验通过二氯化钴(CoCl2)建立滋养细胞缺氧模型,操作简便易行,以此模型探讨CTB的MMP9/TIMP1表达及MMP9/T IMP1对其侵袭能力的影响,为以后的实验研究打下基础。
1 材料和方法
1.1 主要试剂
DMEM/F12 1∶1培养液(Hyclone公司);胎牛血清(FBS,杭州四季青公司);胰蛋白酶(武汉凌飞科技);Matrigel(Sigma公司);Transwell(Corning Costar公司);SYBR Green PCR Master Mix(ABI公司);人细胞滋养细胞系TEV-1(human extravillous trophoblast cell line,香港中文大学惠赠);一抗:兔抗人MMP 9,兔抗人 TIMP 1,鼠抗人GAPDH(均由北京西美杰科技有限公司提供);二抗:辣根过氧化物酶标记的IgG;DAB显色剂(福州迈新生物有限公司);逆转录 cDNA合成试剂盒(Ferments公司);SDS-PAGE凝胶试剂(上海生工生物工程技术有限公司);RIPA细胞裂解液(ProMab公司);Brabford蛋白浓度测定试剂盒(上海碧云天生物技术有限公司)。MMP9引物序列:上游引物为 5′-GCAGAGGAATACCTGTACCGC-3′,下游引物为 5′-AGGTT TGGAATCTGCCCAGGT-3′,片段长度 196 bp;TIMP1引物序列:上游引物 为 5′-CACCT TATACCAGCGTTATGA-3′,下游引物为 5′-GAGAAACTCCTCGCTGCGGT T-3′,片段长度 157 bp;β-actin 引物序列:上游引物为 5′-CAT TAAGGAGAAGCTGTGCT-3′,下游引 物为5′-GT TGAAGGTAGTT TCGTGGA-3′,片段长度208 bp(Invitrogen公司合成)。
1.2 方法
1.2.1 TEV-1的体外培养 参照Feng等[3]的方法,采用含有10%胎牛血清的DMEM/F12 1∶1培养液进行体外培养。
1.2.2 细胞免疫化学检测 将制备好的细胞悬液以1×104/mL密度置于6孔板中,用盖玻片培养,待细胞爬片至 60%~70%,加入CoCl2(150 μ mol/L),48 h后取出盖玻片,用生理盐水洗去玻片上的培养液,用无水乙醇固定细胞15~20 min,分别加兔抗人MMP9和兔抗人TIMP1单克隆抗体,4℃过夜。次日加辣根过氧化物酶标记的二抗,DAB显色,再用苏木精复染,中性树胶封片观察。通过图像分析系统在每张切片上随机选取5个非重叠视野,测定阳性染色的平均吸光度与阳性细胞百分比,计算蛋白阳性表达指数(positive expression index,PEI):PEI=平均吸光度×阳性细胞百分比×100。实验重复3次。
1.2.3 细胞缺氧试验分组 用10%FBS-DMEM/F12培养液,37℃下置5%CO2培养箱中,待细胞融合至80%,用0.25%胰酶消化传代后接种(细胞密度5×104/mL)于6孔板,待细胞融合 70%时,改为无血清培养并根据是否加入CoCl2分为2组:一组继续培养为正常对照组,另一组加入CoCl2(150 μ mol/L)为低氧组;在培养 24、48、72 h时间点收集细胞,进行荧光定量PCR,Western blot检测。每个低氧组时间点以相同培养时间的正常对照组为对照。实验重复3次。
1.2.4 荧光定量PCR检测 将TEV-1传代后放在37℃、5%CO2培养箱中,孵育24 h后换液,分为2组:对照组及实验组;收集细胞,加入1 mL T rizol,用酚-氯仿法抽提总 RNA,去除基因组的DNA,按逆转录cDNA合成试剂盒说明合成 cDNA,进行荧光定量。扩增反应体系为25 μ L(模板1 μ L,上 、下游引物各 100 nmol/L,SYBR Green mix 12.5 μ L,ddH2O 9.5 μ L)。扩增条件为 95 ℃预变性5 min,94℃变性20 s,55℃退火20 s,72℃延伸20 s,循环45次。同时扩增β-actin为内参,获得目的基因与内参的比值(ΔCt),以含量最低的一个样本为标准,其余各样本的含量均为相对该样本的倍数(ΔΔCt),目的基因 mRNA 为相对定量值(2-ΔΔCt)。
1.2.5 Western blot检测 收集细胞,用RIPA裂解细胞提取总蛋白质,确定点样量,经SDS-PAGE凝胶电泳,转移至硝酸纤维素膜。分别与MMP9、TIMP1、GAPDH蛋白抗体及二抗反应后化学发光显色,阳性条带以Gel pro4.0版凝胶吸光度分析软件测定积分吸光度(A)值为其蛋白量。
1.2.6 T ranswell侵袭实验 在T ranswell板(孔径8 μ m,膜直径24 mm),滤膜表面包被按1∶8的比例稀释的50 mg/L magtrigel(100 μ L/孔)置37℃30 min成凝胶。上室加入2 mL细胞悬液(0.2%BSA的DMEM/F12培养液调整细胞密度为 5×104个/mL),下室加入1 mL 5%FBS-DMEM/F12培养液,培养24 h后,次日在上室加入CoCl2(150 μ mol/L),置 37℃、5%CO2培养箱孵育 24、48、72 h。棉签轻轻拭去上室内的细胞和基质胶,保留定向迁移至滤膜下表面的细胞,用95%乙醇固定15~20 min,苏木精染色10 min,高倍显微镜下每孔随机选择5个视野计数细胞,侵袭指数=实验组每高倍镜视野中迁移至下表面的细胞数/对照组每高倍镜视野中迁移至下表面的细胞数。实验重复2次。
2 结果
2.1 缺氧对TEV-1细胞MMP9和TIMP1蛋白表达的影响
免疫细胞化学染色显示,细胞生长好,无坏死,MMP9和TIMP1的阳性表达为淡黄色或棕黄色颗粒,主要定位于细胞质。缺氧组MMP9和TIMP1的蛋白阳性表达均较高,与对照组比较差异有统计学意义(P<0.05)。见表 1,图1、2。
表1 两组 TEV-1细胞的M MP9和TIMP1蛋白表达比较(PEI,±s,n=3)Table 1 The PEI of MMP9 and TIMP1 proteins in TEV-1 cells(±s,n=3)

表1 两组 TEV-1细胞的M MP9和TIMP1蛋白表达比较(PEI,±s,n=3)Table 1 The PEI of MMP9 and TIMP1 proteins in TEV-1 cells(±s,n=3)
*P<0.05 as compared with the control group
Groups MM P9 TIMP1 Hypoxia 1.15±0.15* 1.12±0.11*Control 0.54±0.09 0.51±0.04
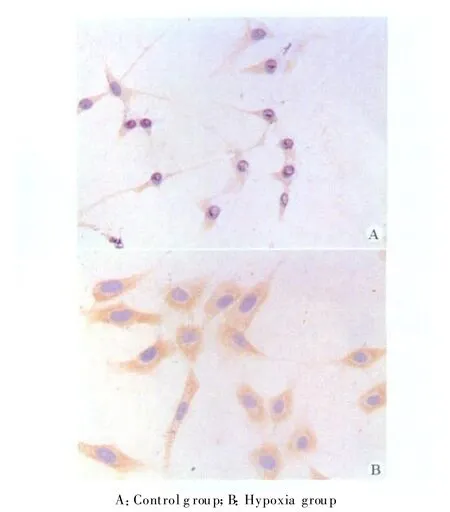
图1 两组MMP9的表达(SP,×400)Fig.1 T he MMP9 expression in two groups(SP,×400)
2.2 各组TEV-1细胞MMP9、TIMP1 mRNA相对表达量的比较
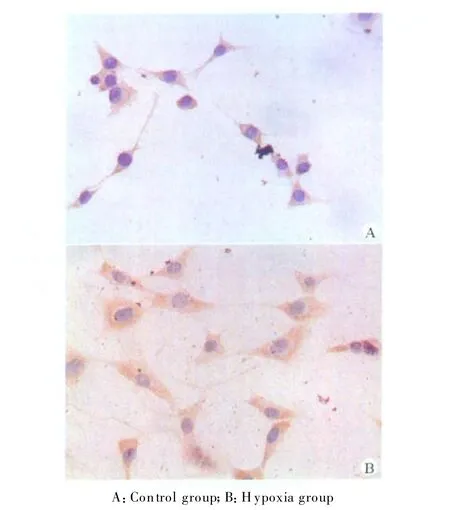
图2 两组TIMP1的表达(SP,×400)Fig.2 The TIMP1 expression in two g roups(SP,×400)
与各时点对照组比较,缺氧组MMP9、TIMP1 mRNA的表达量在24、48、72h均上升 ,两组比较差异均有统计学意义(均 P<0.05);缺氧组MMP9/TIMP1的比值亦均上升(均P<0.05),且与时间呈正相关(r=0.878,P<0.01)。见表2。
2.3 各组TEV-1细胞 MMP9、TIMP1蛋白表达的比较
缺氧组MMP9蛋白的表达量与各时点对照组比较,在24、48、72 h均上调,两组比较差异均有统计学意义(均P<0.05);缺氧组TIMP1蛋白的表达量与各时点对照组比较,在24、48、72 h均上调,两组比较差异均有统计学意义(均P<0.05);缺氧组MMP9/TIMP1的比值亦均上升(均P<0.05),且与时间呈正相关(r=0.613,P<0.05)。见图3。
2.4 缺氧对TEV-1细胞侵袭能力的影响
缺氧处理24、48、72 h后细胞浸润指数分别为(1.60 ±0.62)、(1.53 ±0.49)、(2.21 ±0.83),TEV-1细胞浸润指数升高与时间呈依赖关系。72 h时与对照组比较差异有显著性意义(F=12.57,P<0.01)。缺氧不同时间 TEV-1细胞穿透 Transwell底膜情况见图4~6。
3 讨论
3.1 TEV-1
Feng等[3]用表达人HPV16E6/E7基因的逆转录病毒载体(pLXSN-E6/E7),转染正常早孕的人胎盘绒毛中分离的原代滋养细胞,构建永生化的人细胞滋养细胞系,即为TEV-1,显示有绒毛外滋养细胞标记的所有生物学特征并可表达侵袭性的蛋白,同时虽然有侵袭的潜能但并无恶性转化能力。因此,TEV-1可以作为研究早孕人绒毛外滋养细胞的生理和功能特性的良好细胞模型。
表2 两组 TEV-1细胞MMP9、TIMP1 mRNA相对表达量的比较(±s,n=3)Table 2 The relative expression of MM P9 mRNA and TIMP1 mRNA in T EV-1 cells(±s,n=3)
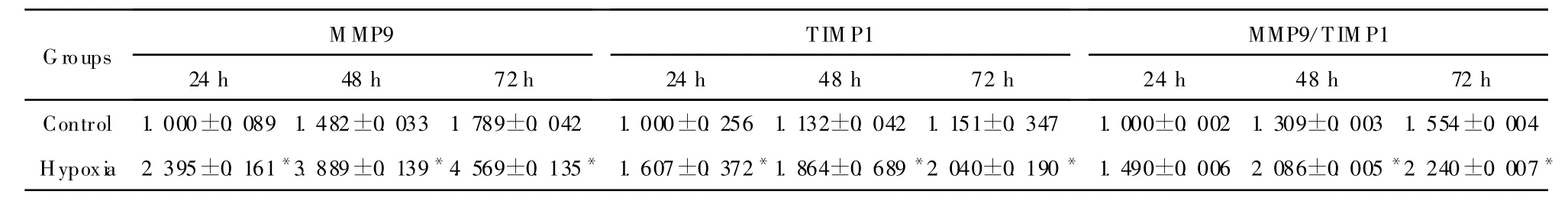
表2 两组 TEV-1细胞MMP9、TIMP1 mRNA相对表达量的比较(±s,n=3)Table 2 The relative expression of MM P9 mRNA and TIMP1 mRNA in T EV-1 cells(±s,n=3)
*P<0.05 as compared with the control group
Groups M MP9TIM P1MMP9/TIM P1 24 h 48 h 72 h 24 h 48 h 72 h 24 h 48 h 72 h Control 1.000±0.089 1.482±0.0331.789±0.042 1.000±0.2561.132±0.0421.151±0.347 1.000±0.0021.309±0.0031.554±0.004 Hypoxia2.395±0.161*3.889±0.139*4.569±0.135*1.607±0.372*1.864±0.689*2.040±0.190*1.490±0.0062.086±0.005*2.240±0.007*
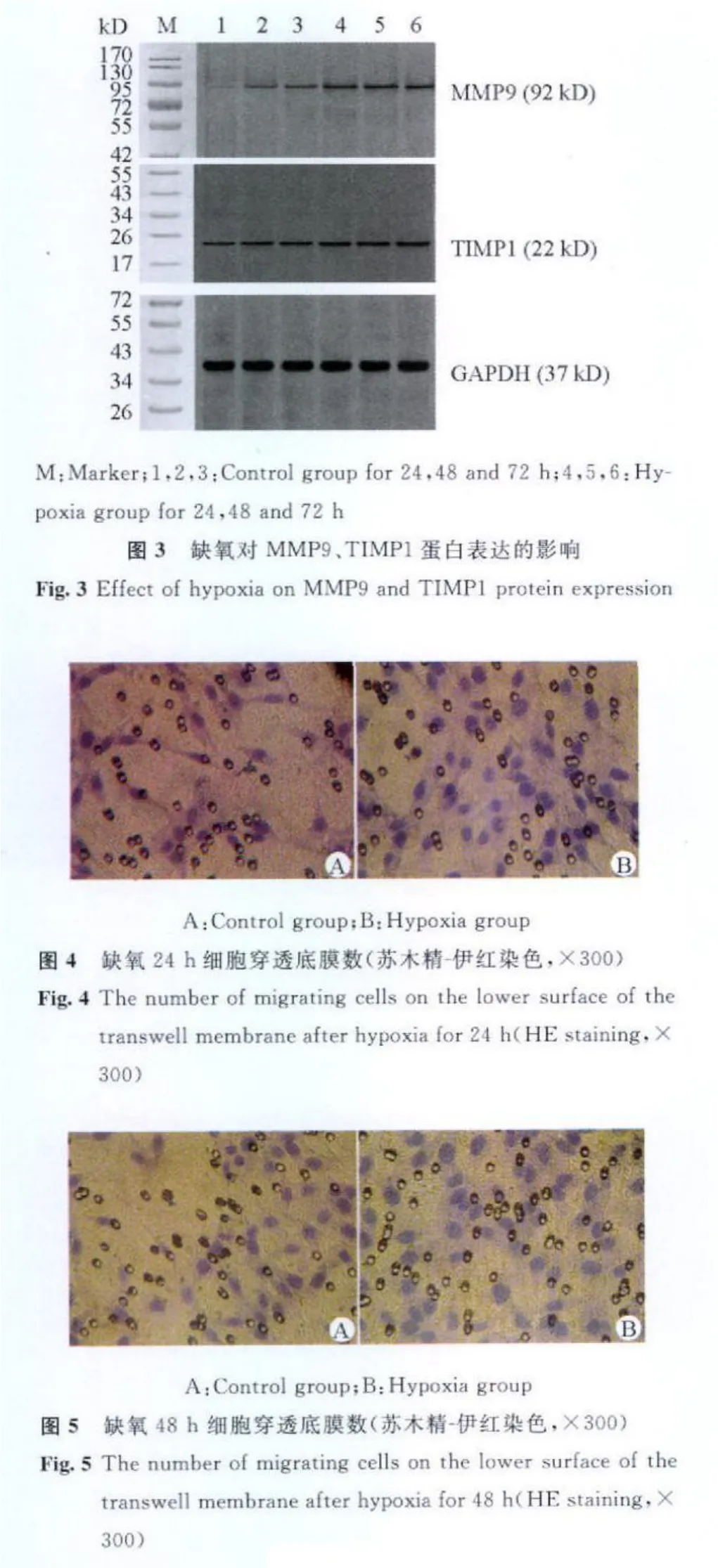

图6 缺氧72 h细胞穿透底膜数(苏木精-伊红染色,×300)Fig.6 The number of migrating cells on the lower surface of the transwell membrane after hypoxia for 72 h(HE staining,×300)
3.2 缺氧对细胞滋养细胞的影响
从受精到分娩,人的胚泡种植部位和胎盘的氧含量一直是变化的。资料显示,在子宫内膜分泌期,宫腔的氧分压为10~15 mmHg[4](约2.5%O2);在早孕10周内,与周围子宫内膜基质的氧分压(约40 mmHg)相比,胎盘组织的氧分压明显较低;中孕后,胎盘的氧分压逐渐从近18 mmHg上升到60 mm-Hg(约8.6%O2)[1]。导致这种孕期氧分压的不同是由于子宫胎盘血流量和局部组织摄取氧能力的变化。在早孕10周内,由滋养细胞组成的迂回网以及子宫螺旋动脉出现滋养细胞栓使绒毛间隙血流受限而使胚胎处于相对缺氧的环境[5]。到早孕末,随着子宫螺旋动脉内滋养细胞栓的消失和胎盘子宫血流量的增加,胎盘的氧含量也相应上升。由此推断,早孕期间,胎盘的生理性缺氧很可能有利滋养细胞的浸润,从而促进胚泡的植入和胎盘的形成。
3.3 缺氧对细胞滋养细胞分泌MMP9、TIMP1的影响
早孕滋养细胞的浸润是着床成功的关键,而MMP9通过降解基质成份促进滋养细胞浸润起主要作用。MMP9的功能活性除受相应的酶原激活外,主要受内源性 TIMP1的调节[6],二者为同一细胞分泌。本实验利用体外培养的TEV-1,对人类早期妊娠细胞滋养细胞MMP9、TIMP1的mRNA表达以及蛋白合成进行研究,结果显示:MMP9、TIMP1主要在滋养细胞的胞质中表达,缺氧使二者表达的mRNA以及蛋白水平均上调(P<0.05),但MMP9/TIMP1的比值升高,并呈时间依赖性。MMP9在缺氧条件下表达升高,与许多研究表明MMP9从第7周开始分泌,第11周达到高峰的趋势是一致的;虽然 TIMP1表达亦升高似乎与之相矛盾,但这种上调可能是为了确保胎盘的正常发育防止滋养细胞的过度浸润所必需的。现已证明,TIMP1除了调节MMP9外,还有其它的细胞作用,包括控制细胞的生长、分化和抗凋亡等[6]。随着妊娠的进展,胎盘氧含量的增加,细胞滋养细胞表型的整合素α1增强,而整合素α1是一种层黏连蛋白的受体,从而说明细胞滋养细胞是向子宫氧浓度高的动脉侵袭,而不侵袭氧浓度低的静脉[7]。因此,缺氧诱导细胞滋养细胞增殖、分化[7]很可能TIMP1起了促进作用,虽然具体机制还有待研究,但说明早孕细胞滋养细胞在生理性缺氧条件下TIMP1上调是有其生理意义的。
目前缺氧促进MMP9、TIMP1上调的分子机制还不十分清楚,但很可能与MMP9和TIMP1基因的启动因子均包含有转录因子AP-1和Ets结合点有关[8]。因为AP-1、Ets均能被缺氧所激活[9-10],同时与缺氧诱导因子1(HIF-1)亦有很大关系。因为缺氧诱导 HIF-1增加,HIF-1诱导 iNOS基因表达[11],NO在各种细胞和组织中对于激活MMPs起关键的作用[12];另缺氧通过激活HIF-1可诱导转录因子Ets-1[13],而Ets-1能诱导MMPS的基因表达和其酶的活性增加[14]。
3.4 缺氧对细胞滋养细胞侵袭能力的影响
通过细胞外基质(ECM)浸润是细胞侵袭、迁移的关键步骤,matrigel为小鼠EHS肿瘤基质提取物,含有Ⅳ型胶原、LN、巢蛋白(entacin)、硫酸乙酰肝素蛋白多糖和生长因子(TGFβ、bFGF)等,为体外侵袭试验提供了较好的ECM模型。本研究采用T ranswell侵袭实验发现:缺氧组的细胞滋养细胞侵袭能力明显较对照组增强(P<0.05),且与时间呈依赖关系。说明在生理性缺氧条件下,早孕细胞滋养细胞的侵袭力是增加的,与MMP9/T IMP1比值的升高有关。
人类的胚泡植入是在相对缺氧的环境下产生的。Hayashi等[15]已证实用滋养细胞来源的人Bewo细胞作实验模型在5%O2和250 μ mol/L CoCl2条件下缺氧能产生同样效应的HIF-1,而动物实验也证明在胎盘发育早期时给予轻度缺氧(约11%O2)可激活滋养细胞侵入血管并促进子宫血管的重建[16]。因此,本实验用 150 μ mol/L CoCl2建立体外缺氧模型,模拟早孕滋养细胞生理性缺氧是可行的,同时也证明了缺氧促进细胞滋养细胞的浸润,并且上调的TIMP1可防止滋养细胞的过度浸润,还可能参与细胞滋养细胞的分化、增殖和抗凋亡。
[1] Rodesch F,Simon P,Donner C,et al.Oxygen measurements in endometrial and trophoblastic tissues during early pregnancy[J].Obstet Gynecol,1992,80(1):283-285.
[2] Campbell S,Rowe J,Jackson C J,et al.In v itro mig ration of cytotrophoblasts through a decidual endothelial monolayer:the role of matrix metalloproteinases[J].Placenta,2003,24(4):306-315.
[3] Feng H C,Choy M Y,Deng W,et al.Establishment and characterization of a human first-trimester extravillous trophoblast cell line(TEV-1)[J].J Soc Gynecol Investig,2005,12(4):e21-32.
[4] Yedwab G A,Paz G,Homonnai T Z,et al.T he temperature,pH,and partial pressure of oxygen in the cervix and uterus of women and uterus of rats during the cycle[J].Fertil Steril,1976,27(1):304-309.
[5] T akeda K,T akeda H,Duan L J,et al.Placental but not heart defects are associated with elevated hypoxiainducible factor alpha levels in mice lacking prolyl hydroxylase domain protein[J].Mol Cell Biol,2006,26(22):8336-8346.
[6] Itoh Y,Nagase H.Preferential inactivation of tissue inhibitor of metalloproteinases-1 that is bound to the precursor of matrix metalloproteinase 9(progelatinase B)by human neutrophil elastase[J].J Biol Chem,1995,270(28):16518-16521.
[7] Genbacev O,Zhou Y,Ludlow J W,et al.Regulation of human placental development by oxygen tension[J].Science,1997,277(5332):1669-1672.
[8] Clark I M,Swingler T E,Sampieri C L,et al.The regulation of matrix metalloproteinases and their inhibitors[J].Int Biochem Cell Biol,2008,40(6/7):1362-1378.
[9] Martin G,Andriamanalijaona R,Grä ssel S,et al.Effect of hypoxia and reoxygenation on gene expression and response to interleukin-1 in cultured articular chondrocy tes[J].Arthritis Rheum,2004,50(11):3549-3560.
[10] Miyoshi A,Kitajima Y,Ide T,et al.Hypoxia accelerates cancer invasion of hepatoma cells by upregulating M MP ex pression in an HIF-1alpha-independent manner[J].Int J Oncol,2006,29(6):1533-1539.
[11] Palmer L A,Semenza G L,Stoler M H.Hypoxia induces typeⅡNOS gene expression in pulmonary artery endothelial cells via HIF-1[J].Am J Physiol,1998,274(2pt1):L212-L219.
[12] Murrell G A,Jang D,Williams R J.Nitric oxide activates metalloprotease enzymes in articular cartilage[J].Biochem Biophys Res Commun,1995,206(1):15-21.
[13] Oikawa M,Abe M,Kurosawa H,et al.Hypoxia induces transcription factor ETS-1 via the activity of hypoxia-inducible factor-1[J].Biochem Biophy s Res Commun,2001,289(1):39-43.
[14] Oda N,Abe M,Sato Y.ET S-1 converts endothelial cells to the angiogenic phenotype by inducing the ex pression of matrix metalloproteinases and integ rin b3[J].J Cell Phy siol,1999,178(2):121-132.
[15] Hayashi M,Sakata M,Takeda T,et al.Induction of glucose transporter 1 expression through hypoxia-inducible factor 1α under hypoxic conditions in trophoblast-derived cells[J].J Endocrinol,2004,183(1):145-154.
[16] Gracy X,Konno T,Michael J.M aternal hypoxia activates endovascular trophoblast cell invasion[J].Dev Biol,2008,314(2):362-375.

