SALL4 RNA干扰对THP-1白血病细胞生物学行为的影响
吴江
华中科技大学同济医学院附属同济医院血液内科,武汉 430030
人类婆罗双树样基因(SALL)与果蝇婆罗双树基因Sal为同源基因,Sal是参与果蝇多种器官发育的重要基因。人类 SALL家族共 4个成员,即SALL1~4,SALL4位于20号染色体q13[1],人们最初对SALL4产生兴趣是因为发现SALL4突变导致了Okihiro综合征/Duane综合征(前臂畸形和耳聋,或者桡侧手畸形、眼肌运动受限)[2-3],进一步研究表明,SALL4对维持胚胎干细胞的发育潜能有一定作用[4]。SALL4还选择性表达于某些类型的白血病:SALL4在急性髓性白血病(AML)和急性B细胞性白血病/淋巴瘤(B-ALL)中高表达,在健康志愿者造血细胞、霍奇金淋巴瘤及非霍奇金淋巴瘤、浆细胞瘤和急性T细胞性白血病/淋巴瘤中低表达或不表达[5]。
为深入研究SALL4在白血病发病机制中的作用,本实验设计合成了SALL4短发夹RNA(shRNA)干扰载体并转染人急性单核细胞白血病THP-1细胞,检测SALL4 RNA干扰(RNAi)对 THP-1细胞生物学行为的影响,以了解SALL4与急性单核细胞白血病的关系。
1 材料与方法
1.1 材料
pGPU6/GFP/Neo siRNA表达载体试剂盒和T4DNA连接酶购于上海吉玛公司;THP-1细胞购于湖南远泰公司;Lipofectamine 2000,Opti-MEMⅠ低血清培养液,RNA抽提 Trizol(Invitrogen公司);RT-PCR试剂盒,质粒提取试剂盒,凝胶DNA回收试剂盒(Promega公司);Minus First Strand cDNA合成试剂盒,DNA酶 Ⅰ,核糖核酸酶抑制剂(Fermentas公司);SYBR GreenPCR Master Mix(ABI公司);余试剂为实验室常备。
PCR仪器:PCR仪(ABI7500);JY-SPC水平电泳槽(北京君意东方公司);DG-Ⅲ双稳数显电泳仪(北京鼎国公司);高速离心机(Sigma公司)。
1.2 方法
1.2.1 设计目的基因RNAi靶点并合成shRNA在GenBank中查找人SALL4 mRNA序列(NM_020436,3 487 bp,GeneID:57167),使用 RNAi设计软件设计一条SALL4特异性shRNA序列和一条阴性对照 shRNA序列(shRNA-NC)。SALL4 shRNA:靶位点 SALL4 mRNA 1122,靶序列 5′-GCACAAGTGTAAGTACTGT-3′,模板序列 S 5′-CACCGCACAAGTGTAAGTACTGTT TCAAGAGAACAGTACTTACACTTGTGCTT TT TTG-3′,A 5′-GATCCAAAAAAGCACAAGTGTAAGTACTGT TCTCT TGAAACAGTACT TACACT TGTGC-3′,转录产物 5′-GCACAAGTGTAAGTACTGTT TCAAGAGAACAGTACTTACACTTGTGCT T-3′;shRNA-NC靶序列5′-GT TCTCCGAACGTGTCACGT-3′,模板序 列 S 5′-CACCGT TCTCCGAACGTGTCACGTCAAGAGATTACGTGACACGTTCGGAGAATT TT T TG-3′,A5′-GATCCAAAAAAT TCTCCGAACGTGTCACGTAATCTCTTGACGTGACACGTTCGGAGAAC-3′,转录产物5′-GT TCTCCGAACGTGTCACGTCAAGAGATTACGTGACACGTTCGGAGAAT T-3′。
1.2.2 pGPU6/GFP/Neo/SALL4-shRNA载体质粒构建及鉴定 用 100 μ L去核酸酶的水溶解shRNA模板链,每种模板链各 1 μ L用 TE(10 mmol/L Tris+1 mmol/L EDTA)稀释至1∶100到1∶1 000,260 nm处测定吸光度值,计算shRNA 模板链的浓度,终浓度大约 100 μ mol/L;分别加入 5 μ L 10 ×shDNA 退火溶 液 、5 μ L 正义shRNA 模板链(100 μ mol/L)、5 μ L 反义 shRNA模板链(100 μ mol/L)和 35 μ L ddH2O 形成 50 μ L反应体系,95℃3 min,再缓慢冷却至室温;用去核酸酶的水稀释已退火的shRNA模板插入片段,终浓度20 nmol/L,建立2个 10 μ L连接反应体系,分别加入1 μ L稀释的已退火shRNA模板插入片段(正义或反义,反义可作为阴性对照)、1 μ L 1×shDNA退火溶液、6.5 μ L去核酸酶的水、1 μ L 10 ×T4DNA 连 接酶缓冲液 、1 μ L pGPU6/GFP/Neo 载 体 、0.5 μ LT4DNA 连 接 酶(5 U/μ L),16℃孵育过夜。
1.2.3 重组质粒的转化、筛选和鉴定 分别取上述连接反应体系5 μ L转化化学制备的E.coli感受态细胞,分别接种于含卡那霉素的LB平板上,37℃培养过夜;再分别挑取单克隆菌落接种于LB培养液中(含卡那霉素50 mg/L),37℃摇菌过夜;用质粒小提试剂盒提取质粒,分别用BamHⅠ、EcoRⅠ酶切,重组成功的载体可以被BamHⅠ酶切而不能被EcoRⅠ酶切;收集成功重组的质粒送上海吉玛公司测序。
1.2.4 细胞培养与转染 THP-1细胞培养于RPIM 1640培养液(含FBS),5%CO2、37℃培养箱,常规传代;取对数生长期细胞(4~5)×104接种在6孔板上,含FBS的基础培养液2 mL。准备siRNALipofectamine 2000 复合物 :以 250 μ L Opti-MEM I稀释5 μ L Lipofectamine 2000,混匀后室温孵育 5 min;以 250 μ L Opti-MEM I稀释 7.5 μ L shRNA,混匀后室温孵育5 min;再混合稀释的shRNA和稀释的 Lipofectamine 2000,室温孵育20 min,形成复合物。将 shRNA-Lipofectamine 2000复合物加入到每个包含细胞和培养液的孔中。混合后37℃、CO2培养箱孵育72 h直至适合分析。荧光显微镜观察GFP表达情况后,流式细胞仪检测转染效率。换用含G418的选择性培养液,挑选G418抗性的单克隆扩增培养,可建立稳定转染SALL4 shRNA的THP-1细胞。
1.2.5 real time PCR检测SALL4表达水平评价shRNA效果 按空白对照细胞,SALL shRNA转染细胞及shRNA NC转染细胞进行分组。每组设置3个平行孔,内参设置为GAPDH。SALL4引物 :上游 5′-GGAGT TCT TCAGCATCTCTG-3′,下游 5′-CTTCTCCTTCATGTCCTCTG-3′;GAPDH引 物:上 游 5′-CCATGTTCGTCATGGGTGTGAACCA-3′, 下 游 5′-GCCAGTAGAGGCAGGGATGATGTTC-3′。常规方法提取总 RNA,加入Dnase去除DNA,参照试剂盒说明书方法进行RT-PCR得到 cDNA;依次加入反转录产物1 μ L、Primer A 100 nmol/L 、Primer B 100 nmol/L 、2 ×SYBR Green PCR Master mix 12.5 μ L 、ddH2O 加至25 μ L;上PCR仪执行如下程序:95℃5 min,94℃20 s;55℃20 s,72℃20 s,72℃5 min,共 40个循环。
1.2.6 M TT检测SALL4 RNAi后THP-1细胞增殖 在96孔板加入各组受试细胞100 μ L/孔(约 1×104个细胞/孔),每组3个重复孔,将96孔板在37℃,含5%CO2空气及100%湿度的细胞培养箱中孵育适当时间(取4个时间点);每孔加50 μ L 1×MTT,37℃孵育4 h,使MT T还原为甲臜;吸出上清液,每孔加150 μ L DMSO使甲臜溶解,用平板摇床摇匀;酶标仪在570 nm波长处检测每孔的吸光度(A)值:将各测试孔的A值减去本底A值(完全培养液加MT T,无细胞),各重复孔的 A值取均值,以每组每个时间点的 A值均值为基础作细胞生长曲线。
1.2.7 流式细胞仪检测各组细胞凋亡与细胞周期各组待测细胞转染72 h后,1 000 g离心5 min,PBS洗涤细胞3次。用4℃预冷的70%乙醇固定,固定不少于12 h。1 000 g离心去除乙醇,调整细胞密度为1×106/mL,取1 mL细胞悬液,用 PBS洗3次,细胞重悬于 1 mL PI染液中(PI染液浓度 50 μ g/mL,含 20 μ g/mL RNase A),4℃染色 30 min,上机检测,Cell Modifit软件分析细胞周期以及细胞凋亡率,每组检测3个平行样本。
1.3 统计学分析
2 结果
2.1 pGPU6/GFP/Neo/SALL4-shRNA的鉴定
测序结果显示,pGPU6/GFP/Neo/SALL4-shRNA和shRNA-NC与模板序列一致。
2.2 转染效率
转染72 h后荧光显微镜观察荧光细胞。流式细胞仪检测SALL4 shRNA转染THP-1细胞的效率为(51.76±1.46)%。
2.3 SALL4 shRNA的干扰效果
real time PCR样本扩增效率一致,故采用mRNA相对定量法[6],以含量最低的1个样本为标准(此处为SALL4 shRNA组第1孔,mRNA含量设为1),其余各样本的含量均表示为相对该样本的倍数 。Δ CT=CTSALL4-CT同孔GAPDH,ΔΔ CT=Δ CT各孔-ΔCTSALL4含量最低孔
转染SALL4 shRNA后的THP-1细胞SALL4表达水平明显下降,与空白对照组和阴性干扰组比较差异具有显著性意义,干扰载体效果显著,见图1。

图1 各组细胞RNAi后SALL4 mRNA表达Fig.1 Expression of SALL4 mRNA in T HP-1 cells transfected with SA LL4 shRNA
2.4 SALL4 RNAi后细胞增殖
SALL4 shRNA、shRNA NC和空白对照3组细胞均呈现随培养时间的延长而不断增长的趋势,SALL4 shRNA组THP-1细胞转染72 h后,A值明显低于其他两组细胞,见表1。说明SALL4 shRNA组细胞的增殖能力明显低于空白对照组及阴性对照组,干扰SALL mRNA对T HP-1细胞的增殖具有明显抑制作用。
表1 SA LL4 RNAi在不同时间点对 THP-1细胞增殖的影响(±s,A值)Table 1 Proliferation of THP-1 cells transfected with SA LL4 shRNA(±s,A value)

表1 SA LL4 RNAi在不同时间点对 THP-1细胞增殖的影响(±s,A值)Table 1 Proliferation of THP-1 cells transfected with SA LL4 shRNA(±s,A value)
*P<0.05 vs SALL4 shRNA group
G roups 12 h 24 h 48 h 72 h Blank control 0.197 0±0.011 8 0.416 7±0.007 8 0.745 7±0.018 6 0.950 3±0.008 0*SALL4 shRNA 0.174 7±0.009 5 0.382 0±0.007 5 0.661 3±0.009 5 0.828 7±0.011 4 shRNA NC 0.185 0±0.009 0 0.401 7±0.001 5 0.700 0±0.018 0 0.874 0±0.008 5*
2.5 SALL4 RNAi 72 h后细胞凋亡与细胞周期变化
SALL4 shRNA组的细胞凋亡率和M期细胞比例与空白对照组和阴性干扰组比较,存在统计学差异:SALL4 shRNA组细胞凋亡率明显高于其他两组,M期细胞比例则明显低于其他两组。空白对照组与 阴性干扰组间未见统计学差异。见表2、图2。
表2 不同组别T HP-1细胞流式分析结果(±s,%)Table 2 Flow cytometry results of THP-1 cells(±s,%)

表2 不同组别T HP-1细胞流式分析结果(±s,%)Table 2 Flow cytometry results of THP-1 cells(±s,%)
*P<0.05 vs SALL4 shRNA group
G roups Cell apoptosis G0/G1phase S phase M phase Blank control 3.563 3±0.291 4* 42.820 0±0.855 0 14.270 0±1.722 6 39.346 7±1.003 0*SALL4 shRNA 10.586 7±0.776 9 44.813 3±0.305 7 12.553 3±0.976 0 32.046 7±1.655 4 shRNA NC 4.040 0±0.331 8* 41.586 7±1.117 2 14.660 0±0.540 8 39.713 3±1.646 4*
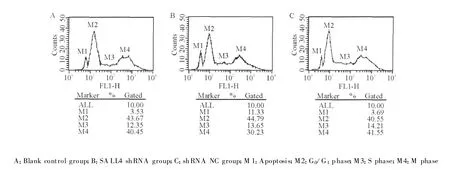
图2 3组THP-1细胞流式检测图Fig.2 Flow cytometry results of THP-1 cells
3 讨论
急性髓细胞白血病(AML)是获得性造血祖细胞突变引起的恶性克隆性疾病,骨髓髓系原始细胞明显增生而分化受阻,同时抑制正常造血。AML发病率占各型白血病的一半以上,是最常见的白血病类型。急性髓性白血病FAB诊断分型M1~M7共7种。THP-1细胞来源于人急性单核细胞白血病(M5)。
癌基因和抑癌基因是肿瘤发生机制研究中的重大发现。近年来,随着研究的深入,不断有新的癌基因和抑癌基因被发现。癌基因通过突变、转位等机制激活后的表达产物促进细胞发生癌变,抑癌基因则因为突变后停止表达而丧失对细胞恶性转变的抑制。SALL4在血液细胞中的表达变化与差异使人很容易将SALL4与癌基因联系起来。
本实验发现:转染SALL4 shRNA干扰THP-1细胞SALL4表达后,THP-1细胞增殖能力明显降低,表明SALL4对维持T HP-1细胞的生长具有一定作用;干扰SALL4的表达导致THP-1细胞凋亡比例上升,说明SALL4在T HP-1细胞可以发挥一定的抗凋亡作用;SALL4 shRNA组有丝分裂期细胞比例明显少于空白对照组和阴性干扰组,显示SALL4能促进T HP-1细胞更快地分裂增生,维持肿瘤细胞的增殖活性。SALL4对THP-1细胞维持其肿瘤细胞恶性生物学特征有较明显的作用。
本研究实验结果提示,SALL4在急性单核细胞白血病(AM L-M5)发生过程中的作用类似于癌基因。有报道[7]认为SALL4通过激活Bmi-1产生作用,而Bmi-1是公认的癌基因,这也许是SALL4在白血病中发挥癌基因作用的机制所在。也有研究[8]发现SALL4能被WNT信号通路中的 TCF/LEF所激活 ,与 β-catenin 结合 ,通过 WNT/β-catenin 信号途径影响靶基因c-myc、Cyclin D1的表达,这也可能是SALL4参与白血病发生发展的一种机制。SALL4的启动子存在 STAT3的结合域,下调STAT3活性能明显抑制 SALL4的表达,说明SALL4可受STAT3调节[9],而STAT3信号转导通路与肿瘤关系十分密切[10]。此外,SALL4还与多种调控细胞增殖、凋亡的基因发生联系[11],可能是白血病肿瘤分子生物学网络中一个比较重要的调控节点。
综上所述,本实验通过干扰急性单核细胞白血病THP-1细胞的SALL4基因表达,发现SALL4对于THP-1细胞的增殖、凋亡及细胞周期均具有比较重要的作用。随着研究的进一步深入,SALL4在白血病发生发展过程中的具体作用机制(如信号传递的方式、下游靶基因的定位等)将会逐渐明晰,同时也为设计并开展以SALL4为作用靶位的基因治疗,或者研发SALL4特异性的靶向药物夯实理论基础。相信特异性针对SALL4的白血病治疗方法将会有一定的应用前景。
[1] Kohlhase J,Schubert L,Liebers M,et al.Mutations at the SA LL4 locus on chromosome 20 result in a range of clinically overlapping phenotypes,including Okihiro syndrome,Holt-Oram syndrome,acro-renal-ocular syndrome,and patients previously reported to represent thalidomide embry opathy[J].J Med Genet,2003,40(7):473-478.
[2] Kohlhase J,Heinrich M,Schubert L,et al.Okihiro syndrome is caused by SA LL4 mutations[J].Hum Mol Genet,2002,11(23):2979-2987.
[3] Kohlhase J,Chitayat D,Kotzot D,et al.SALL4 mutations in Okihiro syndrome(Duane-radial ray sy ndrome),acro-renalocular syndrome,and related disorders[J].Hum Mutat,2005,26(3):176-183.
[4] M a Y,Cui W,Yang J,et al.SA LL4,a novel oncogene,is constitutivelyexpressed in human acute myeloid leukemia(AML)and induces AML in transgenic mice[J].Blood,2006,108(8):2726-2735.
[5] Cui W,K ong N R,Ma Y,et al.Differential expression of the novel oncogene,SALL4,in lymphoma,plasma cell myeloma,and acute lymphoblastic leukemia[J].Mod Pathol,2006,19(12):1585-1592.
[6] Livak K J,Schmittgen T D.Analysis of relative gene ex pression data using real-time quantitative PCR and the 2(-delta delta C(T))method[J].Methods,2001,25(4):402-408.
[7] Yang J,Chai L,Liu F,et al.Bmi-1 is a target gene for SALL4 in hematopoietic and leukemic cells[J].Proc Natl Acad Sci U SA,2007,104(25):10494-10499.
[8] Bö hm J,Sustmann C,Wilhelm C,et al.SALL4 is directly activated by TCF/LEF in the canonical Wnt signaling pathway[J].Biochem Biophy s Res Commun,2006,348(3):898-907.
[9] Bard J D,Gelebart P,Amin H M,et al.Signal transducer and activator of transcription 3 is a transcriptional factor regulating the gene expression of SALL4[J].FASEB J,2009,23(5):1405-1414.
[10] Wu Y,Jiang P,Lin Y,et al.Expression of phosphorylated-ST AT3 and osteopontin and their correlation in melanoma[J].J Huazhong Univ Sci T echnol[Med Sci],2009,29(2):246-250.
[11] Yang J,Chai L,Gao C,et al.SA LL4 is a key regulator of survival and apoptosis in human leukemic cells[J].Blood,2008,112(3):805-813.

