糖毒性下UCP2介导的胰岛功能紊乱的研究
陈莹晖 李裕明 邓 波 李丽华 高海波 陈璐璐
1海南医学院附属医院重症医学科,海口 570102
2华中科技大学同济医学院附属协和医院内分泌科,武汉 430022
葡萄糖是体内重要的能量来源,体内需要的能量大多数是通过糖代谢获得的,因此葡萄糖在体内不仅是能量的来源,还是机体能量代谢的重要调节者。葡萄糖与胰岛素的分泌密切相关,不仅控制胰岛素的分泌,还控制胰岛素的生物合成、剪切、运输。当体内的葡萄糖浓度升高,并持续很长时间,会对一系列的组织、器官造成损伤,这一过程称为“葡萄糖毒性”。在2型糖尿病患者中观察到慢性高血糖对胰岛细胞的毒性作用并损害细胞的功能,但是高糖引起的胰岛β细胞功能紊乱的机制还不是很清楚。最近有研究发现氧化应激和线粒体内膜上的胰岛INS-1细胞解偶联蛋白2(UCP2)通路均与糖毒性作用有密切的关系。本研究拟观察在高糖作用下INS-1细胞内活性氧物质(ROS)代谢产物丙二醛(MDA)的变化和UCP2 mRNA表达,探讨它们之间的关系,进一步了解糖尿病糖毒性的可能机制。
1 材料与方法
1.1 细胞株与试剂
INS-1细胞由华中科技大学同济医学院附属协和医院内分泌实验室提供,RPMI 1640、胎牛血清、T rizol购于美国Gibco公司,分析纯的葡萄糖购于广东省化学试剂工程技术研究中心,Marker、cDNA第一链合成试剂盒、PCR扩增试剂盒购于天根生化公司,MDA测定试剂盒购于南京建成生物工程研究所,大鼠胰岛素测定试剂盒购于上海朗顿生物公司。扩增 UCP2基因片段上游引物为:5′-CTGGGCACCATCCTAACC-3′,下 游 引 物 为 :5′-GCAAGGGAGGTCGTCTGTC-3′,β-actin 基因的PCR 引 物,上游引物 为:5′-TGTGATGGTGGGTATGGGTCAG-3′, 下 游 引 物 为 :5′-GCCATCTCT TGCTGAAGTC-3′,PCR引物合成由上海英骏生物技术有限公司完成。
1.2 器材
721型可见分光光度计(上海光学仪器五厂有限公司),Gradient 96型PCR仪(德国Biometra公司),Galaxy型二氧化碳培养箱(德国Rs Biotech公司),Tanon-4100型凝胶成像系统(TANON公司),Power PAC2000电泳仪(美国Bio-Rad公司)。
1.3 细胞培养和分组
将INS-1细胞培养于含10%胎牛血清(FBS)的RPMI 1640培养液中,同时添加以下成分:10 mmol/L Hepes,1 mmol/L 丙酮酸钠 ,50 μ mol/L β-巯基乙醇,100 U/mL青霉素和100 μ g/mL的链霉素。按照1∶4传代后,加入普通的含11.1 mmol/L葡萄糖的RPMI 1640培养液,10%FBS,隔天换液,培养72 h后,去掉原来的培养液,实验设4个组:①对照组(11.1 mmol/L葡萄糖组);②16.7 mmol/L葡萄糖组;③22.2 mmol/L葡萄糖组;④33.3 mmol/L葡萄糖组,②~④为高糖组。每组设4复孔,培养48 h。
1.4 测定指标和方法
1.4.1 细胞上清液MDA的测定 过氧化脂质降解产物中的MDA可与硫代巴比妥酸(TBA)缩合,形成红色产物,在532 nm处有最大吸收峰,利用这一原理根据公式可计算出MDA的含量,称TBA法。INS-1细胞经不同浓度葡萄糖干预48 h后,吸取各组上清液离心后各留200 μ L于EP管内,采用TBA法测定细胞上清液MDA。
1.4.2 葡萄糖刺激的胰岛素分泌(GSIS)测定INS-1细胞分组培养48 h后,用含16.7 mmol/L葡萄糖的KRBH液刺激90 min后取上清,利用大鼠胰岛素试剂盒,采用ELISA方法检测胰岛素分泌。
1.4.3 倒置显微镜下观察INS-1细胞形态 将对数生长期的INS-1细胞用0.25%的胰蛋白酶消化成单细胞悬液后,以3×105/mL密度接种于6孔培养板内,每孔含培养液2.5 mL,培养液中血清浓度为10%,在37℃、5%CO2的培养箱中进行培养。隔天换液,培养72 h后,吸出培养液,换含不同浓度葡萄糖(11.1、16.7、22.2 、33.3 mmol/L)的培养液作用24和48 h后,倒置显微镜下观察并照相。
1.4.4 RT-PCR检测INS-1细胞UCP2 mRNA的水平 11.1 mmol/L葡萄糖对照组,16.7、22.2、33.3 mmol/L葡萄糖各组INS-1细胞分别培养48 h后Trizol法提取总RNA(按试剂盒说明书操作),经逆转录反应生成cDNA第一链,取逆转录产物2 μ L作模板,以上、下游引物扩增 UCP2基因片段,PCR条件如下:94℃预变性5 min,94℃变性1 min,55℃退火1 min,72℃延伸10 min,经 35个循环,扩增产物在1.2%琼脂糖凝胶中电泳,成像,观察结果,分析目的基因与β-actin凝胶电泳条带吸光度之比值。
1.5 统计学处理
2 结果
2.1 INS-1细胞的形态学改变
在倒置相差显微镜下观察发现,对照组INS-1细胞呈抱团、叠层生长,随着葡萄糖浓度的升高,细胞逐渐失去抱团生长的特性,凋亡细胞增多,使用高糖培养48 h后,从16.7 mmol/L糖浓度组开始就可见细胞体积变小,贴壁能力减弱,细胞内颗粒状物质增多,细胞变圆,皱缩甚至浮起,尤其是22.2 mmol/L和33.3 mmol/L葡萄糖浓度组,细胞损害尤为明显。见图1。
2.2 不同浓度葡萄糖对INS-1细胞MDA含量的影响
随着葡萄糖浓度的增加,INS-1细胞MDA含量逐渐增加,16.7 mmol/L高糖组与对照组(11.1 mmol/L)比较,(2.84±1.02)和(0.47±0.28)nmol/mL,P=0.008;22.2 mmol/L高糖组和16.7 mmol/L高糖组相比较,(6.28±0.57)和(2.84±1.02)nmol/mL,P=0.001;33.3 mmol/L高糖组和22.2 mmol/L高糖组比较,(12.13±1.45)和(6.28±0.57)nmol/ mL,P=0.000,差异均有显著性意义。

图1 不同浓度葡萄糖培养48 h INS-1细胞形态改变(×100)Fig.1 The morphology of the INS-1 cell lines culured for 48 h with different concentrations of glucose(×100)
2.3 不同浓度葡萄糖对INS-1细胞GSIS值的影响
不同浓度的葡萄糖作用48 h后,葡萄糖刺激下的胰岛素分泌结果表明:随着葡萄糖浓度的升高,与对照组相比,GSIS值逐渐下降,16.7 mmol/L高糖组与对照组比较,(1.50±0.03)和(2.27±0.19),P=0.000;22.2 mmol/L高糖组与16.7 mmol/L高糖组比较,(1.18±0.12)和(1.50±0.03),P=0.003;33.3 mmol/L高糖组和22.2 mmol/L高糖组比较,(0.88±0.04)和(1.18±0.12),P=0.004,差异均有显著性意义。
2.4 不同浓度葡萄糖对INS-1细胞UCP2 mRNA表达的影响
随着葡萄糖浓度增加,INS-1细胞 UCP2 mRNA表达总体逐渐增强,其中22.2 mmol/L高糖组与11.1 mmol/L对照组相比较,P=0.021;33.3 mmol/L高糖组与11.1 mmol/L对照组相比较,P=0.002;33.3 mmol/L高糖组与16.7 mmol/L高糖组相比较,P=0.046,差异均具有统计学意义;16.7 mmol/L高糖组与11.1 mmol/L对照组相比较差异无统计学意义(P=0.135)。但从总体上看,UCP2 mRNA表达仍呈增强趋势。见图2、表1。
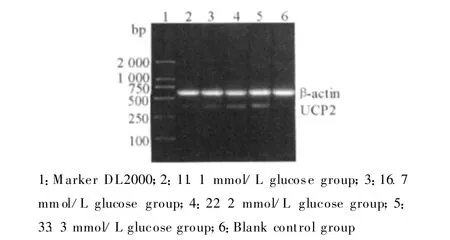
图2 RT-PCR检测高糖处理后INS-1细胞UCP2 mRNA的表达Fig.2 T he expression of the UCP2 mRNA detected by RTPCR in INS-1 cells culured with high concentration of glucose
3 讨论
胰岛β细胞对葡萄糖浓度的改变十分敏感,胰岛素分泌的绝对或相对不足被认为是糖尿病发生的主要原因[1],目前有关高糖损害胰岛β细胞的分泌功能的学说众多,除了认为高糖可造成β细胞凋亡增加而损害胰岛β细胞功能外,高血糖还可通过影响细胞中核转录因子NF-κ B信号通路[2],引起胰岛细胞功能的紊乱。还有研究认为胰岛β细胞线粒体上存在的UCP2信号通路也参与了调节胰岛素分泌的作用[3-4]。
表1 不同浓度葡萄糖对INS-1细胞UCP2 mRNA表达的影响(±s,n=4)Table 1 The effects of different concentrations of glucose on the expression of the UCP2 mRNA in INS-1 cell lines(±s,n=4)

表1 不同浓度葡萄糖对INS-1细胞UCP2 mRNA表达的影响(±s,n=4)Table 1 The effects of different concentrations of glucose on the expression of the UCP2 mRNA in INS-1 cell lines(±s,n=4)
*P<0.01 vs 11.1 mmol/L glucose g roup;△P<0.01 vs 16.7 mmol/L glucose group
Glucose concentrations(mmol/L) UCP2 mRNA 11.1 0.090±0.040 16.7 0.159±0.067 22.2 0.205±0.058*33.3 0.256±0.074*△
UCP2是线粒体内膜上的一种质子转运蛋白,当它被激活的时候,可以产生质子的渗漏,降低线粒体在呼吸时形成的H+梯度,使氧化磷酸化解偶联,ATP合成降低,导致细胞代谢中的能量以热能的形式释放出来。因此,该质子转运蛋白被称为解偶联蛋白(uncoupling proteins,UCPs)。目前,已发现的UCPs有 5个亚型:UCP1、UCP2、UCP3、UCP4 和UCP5,其中,UCP2在1997年首先被发现存在于多种组织包括胰腺组织中[5]。当UCP2在胰岛细胞表达增加时,通过使线粒体的氧化磷酸化解偶联,ATP产生减少,ATP/ADP比值下降,使K+/ATP通道关闭减少,因此抑制了Ca2+的内流,减少了胰岛素的分泌,造成胰岛 β细胞功能失调。但是UCP2的活性在胰岛细胞内是如何被调节的还不清楚。Brand等[6]提出一个 UCP2负调控的假设模型:认为过氧化物的产生依赖于线粒体内膜的质子电势差,当线粒体内膜的质子电势差升高时,过氧化物的产生也相应的增多了,过氧化物可能是通过某种中介物激活UCP2内膜的质子漏活性,因此导致线粒体膜电位的下降,从而以一种反馈回路的方式限制了线粒体过氧化物的产生。最近,有研究表明,当一种特殊的活性氧(ROS)过氧化物添加到隔离出来的线粒体时,能激活UCP2和它的同族体 UCP1和UCP3[7]。在国外有学者研究发现UCP2基因敲除的老鼠在胰岛和其他的组织中产生更多的过氧化物[8-9],并且也已经观察到在ob/ob鼠的β细胞中增多的过氧化物可激活UCP2[10-11]。体外和体内实验也发现高糖刺激下UCP2表达的增加是引起2型糖尿病β细胞功能障碍的一个原因[12],此外,在糖毒性的动物模型中抑制 UCP2的表达能够极大提高β细胞功能[13]。以上的研究表明 ROS产物、UCP2和胰岛素的分泌这三者之间可能存在着复杂的调控机制。
本研究利用不同浓度的葡萄糖培养INS-1细胞,首先观察INS-1细胞的形态学改变,结果显示:随着葡萄糖浓度的增加,培养时间的延长,细胞逐渐失去抱团生长的特性,细胞内颗粒状物质增多,细胞皱缩,凋亡细胞逐渐增多,且随着葡萄糖浓度的增加,这种改变更为明显,说明了葡萄糖毒性的存在。并且应用可见分光光度计测定INS-1细胞ROS的代谢产物 MDA,运用 RT-PCR方法检测 UCP2 mRNA的表达和葡萄糖刺激下INS-1细胞的胰岛素分泌功能,结果表明:随着葡萄糖浓度的增加,MDA的含量增加且其差异具有统计学意义,UCP2 mRNA的表达总体也呈增强趋势,同时INS-1细胞的胰岛素分泌功能下降。根据以上结果,我们推测,慢性高糖会导致氧化应激作用的加强,ROS生成增多,在胰岛β细胞,因其ROS灭活酶含量低微,ROS较易损害β细胞功能并导致胰岛β细胞凋亡,ROS产物MDA增多又能引起胰岛细胞线粒体上的UCP2 mRNA表达增加,UCP2通过氧化磷酸化解偶联作用使ATP产生减少,进一步引起胰岛素分泌功能受损。
本实验的结果提示了ROS激活可通过 UCP2介导的途径引起胰岛细胞的功能紊乱,这可能也是2型糖尿病“糖毒性”作用的重要发病机制之一。因此抑制UCP2的活性也许能为改善2型糖尿病的胰岛细胞功能紊乱提供一个有效的治疗方法。但由于UCP2分布的广泛性以及组织特异性,如脂肪及骨骼肌组织的 UCP2调节能量代谢,故广泛地减少UCP2并不恰当。最好能找到一种组织特异性的方法,仅选择性减少β细胞的UCP2,在不影响外周组织能量代谢的基础上增加胰岛素分泌。这可能是以后研究的热点。
[1] Polonsky K S.T he beta-cell in diabetes:from molecular genetics to clinical research[J].Diabetes,1995,44(6):705-717.
[2] Kwon G,Corbett J A,Hauser S,et al.Evidence for involvement of the proteasome complex(26S)and NFkappaB in IL-1beta-induced nitric oxide and prostaglandin production by rat islets and RINm5F cells[J].Diabetes,1998,47(4):583-591.
[3] Chan C B,De Leo D,Joseph J W,et al.Increased uncoupling protein-2 levels in beta-cells are associated with impaired glucose-stimulated insulin secretion:mechanism of action[J].Diabetes,2001,50(6):1302-1310.
[4] Zhang C Y,Baffy G,Perret P,et al.Uncoupling protein-2 negatively regulates insulin secretion and is a majo r link between obesity,β cell dysfuction,and type 2 diabetes[J].Cell,2001,105(6):745-755.
[5] Chan C B,M acDonald P E,Saleh M C,et al.Overexpression of uncoupling protein 2 inhibits glucose-stimulated insulin secretion from rat islets[J].Diabetes,1999,48(7):1482-1486.[6] Brand M D,Affourtit C,Esteves T C,et al.Mitochondrial superoxide:production,biological effects,and activation of uncoupling proteins[J].Free Radic Biol M ed,2004,37(6):755-767.
[7] Echtay K S,Roussel D,St-Pierre J,et al.Superoxide activates mitochondrial uncoupling proteins[J].Nature,2002,415(6867):96-99.
[8] Joseph J W,Koshkin V,Saleh M C,et al.Free fatty acid-induced beta-cell defects are dependent on uncoupling protein 2 expression[J].J Biol Chem,2004,279(49):51049-51056.
[9] Arsenijevic D,Onuma H,Pecqueur C,et al.Disruption of the uncoupling protein-2 gene in mice reveals a role in immunity and reactive oxygen species production[J].Nat Genet,2000,26(4):435-439.
[10] Krauss S,Zhang C Y,Sco rrano L,et al.Superoxide-mediated activation of uncoupling protein 2 causes pancreatic beta cell dy sfunction[J].J Clin Invest,2003,112(12):1831-1842.
[11] Koshkin V,Wang X,Scherer P E,et al.Mitochondrial functional state in clonal pancreatic beta-cells exposed to free fatty acids[J].J Biol Chem,2003,278(22):19709-19715.
[12] Affourtit C,Brand M D.Uncoupling protein-2 contributes significantly to high mitochondrial proton leak in INS-1E insulinoma cells and attenuates glucose-stimulated insulin secretion[J].Biochem J,2008,409(1):199-204.
[13] De Souza C T,Araujo E P,Stoppiglia L F,et al.Inhibition of UCP2 expression reverses diet-induced diabetes mellitus by effects on both insulin secretion and action[J].FASEB J,2007,21(4):1153-1163.

