基于网络药理学和分子对接技术探讨健心合剂治疗慢性心力衰竭的作用机制
范慧敏 张泽宇 毕颖斐


摘要 目的: 应用网络药理学和分子对接技术探讨健心合剂治疗慢性心力衰竭的作用机制。 方法: 通过TCMSP数据库检索中药复方健心合剂的中药组分并确定其有效成分,获取有效成分对应的靶蛋白。运用GeneCards、OMIM、PharmGkb、TTD、DrugBank数据库获取慢性心力衰竭相关蛋白;利用STRING数据库探究药物与疾病交集靶点的互作关系,通过Cytoscape.v3.8.2软件筛选核心靶点进行成分.靶点拓扑分析;通过Rx64 4.0.2软件对交集蛋白进行基因本体(GO)功能富集分析、京都基因与基因组百科全书(KEGG)通路富集分析;采用AutoDock Vina软件对蛋白与成分进行分子对接验证。 结果: 通过筛选共得到健心合剂166种活性成分、231种中药潜在作用靶点。药物与疾病交集蛋白的核心为RAC.α丝氨酸/苏氨酸.蛋白激酶B(AKT1)、丝裂原活化蛋白激酶1(MAPK1)、肿瘤坏死因子(TNF)等。基因富集分析得到2 971条GO功能条目、150条KEGG通路。结果表明,磷脂酰肌醇3激酶(PI3K).蛋白激酶B(AKT)、TNF等通路与慢性心力衰竭关系密切。分子对接显示,核心蛋白与相应成分之间均具有良好的结合能力。 结论: 健心合剂中的主要活性成分槲皮素、木犀草素、山柰酚、丹参酮ⅡA、黄芩素、β.谷甾醇可能作用于AKT1、MAPK1、TNF等核心靶点,进而调节PI3K.AKT、TNF等信号通路治疗慢性心力衰竭。
关键词 慢性心力衰竭;健心合剂;网络药理学;分子对接;中医药
doi: 10.12102/j.issn.1672.1349.2024.10.003
The Mechanism of Jianxin Mixture for the Treatment of Chronic Heart Failure Based on Network Pharmacology and Molecular Docking Technology
FAN Huimin, ZHANG Zeyu, BI Yingfei
First Teaching Hospital of Tianjin University of Traditional Chinese Medicine, National Clinical Research Center for Chinese Medicine Acupuncture and Moxibustion, Tianjin 300381, China; Tianjin University of Traditional Chinese Medicine, Tianjin 301617, China
Corresponding Author BI Yingfei, E.mail: yingfei1981@163.com
Abstract Objective: To explore the mechanism of Jianxin mixture for treating chronic heart failure based on network pharmacology and molecular docking technology. Methods: TCMSP database was used to search the traditional Chinese medicine components in Jianxin mixture and identify the active ingredient,and the corresponding target proteins were obtained.GeneCards,OMIM,PharmGkb,TTD and DrugBank databases were used to obtain chronic heart failure related proteins.The interaction between drug and disease intersection targets was investigated by STRING database,and core targets were screened by Cytoscape.v3.8.2 software for composition.target topology analysis.The gene ontology(GO) function enrichment analysis and Kyoto Encyclopedia of Genes and Genomes(KEGG) pathway enrichment analysis were performed by Rx64 4.0.2 software.AutoDock Vina software was used to verify the molecular docking between proteins and components. Results: A total of 166 kinds of active ingredients and 231 kinds of potential targets of Chinese medicine were obtained by screening.The core of drug and disease intersection proteins were RAC.α serine/threonine.protein kinase B(AKT1),mitogen.activated protein kinase 1(MAPK1),tumor necrosis factor(TNF).Gene enrichment analysis obtained 2 971 GO function terms and 150 KEGG pathways.The results showed that phosphatidylinositol 3 kinase.protein kinase B(PI3K.AKT) and TNF pathways were closely related to chronic heart failure.Molecular docking showed that the core proteins had good binding ability with the corresponding components. Conclusion: The main active ingredients in Jianxin mixture,such as quercetin,luteolin,kaempferol,tanshinone ⅡA,baicalein and β.sitosterol,might act on core targets such as AKT1,MAPK1 and TNF,and then regulate PI3K.AKT,TNF and other signaling pathways for the treatment of chronic heart failure.
Keywords chronic heart failure; Jianxin mixture; network pharmacology; molecular docking; traditional Chinese medicine
慢性心力衰竭(chronic heart failure,CHF)是指心脏长期受到致病因素刺激后发生结构或功能改变,临床常见疲乏、呼吸窘迫、水肿等症状或体征 [1] 。中医学将CHF归属于“心悸”“水肿”等范畴,认为其是由于多种心脏疾病恶化或心脏本身气血阴阳亏耗所致功能紊乱,产生瘀血、痰饮等病理产物,标本互作致使病情进一步恶化 [2] 。健心合剂源自《中国中医秘方大全》,是 近现代龚传鼎医家针对CHF的经验方,由葶苈子、桑 白皮、丹参、红花、桃仁、赤芍组成,功在利水化饮、活血消瘀,有助于消除瘀血、痰湿等病理产物。方中葶苈子、桑白皮有利水化饮之效,有助于加快代谢病理性积液,配以丹参、红花、桃仁、赤芍活血通脉,临床应用颇为灵验。
网络药理学依托于公共数据库进行数据挖掘、生信分析,借助网络模型进行可视化分析,多维度揭示药物对疾病的调控机制,在中药复方领域,为解析药物成分与生物效应之间的关联提供了精准的预测与解析,进而开拓了现代药物研究的新模式。分子对接技术可演算得到受体与配体之间的亲和力及结合形式,为药物的筛选与评价提供了科学依据。鉴于健心合剂治疗CHF的显著疗效,本研究采用网络药理学及分子对接技术探讨该处方治疗CHF的作用机制,旨在为后续实验研究与临床实践提供参考和方向。
1 健心合剂改善心力衰竭的现代药理学研究
1.1 葶苈子
葶苈子治疗CHF表现为利尿、正性肌力、抑制心室重构及保护心肌细胞等多维度的药理作用 [3] 。相关研究表明,葶苈子主要通过降低血清Na +、心钠素、脑钠素浓度,调节肺、肾水液代谢相关蛋白以发挥利尿作用 [4] ,减少CHF病人体内液体潴留,减轻液体过载对心脏的负担。葶苈子可减轻心肌细胞凋亡与氧化应激损伤 [5] ,为抑制CHF进展中的病理性心室重构提供支持 [6] 。葶苈子及其提取物可显著提高心肌收缩力,优化心脏血流动力学,从而提高心功能 [7] 。
1.2 桑白皮
桑白皮可改善心力衰竭大鼠心功能,有效降低脑钠肽(BNP)、肌钙蛋白I(cTnI)及肿瘤坏死因子α(TNF.α)水平,增加大鼠尿量,表现出抗心力衰竭作用 [8] 。多项研究证实,桑白皮通过调节细胞内钙稳态、内皮依赖途径、促进一氧化氮合酶(NOS)合成和一氧化氮(NO)释放等引起血管舒张 [9.11] ,减轻心脏后负荷。桑白皮对NO的调节可作用于支气管,达到松弛目的,发挥平喘功能 [12] ,有助于一定程度缓解CHF的临床症状。桑白皮中的总黄酮成分具有良好的镇咳和祛痰作用 [13] 。
1.3 丹参
丹参及其组分可有效抑制血管紧张素Ⅱ(AngⅡ)诱导的心房钠尿肽、c.Fos、c.Jun、β.肌动蛋白的过度表达 [14.15] ,降低心肌细胞Ca 2+ 水平,进一步阻断心肌肥厚信号向核内的传导 [16.17] ,延缓CHF进展。通过调控凋亡基因蛋白表达,可发挥抑制心肌细胞凋亡的效应,从而保护心肌 [18] 。丹参的有效组分丹参酮ⅡA可作用于磷脂酰肌醇3激酶(PI3K).蛋白激酶B(AKT).哺乳动物雷帕霉素靶蛋白(mTOR)信号通路,促进细胞自噬,减轻心肌氧化应激损伤 [19] 。丹参酮ⅡA还可抑制还原型烟酰胺腺嘌呤二核苷酸(NADH)/还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)氧化酶的活性,并提高超氧化物歧化酶(SOD)活性,从而有效清除氧自由基,抑制脂质过氧化反应,保护血管内皮细胞的功能 [20] 。
1.4 红花
相关研究表明,红花.葶苈子药对通过调控miRNA.22/转化生长因子β 1(TGF.β 1)信号通路,抑制成纤维细胞增殖和胶原合成,减轻心肌梗死后心力衰竭小鼠的心肌重构 [21] 。已证实红花中的关键活性成分红花黄色素在临床应用中能显著改善冠心病心力衰竭病人BNP水平及心功能 [22] ,降低肺源性心脏病心力衰竭病人心肌损伤标志物及血清超敏C反应蛋白(hs.CRP)水平,抵抗炎症反应并减轻心肌损害 [23] 。另有研究表明,红花黄色素A对离体心肌细胞线粒体有保护作用,可缓解其肿胀,增强膜的流动性,显著抑制由羟自由基触发的线粒体脂质过氧化,缓解大鼠心肌线粒体损伤 [24] 。
1.5 桃仁
目前桃仁单药在改善CHF的临床应用研究相对有限,已有的部分研究对揭示其潜在的药理作用提供了思路。桃仁可抑制去甲肾上腺素引起的缩血管作用,降低血管阻力 [25] ,能为减轻心脏后负荷提供理论支持。另有研究表明,桃仁可调节脂质代谢并抑制炎症反应,一定程度发挥降脂稳斑的作用 [26] ,减少心血管事件的发生风险。桃仁具有抗血小板聚集、抗血栓形成、改善急性心肌梗死大鼠心肌缺血损伤 [27] 的作用,可能为防治CHF并发症及改善预后等提供新的治疗方向。
1.6 赤芍
研究表明,赤芍中的重要活性成分赤芍总苷可改善心肌细胞电生理,缩小缺血区面积,减低心肌酶学指标活性,这种作用呈剂量依赖性 [28.29] 。赤芍总苷可稳定细胞膜,保护内源性抗氧化酶活性,清除自由基,达到保护心肌细胞的目的 [30] 。赤芍总苷通过减轻心肌缺血大鼠血清炎症水平,保护缺血心肌细胞线粒体的相对完整性,从而缩小大鼠心肌梗死面积 [31] 。赤芍总苷对RAS同源基因家族成员A(RhoA)/Rho相关卷曲螺旋形成蛋白激酶(ROCK)通路可发挥抑制作用,以降低线粒体膜电位及提高游离Ca 2+ 水平,减少心肌细胞凋亡 [32.33] 。
1.7 健心合剂的现代药理作用及临床应用概述
中医学认为CHF的发生是心气虚弱无力鼓动血脉,致使心血瘀阻,痰湿、水饮、瘀血等病理产物蓄积进一步损及阴阳,以致恶性循环。CHF病机总属本虚标实,多见虚实夹杂。健心合剂具有利水、消瘀之功,临床疗效颇佳。相关研究表明,健心合剂可显著改善CHF病人心功能 、运动耐量和中医证候疗效,降低60 d 再住院率 [34] 。该方可有效调控过度激活的神经和内分泌系统,进而促进心肌病理性重构的逆转,延缓CHF的病程 [35] 。早期应用健心合剂治疗效果优于晚期治疗,进一步强调了其在预防CHF中的重要作用。在动物模型研究中,健心合剂可显著增加大鼠心脏冠状动脉血流量、心肌收缩幅度,减慢心率,改善微循环 [36] 。还可通过调节线粒体内钙、镁含量及相关酶活性,进而发挥抗心肌缺血的作用 [37] 。
2 资料与方法
2.1 药物活性成分的收集与筛选
运用TCMSP数据库(http://tcmspw.com/tcmsp.php), 以赤芍、丹参、红花、桑白皮、桃仁、葶苈子为检索词,设定口服生物利用度(OB)≥30%、类药性(DL)≥0.18为筛选条件获取中药的有效成分。通过TCMSP数据库根据有效成分ID查询靶蛋白,导入UniProt 数据库(https://www.uniprot.org/)进行名称的标准化处理。
2.2 疾病靶点预测
基于OMIM数据库(https://omim.org/)、GeneCards数据库 (http://www.genecards.org/)、PharmGkb数据库(http://www.pharmgkb.org/)、TTD数据库(http://db.idrblab.net/ttd)和DrugBank数据库(https://www.drugbank.ca/),以“chronic heart failure”为关键词进行检索,对CHF相关蛋白进行收集、整理。
2.3 蛋白.蛋白互作(PPI)网络的构建与分析
为获取药物与疾病的交集靶点,保存为Drug.Disease,将所得结果输入STRING数据库(http://string.db.org)分析蛋白相互作用关系。利用Cytoscape.v3.8.2软件以度值、介度、紧密度、网络中心性和局部边缘通性均大于中位值为限定条件进行2次筛选,最终得到核心蛋白。
2.4 药物成分.疾病靶点网络的构建
将健心合剂活性成分和靶蛋白导入Cytoscape.v3.8.2 软件,进行可视化处理,构建成分.靶点网络。网络图中,化合物和靶点用节点表示,节点之间相互作用的关系用边表示。
2.5 基因本体(GO)功能富集分析和京都基因与基因组百科全书(KEGG)通路富集分析
将Drug.Disease通过Rx64 4.0.2软件以 P <0.05为筛选条件进行GO功能富集分析和KEGG通路富集分析,GO功能富集分析主要包括生物过程(biological process,BP)、分子功能(molecular function,MF)和细胞组成(cellular component,CC)。将GO富集分析得到的3个部分取排名居前10位的功能绘制条形图;将KEGG通路富集分析获取的前30条通路绘制KEGG气泡图。
2.6 分子对接验证及筛选
将PPI排名居前3位的核心蛋白为受体,相应的药物成分为配体进行分子对接分析。通过PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)获取成分的2D结构并借助Chem3D.exe软件进行3D转化及结构优化,保存为lig.mol2。在PDB数据库(http://www.rcsb.org/)中获取蛋白的晶体结构,通过PyMOLWin.exe软件去除H 2O和小分子配体,保存为 rep.pdb。将rep.pdb和lig.mol2导入AutoDock Tools 1.5.6 软件转 化为PDBQT文件和确定活性口袋文件grid.gpf, 最后,利用AutoDock Vina和PyMOLWin.exe进行分子对接和可视化处理。
3 结 果
3.1 健心合剂活性成分的收集与筛选
基于TCMSP数据库查询健心合剂成分,经筛选后得到活性成分166种,其中赤芍29种、丹参65种、红花22种、桑白皮31种、桃仁23种、葶苈子12种。对这些有效成分进行靶标预测,通过UniProt进行名称标化,获得231种靶蛋白。详见表1。
3.2 疾病靶标的筛选及PPI网络的构建
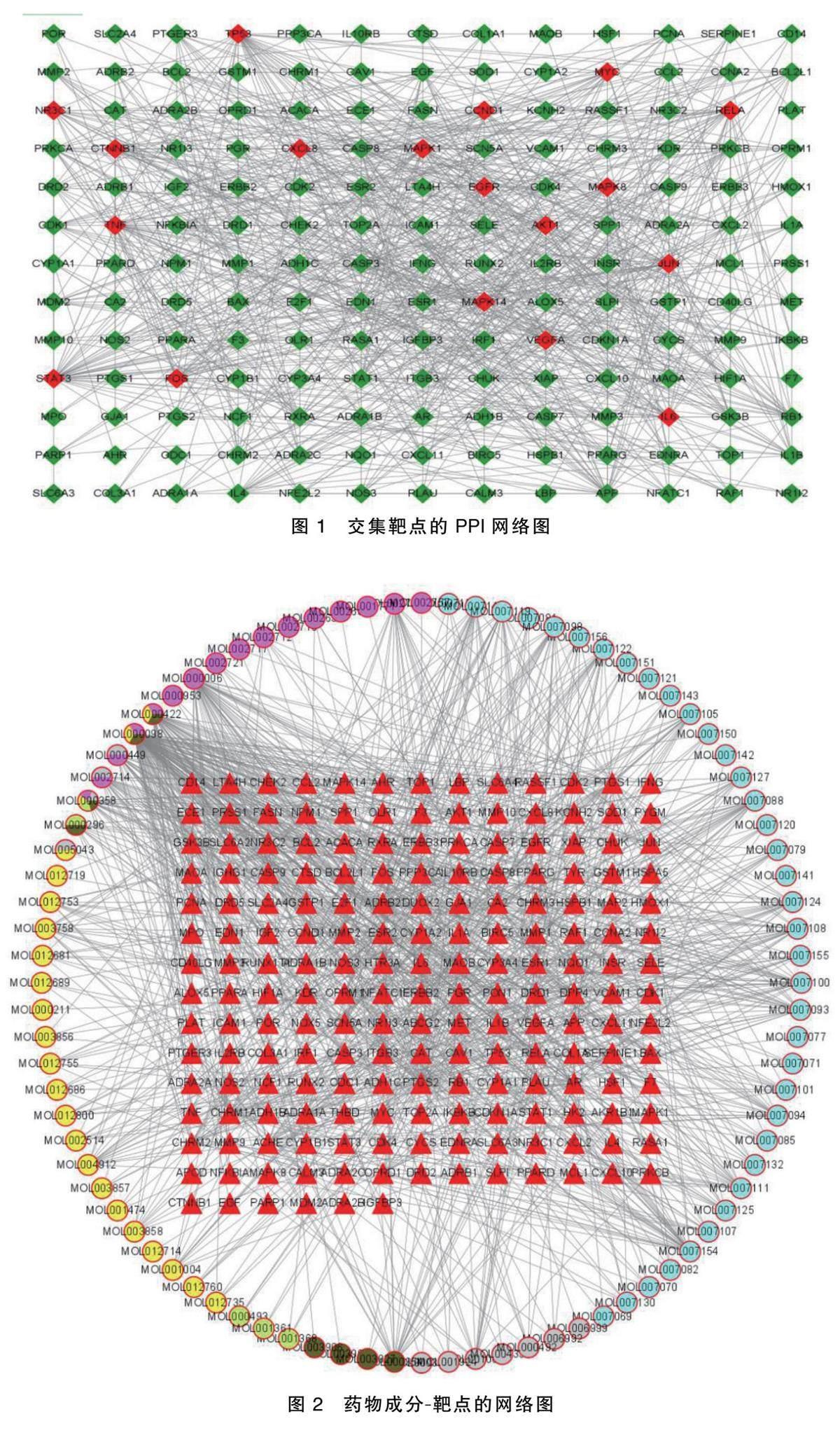
通过OMIM、GeneCards、 PharmGkb、TTD、DrugBank 等数据库共获得3 125种CHF相关蛋白。将疾病蛋白与药物靶点取交集,结果显示,188种交集蛋白即为健心合剂作用于CHF的靶点。将交集蛋白输入STRING数据库获得蛋白互作关系后通过Cytoscape 软件筛选核心蛋白(见图1),图中红色节点代表核心蛋白,绿色节点代表相关蛋白。其中,核心蛋白主要为RAC.α丝氨酸/苏氨酸.蛋白激酶B(AKT1)、丝裂原活化蛋白激酶1(MAPK1)、肿瘤坏死因子(TNF)等。
3.3 成分.靶点拓扑图的构建
利用Cytoscape.v3.8.2软件对成分.靶点进行拓扑分析,包括276个节点、952条边,详见图2。内部红色三角形代表靶蛋白,外部环形代表药物成分,黄色圆形为桑白皮,青色圆形为桃仁,墨绿色圆形为葶苈子,灰色圆形为赤芍,蓝色圆形为丹参,粉红色圆形为红花,混合颜色为多种药物共有的成分。结果显示, 健心合剂主要成分为槲皮素、木犀草素、山柰酚、丹参酮ⅡA、 黄芩素、β.谷甾醇等;度值排名居前10位的靶蛋白分别为前列腺素G/H合酶1/2、雌激素受体、雄性激素受体、钠通道蛋白5亚基α、碳酸酐酶2、二肽基肽酶4、胰蛋白酶1、乙酰胆碱酯酶、β 2肾上腺素能受体。可见,健心合剂治疗CHF具有多组分、多靶点的优势。
3.4 GO和KEGG富集分析
GO功能富集分析共获得2 971个条目,其中BP为2 631条,主要包括氧代谢、含氧量反应、氧化应激、药物反应、化学应激等;CC为126条,主要与突触前膜、突触后膜、质膜筏等有关;MF为214条,主要涉及儿茶酚胺结合、G蛋白偶联受体活性、药物结合等。详见图3。
KEGG通路富集分析共获得150条信号通路。详见图4。图中纵坐标代表通路名称,横坐标代表基因的占比,圆圈面积代表富集在该通路上基因的数目,颜色代表富集程度,红色越深提示富集显著性越强。结果显示,PI3K.AKT、TNF等信号通路与CHF关系密切。PI3K.AKT通路涉及心肌细胞肥大、凋亡和心肌纤维化等机制 [38.39] ;TNF.α等炎性细胞因子过高加剧CHF病人血流动力学紊乱及心肌重塑 [40] 。可见,健心合剂通过多通路对CHF发挥治疗作用。
3.5 分子对接验证及筛选
受体与配体间自由能<-7 kcal/mol(-29.29 kJ/mol) 表示结合等级强烈 [41] 。通过分子对接验证PPI核心靶点中排名居前3位的AKT1、MAPK1、TNF与相应成分黄芩素、β.谷甾醇、山柰酚、木犀草素、槲皮素及丹参酮ⅡA之间的对接程度,结果表明,靶蛋白与对应化合物分子之间结合能均<-29.29 kJ/mol(见表2),其中与AKT1结合能最低的化合物为β.谷甾醇(-40.17 kJ/mol),与MAPK1结合能最低的化合物为木犀草素(-38.07 kJ/mol),与TNF结合能最低的化合物为丹参酮ⅡA(-39.75 kJ/mol)。将靶蛋白与对应化合物构建分子对接模式图,详见图5。说明药物成分与作用靶点之间具有良好的结合能力。
4 讨 论
本研究应用网络药理学与分子对接技术探讨健心合剂与CHF的关系,治疗CHF涉及的成分、靶点、通路等具体机制。成分.靶点拓扑分析显示,健心合剂主要通过槲皮素、木犀草素、山柰酚、丹参酮ⅡA、黄芩素、β.谷甾醇等活性成分协同调控CHF进程。现代药理研究表明,上述成分通过抗炎、抗氧化、抗纤维化、抗血栓、抗凋亡等途径阻止或延缓心室重构进展 [42.46] 。其中,槲皮素在此基础上扩张血管并增强免疫应答,在生化及组织学异常状态的修复中具有积极的作用 [47] ;木犀草素可正向调节心肌细胞收缩功能,抑制平滑肌细胞过度增殖和迁移,有效清除自由基 [48.50] ;山柰酚通过阻断AKT/糖原合成酶激酶.3β(GSK.3β)和p38丝裂原激活蛋白激酶(p38 MAPK)等通路,抑制心肌细胞凋亡 [51.52] ,并基于调节Ca 2+ 摄取诱导改善线粒体能量代谢和心肌细胞功能 [53] ;丹参酮ⅡA主要通过调节AMPK/mTOR介导的自噬通路发挥心脏保护作用 [54.56] ,抑制钙调磷酸酶/Nfatc3途径,调控心脏电生理特性,改善心脏肥大 [57] ;β.谷甾醇和黄芩素兼有杀菌、降脂、抗动脉粥样硬化、抑制血管重构、增强免疫及延缓心肌衰老等综合效应 [58.60] 。
PPI网络排名居前3位的核心蛋白为AKT1、MAPK1(ERK1)、TNF,可能是健心合剂改善CHF的关键靶点。AKT1是丝裂原活化蛋白激酶家族中的成员,在调节心脏生长、衰老、糖和脂质代谢紊乱等多种级联信号传导机制中发挥着关键作用 [61] 。AKT蛋白缺失可能导致早期收缩功能障碍,增加罹患心力衰竭的风险 [62] ,其可激活心脏中内皮型一氧化氮合酶(eNOS)信号传导,增加心脏毛细血管密度,延缓心肌的病理性改变 [63.64] 。MAPK是多种生化信号的整合点,参与细胞增殖、分化、转录调控和发育等关键过程。激活MAPK1可促进细胞增殖和分化,有效减少细胞凋亡 [65.67] 。木犀草素通过MAPK和PI3K.AKT途径修复内皮功能,抑制细胞凋亡,优化心肌收缩功能 [68.69] 。TNF是一种细胞因子,主要由巨噬细胞产生,对免疫反应、炎症反应、细胞凋亡、增殖和分化具有重要的调节作用。TNF.α在心肌细胞中通过干扰Ca 2+ 稳态发挥负性肌力效应 ,可能触发细胞凋亡途径 [70.71] 。TNF.α 可刺激其他促炎细胞因子合成 [72] ,破坏基质金属蛋白酶与其抑制剂的稳定性,加速细胞外基质降解 [73] 。丹参酮ⅡA可降低细胞TNF.α水平,缓解炎症反应,减轻心肌损伤 [74] ,通过抑制核转录因子.κB/TNF.α途径,进一步减少心肌细胞凋亡 [75] 。
KEGG通路富集分析结果中与心力衰竭关系密切的通路涉及PI3K.AKT、TNF等途径。TNF信号通路旨在通过激活MAPK和NF.κB信号通路,共同导致编码促炎基因的转录上调 [76] 。在CHF发展过程中,多种有害因素引起的应激反应促进TNF等炎性因子或细胞因子的自分泌和旁分泌,进而通过调节效应分子激活PI3K.AKT和ERK通路 [40,77.79] 。PI3K.AKT通路的激活可刺激下游效应分子,导致成纤维细胞转录因子活性增强及心肌组织中促凋亡因子的释放,加重心室重构,心肌顺应性、收缩力和同步性降低,心肌生理性电化学活动障碍,折返环和单向阻滞,最终造成心肌生理电化学性和组织物理结构特性的重大改变 [80.81] 。ERK信号通路是MAPK信号通路家族的一个重要分支,在关键的细胞过程(包括细胞存活和增殖)控制中发挥着重要作用,该通路被激活后以正反馈调节方式磷酸化ERK1/2的上游蛋白激酶,如Sos蛋白(SOS)、Raf.1蛋白激酶(Raf.1)和丝裂原激活的蛋白激酶(MEK),启动与成纤维细胞增殖相关基因的转录和表达,导致胶原合成异常增多,促进心肌纤维化改变,加剧病人血流动力学紊乱及心肌重塑 [82.83] 。
综上所述,借助网络药理学和分子对接技术探索出健心合剂可能通过槲皮素、木犀草素、山柰酚、丹参酮ⅡA、黄芩素、β.谷甾醇等活性成分对TNF通路、PI3K.AKT通路和ERK通路的多个信号传递环节实施调控以抑制CHF的发展,显示了该方通过多通路、多靶点、多组分调节疾病病理进程的中医优势,该结果与临床实践及疗效预期吻合。由于网络药理学和分子对接技术仅考虑药物活性成分的吸收情况和结合能力,未衡量其在复方中的含量及相互反应等问题,存在局限性,一定程度与中药辨证论治的整体观念相悖。今后需进一步探索这些成分在体内的真实浓度、药物之间的协同效应或潜在的拮抗作用,为精确的药效预测和治疗方案提供依据。随着多组学技术的快速发展,今后可从代谢组学全方位、多角度地揭示健心合剂对CHF的调控网络和潜在治疗机制。
参考文献:
[1] MCDONAGH T A, METRA M,ADAMO M, et al .2021 ESC guidelines for the diagnosis and treatment of acute and chronic heart failure[J].European Heart Journal,2021,42(36):3599.3726.
[2] 陈可冀, 吴宗贵,朱明军,等.慢性心力衰竭中西医结合诊疗专家共识[J].中国中西医结合杂志,2016,36(2):133.141.
[3] 曹雅雯, 汤岐梅,侯雅竹,等.葶苈子治疗心力衰竭的药理研究进展[J].中西医结合心脑血管病杂志,2019,17(20):3123.3126.
[4] 曾梦楠, 李苗,张贝贝,等.葶苈子、薏苡仁、车前子的利水功效比较[J].中成药,2018,40(1):40.46.
[5] 冯卫生, 杨方方,张莉,等.南葶苈子水提物对多柔比星诱导H9c2细胞凋亡和氧化应激的抑制作用[J].中国药学杂志,2018,53(23):1999.2007.
[6] 郭娟, 陈长勋,沈云辉.葶苈子水提液对动物实验性心室重构的影响[J].中草药,2007,38(10):1519.1523.
[7] 孙志强, 李超,吴源鸿,等.南葶苈子提取液对心力衰竭大鼠心功能的影响[J].心脑血管病防治,2016,16(6):427.430;488.
[8] 郑晓珂, 白义萍,张国顺,等.桑白皮有效部位对心衰大鼠心功能的影响[J].中成药,2016,38(10):2093.2098.
[9] PANTH N, PAUDEL K R,GONG D S, et al .Vascular protection by ethanol extract of Morus alba root bark:endothelium.dependent relaxation of rat aorta and decrease of smooth muscle cell migration and proliferation[J].Evidence.Based Complementary and Alternative Medicine,2018,2018:7905763.
[10] 冯冰虹, 苏浩冲,杨俊杰.桑白皮非丙酮提取物的药效学研究[J].中药材,2005,28(4):322.326.
[11] 汝海龙, 林国华,沈礼.桑白皮乙酸乙酯提取物的舒血管作用及其机制初探[J].健康研究,2012,32(5):321.324.
[12] 阚启明, 康宁,田海涛,等.桑皮苷的镇咳平喘作用[J].沈阳药科大学学报,2006,23(6):388.391.
[13] 韦媛媛, 徐峰,陈侠,等.桑白皮总黄酮的镇咳祛痰作用[J].沈阳药科大学学报,2009,26(8):644.647.
[14] 周代星, 梁黔生,何雪心,等.AngⅡ诱导的心肌肥大中c.fos,c.Jun mRNA表达变化及丹参酮ⅡA的影响[J].中国中药杂志,2008,33(8):936.939.
[15] 郭自强, 王硕仁,朱陵群,等.丹参素和川芎嗪对血管紧张素Ⅱ致心肌肥大相关基因的影响[J].中国中西医结合杂志,2005,25(4):342.344.
[16] 冯俊, 张洁,郑智,等.丹参酮ⅡA抑制新生大鼠心肌细胞肥大的作用机制[J].中国急救医学,2006,26(4):274.276.
[17] 王照华, 李永胜,杨乐,等.丹参酮对肥大心肌细胞中电生理特征和钙调神经磷酸酶活性的作用[J].现代中西医结合杂志,2011,20(32):4060.4063.
[18] 王晓霞, 陈志强,龚玲玲,等.丹参注射液对大鼠心肌缺血再灌注时心肌细胞凋亡的影响[J].临床心血管病杂志,2002,18(8):387.389;418.
[19] 曹慧敏, 宋囡,张妮,等.丹参酮ⅡA通过PI3K/Akt/mTOR信号通路调控自噬抗内皮细胞氧化应激损伤研究[J].北京中医药大学学报,2017,40(11):933.939.
[20] FU J J, HUANG H Q,LIU J J, et al .Tanshinone ⅡA protects cardiac myocytes against oxidative stress.triggered damage and apoptosis[J].European Journal of Pharmacology,2007,568(1/2/3): 213.221.
[21] 王咏, 马度芳,王成,等.基于心脏成纤维细胞microRNA.22/TGFβ.1信号通路研究红花.葶苈子对心肌纤维化的抑制作用[J].辽宁中医杂志,2020,47(12):171.175;240.
[22] 陈建梅, 史爱梅,叶炳华,等.红花黄色素对冠心病心衰患者脑钠肽水平的影响[J].中国实用医药,2017,12(29):118.119.
[23] 陈秋, 刘学强,李清福,等.红花黄色素对肺心病心衰患者的心肌保护作用[J].西南国防医药,2014,24(4):378.380.
[24] 吴伟, 李金荣,朴永哲,等.羟基红花黄色素A缓解大鼠心肌线粒体损伤的作用研究[J].中国药学杂志,2006,41(16):1225.1227.
[25] 尹立敏, 王红艳,颜永刚.桃仁分离物对急性寒凝血瘀模型大鼠血液流变学和血常规水平的影响[J].陕西中医药大学学报,2016,39(2):85.88;106.
[26] 文川, 徐浩,黄启福,等.活血中药对ApoE基因缺陷小鼠血脂及动脉粥样硬化斑块炎症反应的影响[J].中国中西医结合杂志,2005,25(4):345.349.
[27] 耿涛, 谢梅林,彭少平.桃仁提取物抗大鼠心肌缺血作用的研究[J].苏州大学学报(医学版),2005,25(2):238.240.
[28] 刘芬, 王秋静,吕文伟,等.赤芍总甙对犬急性缺血心肌的保护作用[J].中国临床康复,2005,9(31):136.138.
[29] 莫晓燕, 杜晓阳,黄海霞,等.赤芍总苷对体外培养乳鼠心肌细胞损伤的保护作用[J].中国临床康复,2005,9(43):188.190.
[30] 高丽, 张哲,许树钦,等.赤芍总苷对过氧化氢所致H9c2心肌细胞损伤的保护作用[J].时珍国医国药,2011,22(5):1194.1195.
[31] 董国菊, 刘剑刚,张庆翔,等.活血解毒中药组分配伍对急性心肌梗死后缺血心肌病理形态和心功能的影响[J].环球中医药,2015,8(11):1340.1345.
[32] 许惠玉, 陈志伟,牛建昭,等.赤芍总苷诱导K562细胞凋亡及对线粒体膜电位和Ca 2+ 的影响[J].中国组织工程研究与临床康复,2008,12(16):3123.3126.
[33] 张涛, 毛治尉,豆倩云,等.基于RhoA/ROCK通路探讨赤芍总苷对心肌梗死大鼠心肌凋亡的影响[J].中国老年学杂志,2023,43(5):1138.1142.
[34] 金玲. 中西医结合治疗慢性心力衰竭75例[J].山东中医杂志,2008,27(11):764.765.
[35] 蒋红心, 许运明,茆俊卿,等.健心合剂早期干预无症状心衰40例临床研究[J].江苏中医药,2003,35(12):10.11.
[36] 张明远, 赵玉珍,刘蕾,等.健心合剂对离体大鼠心脏冠脉流量及小鼠耳廓微循环的影响[J].黑龙江医药科学,2005,28(6):28.29.
[37] 刘蕾, 朱秋双,赵玉珍,等.健心合剂对大鼠心肌缺血损伤的保护作用[J].黑龙江医药科学,2006,29(1):6.7.
[38] ZHONG S, GUO H L,WANG H, et al .Apelin.13 alleviated cardiac fibrosis via inhibiting the PI3K/Akt pathway to attenuate oxidative stress in rats with myocardial infarction.induced heart failure[J].Bioscience Reports,2020,40(4):BSR20200040.
[39] WEEKS K L, BERNARDO B C,OOI J Y Y, et al .The IGF1.PI3K.Akt signaling pathway in mediating exercise.induced cardiac hypertrophy and protection[J].Advances in Experimental Medicine and Biology,2017,1000:187.210.
[40] DITTRICH G M, HEINEKE J.TNF.α signaling:TACE inhibition to put out the burning heart[J].PLoS Biology,2020,18(12):e3001037.
[41] HSIN K Y, GHOSH S,KITANO H.Combining machine learning systems and multiple docking simulation packages to improve docking prediction reliability for network pharmacology[J].PLoS One,2013,8(12):e83922.
[42] KRISHNA P S, NENAVATH R K,SUDHA RANI S, et al .Cardioprotective action of Amaranthus viridis methanolic extract and its isolated compound Kaempferol through mitigating lipotoxicity,oxidative stress and inflammation in the heart[J].Biotech,2023,13(9):317.
[43] LUO Y Y, SHANG P P,LI D Y.Luteolin:a flavonoid that has multiple cardio.protective effects and its molecular mechanisms[J].Frontiers in Pharmacology,2017,8:692.
[44] GUO R, LI L,SU J, et al .Pharmacological activity and mechanism of tanshinone ⅡA in related diseases[J].Drug Design,Development and Therapy,2020,14:4735.4748.
[45] FERENCZYOVA K, KALOCAYOVA B,BARTEKOVA M.Potential implications of quercetin and its derivatives in cardioprotection[J].International Journal of Molecular Sciences,2020,21(5):1585.
[46] AHMADI A, MORTAZAVI Z,MEHRI S, et al .Protective and therapeutic effects of Scutellaria baicalensis and its main active ingredients baicalin and baicalein against natural toxicities and physical hazards:a review of mechanisms[J].Daru,2022,30(2):351.366.
[47] PATEL R V, MISTRY B M,SHINDE S K, et al .Therapeutic potential of quercetin as a cardiovascular agent[J].European Journal of Medicinal Chemistry,2018,155:889.904.
[48] AHMED S, KHAN H,FRATANTONIO D, et al .Apoptosis induced by luteolin in breast cancer:mechanistic and therapeutic perspectives[J].Phytomedicine,2019,59:152883.
[49] LI L, LUO W,QIAN Y Y, et al .Luteolin protects against diabetic cardiomyopathy by inhibiting NF.κB.mediated inflammation and activating the Nrf2.mediated antioxidant responses[J].Phytomedicine,2019,59:152774.
[50] NING B B, ZHANG Y,WU D D, et al .Luteolin.7.diglucuronide attenuates isoproterenol.induced myocardial injury and fibrosis in mice[J].Acta Pharmacologica Sinica,2017,38(3):331.341.
[51] DU Y, HAN J B,ZHANG H X, et al .Kaempferol prevents against Ang Ⅱ.induced cardiac remodeling through attenuating Ang Ⅱ.induced inflammation and oxidative stress[J].Journal of Cardiovascular Pharmacology,2019,74(4):326.335.
[52] HU K ,NORDBECK P.Preclinical and clinical effects of the flavanol kaempferol:oxidative stress,myocardial inflammation,and the impact of human metabolism[J].Journal of Cardiovascular Pharmacology,2019,74(4):324.325.
[53] KAMISAH Y, JALIL J,YUNOS N M, et al .Cardioprotective properties of kaempferol:a review[J].Plants,2023,12(11):2096.
[54] LI X, XIANG D K,SHU Y Z, et al . Mitigating effect of tanshinone ⅡA on ventricular remodeling in rats with pressure overload.induced heart failure[J].Acta Cirurgica Brasileira,2019,34(8):e201900807.
[55] ZHANG X F, WANG Q Y,WANG X P, et al .Tanshinone ⅡA protects against heart failure post.myocardial infarction via AMPKs/mTOR.dependent autophagy pathway[J].Biomedecine & Pharmacotherapie,2019,112:108599.
[56] CHEN R J, CHEN W L,HUANG X L, et al .Tanshinone ⅡA attenuates heart failure via inhibiting oxidative stress in myocardial infarction rats[J].Molecular Medicine Reports,2021,23(6):404.
[57] TAN X Y, LI J P,WANG X Y, et al .Tanshinone ⅡA protects against cardiac hypertrophy via inhibiting calcineurin/NFATc3 pathway[J].International Journal of Biological Sciences,2011,7(3):383.389.
[58] CHEN Y, CHEN L,HONG D Y, et al .Baicalein inhibits fibronectin.induced epithelial.mesenchymal transition by decreasing activation and upregulation of calpain.2[J].Cell Death & Disease,2019,10(5):341.
[59] WAN C X, XU M,HUANG S H, et al .Baicalein protects against endothelial cell injury by inhibiting the TLR4/NF.κB signaling pathway[J].Molecular Medicine Reports,2018,17(2):3085.3091.
[60] 陈元堃, 曾奥,罗振辉,等.β.谷甾醇药理作用研究进展[J].广东药科大学学报,2021,37(1):148.153.
[61] WANG A P, GUO Y P,DING S, et al .The investigation of the molecular mechanism of Morinda officinalis how in the treatment of heart failure[J].Frontiers in Bioscience(Landmark Edition),2023,28(2):34.
[62] OCK S, LEE W S,KIM H M, et al .Connexin 43 and zonula occludens.1 are targets of Akt in cardiomyocytes that correlate with cardiac contractile dysfunction in Akt deficient hearts[J].Biochimica et Biophysica Acta Molecular Basis of Disease,2018,1864(4 Pt A):1183.1191.
[63] ARAKI S, IZUMIYA Y,HANATANI S, et al .Akt1.mediated skeletal muscle growth attenuates cardiac dysfunction and remodeling after experimental myocardial infarction[J].Circulation Heart Failure,2012,5(1):116.125.
[64] DEBOSCH B, TRESKOV I,LUPU T S, et al .Akt1 is required for physiological cardiac growth[J].Circulation,2006,113(17):2097.2104.
[65] BASHANFER S A A, SALEEM M,HEIDENREICH O, et al .Disruption of MAPK1 expression in the ERK signalling pathway and the RUNX1.RUNX1T1 fusion gene attenuate the differentiation and proliferation and induces the growth arrest in T(8;21) leukaemia cells[J].Oncology Reports,2019,41(3):2027.2040.
[66] YUE T L, WANG C,GU J L, et al .Inhibition of extracellular signal.regulated kinase enhances ischemia/reoxygenation.induced apoptosis in cultured cardiac myocytes and exaggerates reperfusion injury in isolated perfused heart[J].Circulation Research,2000,86(6):692.699.
[67] ZHAO J, LI L,PENG L.MAPK1 up.regulates the expression of MALAT1 to promote the proliferation of cardiomyocytes through PI3K/AKT signaling pathway[J].International Journal of Clinical and Experimental Pathology,2015,8(12):15947.15953.
[68] XU T D, LI D Y,JIANG D H.Targeting cell signaling and apoptotic pathways by luteolin:cardioprotective role in rat cardiomyocytes following ischemia/reperfusion[J].Nutrients,2012,4(12):2008.2019.
[69] YU D S, LI M W,TIAN Y Q, et al .Luteolin inhibits ROS.activated MAPK pathway in myocardial ischemia/reperfusion injury[J].Life Sciences,2015,122:15.25.
[70] YOKOYAMA T, VACA L,ROSSEN R D, et al .Cellular basis for the negative inotropic effects of tumor necrosis factor.alpha in the adult mammalian heart[J].The Journal of Clinical Investigation,1993,92(5):2303.2312.
[71] HAUDEK S B, TAFFET G E,SCHNEIDER M D, et al .TNF provokes cardiomyocyte apoptosis and cardiac remodeling through activation of multiple cell death pathways[J].The Journal of Clinical Investigation,2007,117(9):2692.2701.
[72] HAMID T, GU Y,ORTINES R V, et al .Divergent tumor necrosis factor receptor.related remodeling responses in heart failure:role of nuclear factor.kappa B and inflammatory activation[J].Circulation,2009,119(10):1386.1397.
[73] SIVASUBRAMANIAN N, COKER M L,KURRELMEYER K M, et al .Left ventricular remodeling in transgenic mice with cardiac restricted overexpression of tumor necrosis factor[J].Circulation,2001,104(7):826.831.
[74] XU P L, JI L,TIAN S, et al .Clinical effects of tanshinone ⅡA sodium sulfonate combined with trimetazidine and levocarnitine in the treatment of AVMC and its effects on serum TNF.α,IL.18 and IL.35[J].Experimental and Therapeutic Medicine,2018,16(5):4070.4074.
[75] WU W Y, WANG W Y,MA Y L, et al .Sodium tanshinone ⅡA silate inhibits oxygen.glucose deprivation/recovery.induced cardiomyocyte apoptosis via suppression of the NF.κB/TNF.α pathway[J].British Journal of Pharmacology,2013,169(5):1058.1071.
[76] VAN LOO G, BERTRAND M J M.Death by TNF:a road to inflammation[J].Nature Reviews Immunology,2023,23(5):289.303.
[77] CHEN C C, ZONG M,LU Y, et al .Differentially expressed lnc.NOS2P3.miR.939.5p axis in chronic heart failure inhibits myocardial and endothelial cells apoptosis via iNOS/TNFα pathway[J].Journal of Cellular and Molecular Medicine,2020,24(19):11381.11396.
[78] GENET G, BOY K,MATHIVET T, et al .Endophilin.A2 dependent VEGFR2 endocytosis promotes sprouting angiogenesis[J].Nature Communications,2019,10(1):2350.
[79] WANG C, GU C,JEONG K J, et al .YAP/TAZ.mediated upregulation of GAB2 leads to increased sensitivity to growth factor.induced activation of the PI3K pathway[J].Cancer Research,2017,77(7):1637.1648.
[80] PARK S, NGUYEN N B,PEZHOUMAN A, et al .Cardiac fibrosis:potential therapeutic targets[J].Translational Research,2019,209:121.137.
[81] YANG W B, WU Z J,YANG K, et al .BMI1 promotes cardiac fibrosis in ischemia.induced heart failure via the PTEN.PI3K/Akt.mTOR signaling pathway[J].American Journal of Physiology Heart and Circulatory Physiology,2019,316(1):H61.H69.
[82] TIAN X Q, SUN C Y,WANG X W, et al .ANO1 regulates cardiac fibrosis via ATI.mediated MAPK pathway[J].Cell Calcium,2020,92:102306.
[83] WANG H C, LIU S W,LIU S Q, et al .Enhanced expression and phosphorylation of Sirt7 activates smad2 and ERK signaling and promotes the cardiac fibrosis differentiation upon angiotensin.Ⅱ stimulation[J].PLoS One,2017,12(6):e0178530.
(收稿日期:2023.09.19)
(本文编辑 薛妮)

