血清TMAO水平对心房颤动病人心房肌纤维化的影响
朱浩然 耿金 孟思雨 葛培兵 倪天祎 张清 王丙剑
摘要 目的: 观察血清氧化三甲胺(TMAO)水平对心房颤动病人心房肌纤维化的影响。 方法: 入组31例瓣膜病病人,其中心房颤动组(AF组)16例和窦性心律组(SR组)15例;收集入组病人的人口学资料、相关实验室检查及心脏超声等资料。使用液相色谱法测定血清TMAO水平并比较两组间差异;马松染色分析两组心房肌组织纤维化差异;蛋白免疫印迹法(Western Blot)测定病人心房肌组织抗平滑肌抗体(aSMA)蛋白含量。对TMAO水平与aSMA含量及左房内径(LAD)进行线性相关分析。 结果: 与SR组比较,AF组LAD、血清TMAO水平及aSMA增高,差异有统计学意义( P <0.05)。血清TMAO水平与LAD、aSMA含量均呈正相关( r 值分别为0.409,0.633, P <0.05)。 结论: 心房颤动病人血清TMAO水平明显升高,伴随着心房胶原纤维沉积和LAD扩大,提示TMAO可能在促进心房颤动发展过程中对心房肌纤维化产生作用。
关键词 心房颤动;氧化三甲胺;心房肌纤维化;左房内径
doi: 10.12102/j.issn.1672.1349.2024.10.028
近年来,随着老龄化问题的加重及心血管疾病的增多,心房颤动发病率日益升高,心房颤动可能增加脑卒中、血栓栓塞、心力衰竭及心肌梗死等疾病风险,严重影响病人的生活质量,甚至危及生命 [1.2] 。因此,及时发现并治疗心房颤动显得尤为重要。目前认为在心房颤动发生发展过程中,伴随心房原有电活动及结构特征性改变,早期主要表现为电重构,心肌纤维化导致的结构重构是心房颤动晚期主要的病理改变 [3.4] 。急性心肌损伤及伴随的肥胖、糖尿病等代谢紊乱均可加快心肌纤维化的进程,且多种炎性因子参与的炎症反应也是心肌纤维化的重要诱发因素,加速心脏重构,促进心房颤动的维持与进展 [3,5] 。氧化三甲胺(trimethylamine N.oxide,TMAO)是含磷脂酰胆碱、胆碱的化合物,经肠道菌群代谢吸收后在肝脏内氧化的产物,在动脉粥样硬化、心力衰竭、心肌梗死等诸多心血管疾病的发生发展中发挥着重要作用。相关研究表明,在心肌肥大及缺血再灌注的小鼠模型中,血清TMAO含量与心肌纤维化相关,下调TMAO可显著抑制心肌纤维化,缓解疾病进展 [6.8] 。心房颤动涉及心房肌纤维化,TMAO与心房颤动及心房纤维化关系的研究较少。本研究观察血清TMAO水平对心房颤动病人心房肌纤维化的影响。
1 资料与方法
1.1 一般资料
选取2021年1月—7月于淮安市第一人民医院行瓣膜置换手术的心脏病病人31例。根据是否合并心房颤动及发病的持续时间分为持续性心房颤动组(AF组,16例)和窦性心律组(SR组,15例)。AF组入选心房颤动持续发作>7 d,通过药物或电复律中止发作的病人;SR组入选无心房颤动史,心电图检查为窦性心律的病人。纳入标准:心脏彩超明确诊断为瓣膜性心脏病;纽约心脏病协会(NYHA)心功能分级Ⅱ级或Ⅲ级;年龄18~80岁。排除标准:急性左心衰竭、心功能Ⅳ级;重症感染和活动性风湿热;甲状腺功能紊乱;严重肾功能不全;病态窦房结综合征或其他需要起搏器治疗的疾病;阵发性心房颤动等。本研究符合淮安市第一人民医院伦理委员会制订的伦理学标准并被批准(批准文号:KY.2022.125.01),且所有病人均签署知情同意书。
1.2 治疗方法
所有病人均在心脏外科行瓣膜置换或修复手术,入院当天抽取全血检测TMAO。手术过程中,探查左心耳心肌组织,在左心耳适当部位留取少许左心房标本。将马松染色的心房组织固定于4%多聚甲醛中,其余组织保存在液氮中,-80 ℃保存,用于蛋白免疫印迹法(Western Blot)。
1.3 研究方法
收集病人的人口学资料、临床资料及住院期间用药情况;记录病人当天血肌酐(Cr)和总胆固醇(TC)水平;所有病人在入院3 d内完成超声心动图检查,记录左室舒张末期内径(LVEDD)、左房内径(LAD)和左室射血分数(LVEF)。
1.4 液相色谱法
所有病人均在清晨、 空腹、清醒时抽取肘静脉血3~ 5 mL置于干燥管中,全血在4 ℃条件下,以2 500 r/min 离心10 min,所得血清约500 μL,采用高效液相色谱串联质谱法测定TMAO水平 [9] 。先将TMAO.d9添加到血清样品中,在m/z 85.68范围内对其进行液相色谱.质谱(LC/MS)分析,之后在m/z 76.58范围内对TMAO进行LC/MS分析,最后将TMAO和TMAO.d9加入对照样品中,绘制TMAO定量分析的校准曲线。
1.5 马松染色
马松染色按照试剂盒(KGMST.8004,KeyGEN BioTech,China)说明书进行,石蜡切片脱水后以蒸馏水清洗,苏木精染色5 min,充分水洗后以丽春红染色液染色5 min,冰醋酸溶液和磷钼酸溶液清洗后,以苯胺蓝染色液染色5 min,脱水后封片。采用Image Pro Plus软件分析胶原含量,评估其纤维化程度。
1.6 Western Blot试验
使用RIPA(购自Beyotime公司)和苯甲基磺酰氟(PMSF,购自Beyotime公司)提取心肌组织中的蛋白,之后使用二喹啉甲酸(BCA)试剂盒(购自Beyotime公司)定量分析蛋白浓度。在配好的胶中加入蛋白样品后电泳,转膜至聚偏乙烯膜(PVDF)上,用抗平滑肌抗体(aSMA)一抗(购自Proteintech公司,货号:14395.1.AP,1∶2 000稀释)4 ℃孵育过夜,以二抗(购自Proteintech公司,货号:SA00001.2,1∶7 500稀释)孵育1 h后电化学发光(ECL)法显影。以三磷酸甘油醛脱氢酶(GAPDH,购自Proteintech公司,货号:10494.1.AP,1∶10 000稀释)进行参照蛋白,采用Image J软件定量分析蛋白含量。
1.7 统计学处理
所有数据采用SPSS 22.0(IBM SPSS,Armonk,NY)进行统计学分析。符合正态分布的定量资料以均数±标准差( x ± s )表示,采用独立样本 t 检验;定性资料以例数、百分比(%)表示,采用 χ 2检验或Fisher确切概率法。使用广义线性模型确定TMAO、aSMA及LAD的相关性,使用线性回归模型调整混杂因素。以 P <0.05为差异有统计学意义。
2 结 果
2.1 两组临床资料比较
与SR组比较,AF组LAD、血清TMAO水平及aSMA增高, 差异有统计学意义( P <0.05)。详见表1。
2.2 血清TMAO水平及心房肌纤维化程度
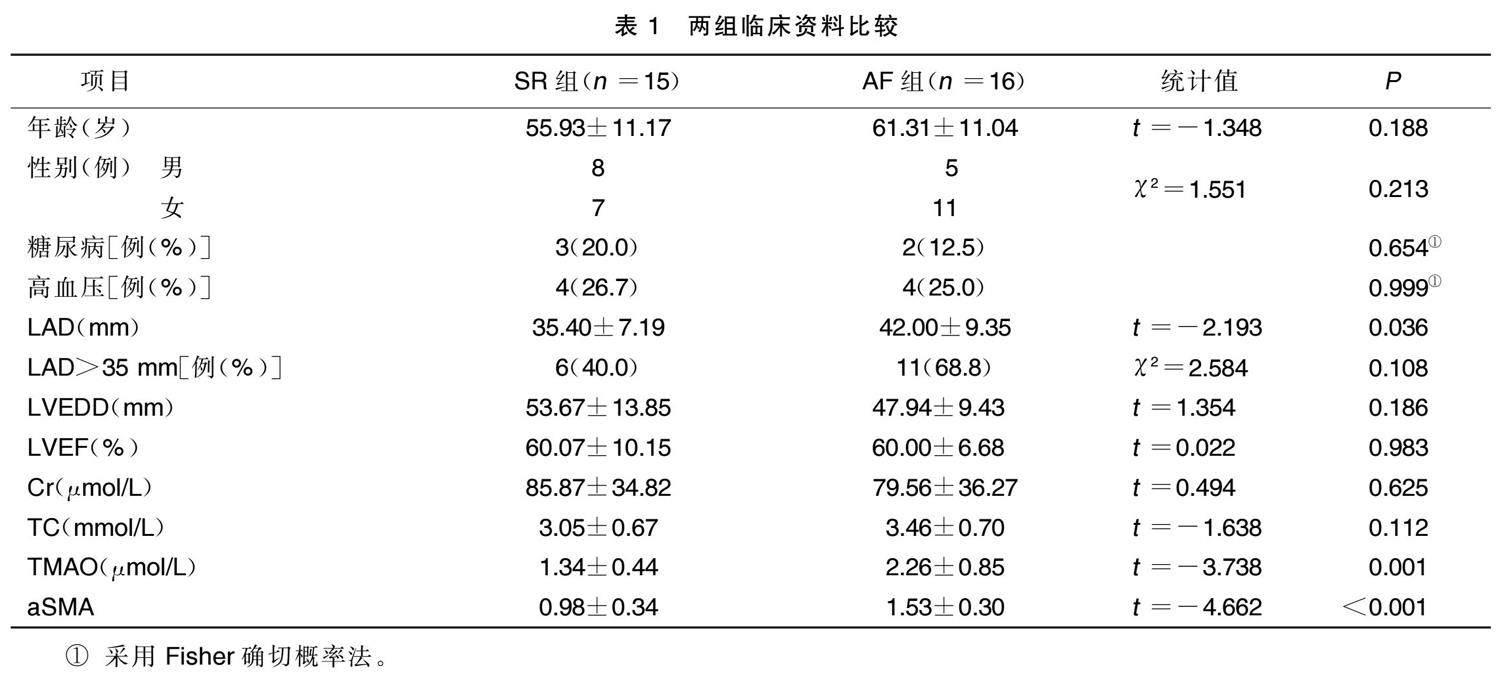
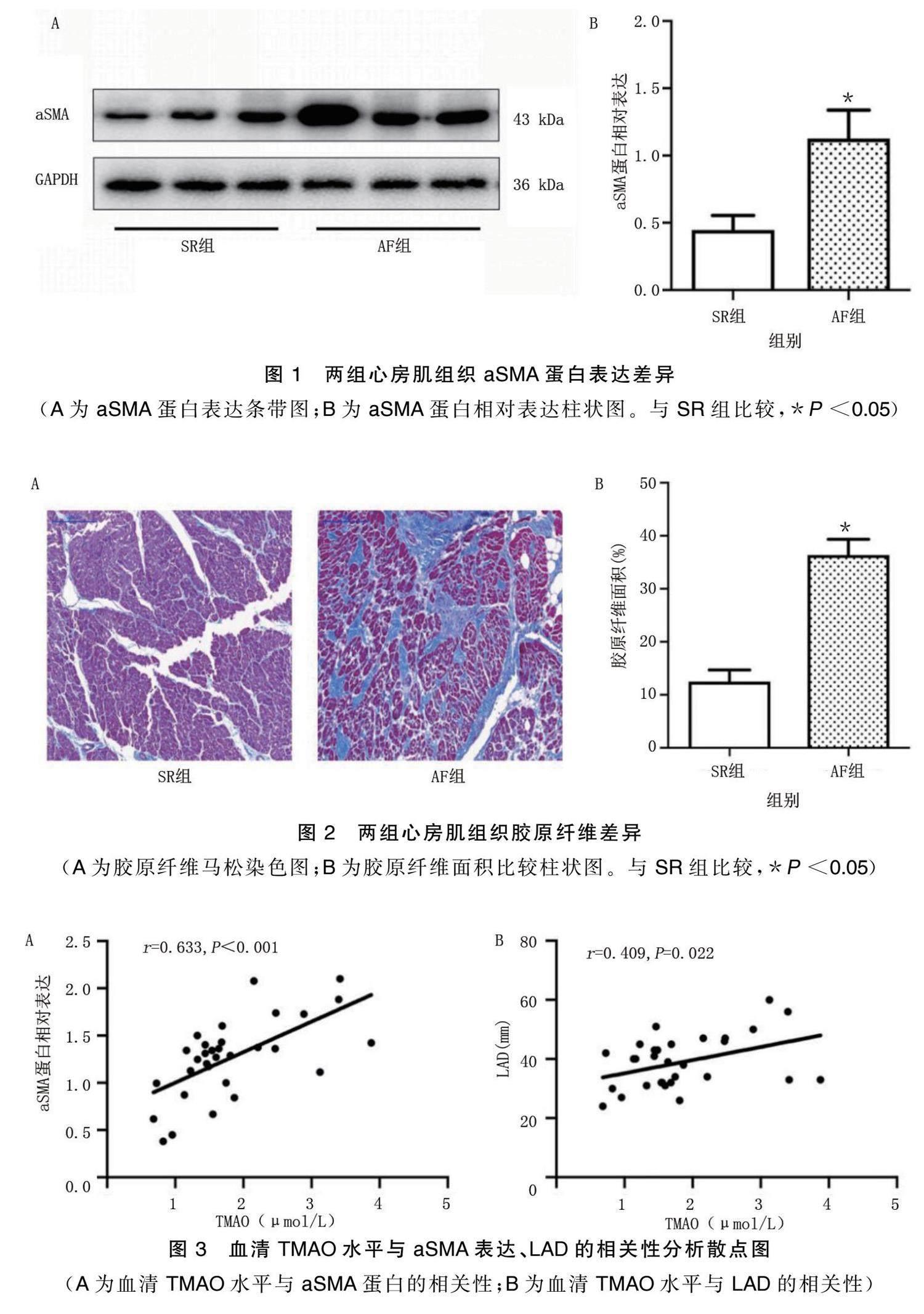
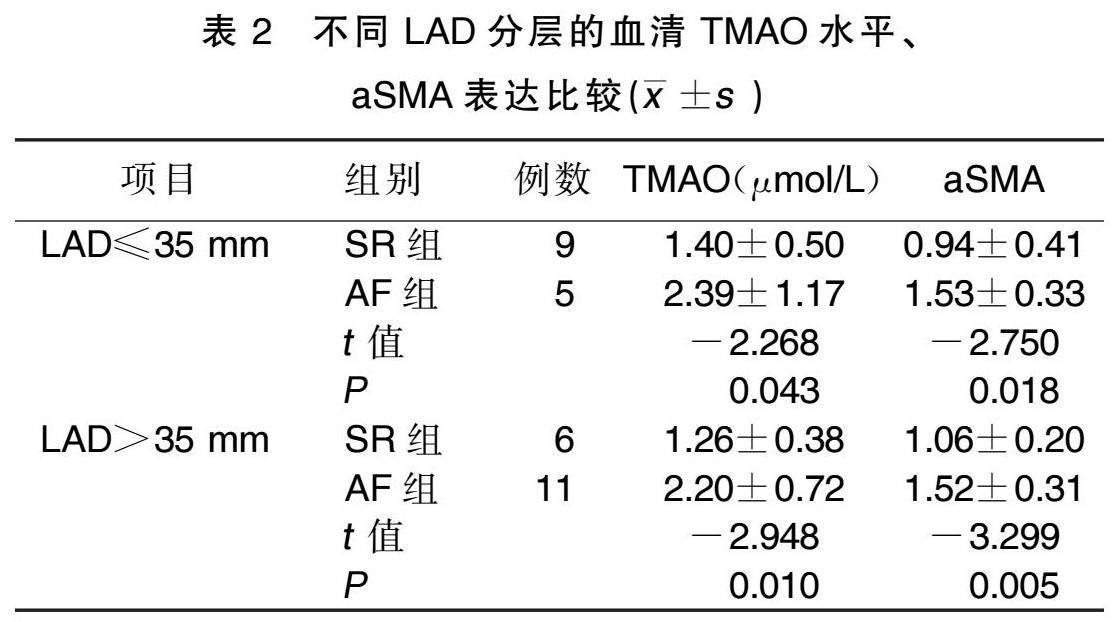
Western Blot法检测心房肌组织的蛋白相对表达,可见纤维化标志物aSMA在AF组中高表达,详见图1。马松染色显示,AF组胶原明显高于SR组,详见图2。线性相关分析结果显示,TMAO水平与aSMA相对表达( r =0.633, P <0.001)、LAD( r =0.409, P =0.022)均呈正相关。详见图3。
2.3 不同LAD分层的血清TMAO水平、aSMA表达比较
为消除混杂因素的影响,对LAD进行了分层分析。AF组血清TMAO水平、aSMA表达均高于SR组( P <0.05)。详见表2。提示心房颤动病人TMAO水平上调及纤维化加重与LAD无关。
3 讨 论
心房颤动的常见危险因素包括年龄、肥胖、高血压、糖尿病及肾功能不全等 [10.11] ,虽然对上述因素进行预防与筛查,但心房颤动发病率、致死率仍居高不下 [12.13] 。持续性心房颤动导致心肌纤维化,发展为心房结构重构,从而使心房舒缩功能受损,心脏泵血功能减退甚至丧失,心力衰竭死亡常成为心房颤动病人的最终结局。因此,有效控制纤维化进程在治疗心房颤动过程中至关重要。
TMAO是消化过程中肠道菌群产生的代谢产物,胆碱和肉毒碱作为TMAO前体物质在红肉中含量很多,因此,长期摄入红肉可使血浆TMAO水平升高 [14.15] 。在肠道中,胆碱、肉毒碱和卵磷脂等代谢前体转化为三甲胺(TMA),TMA穿过肠壁进入血液循环,在肝脏中由黄素单加氧酶(FMOs)氧化形成TMAO。目前认为,TMAO是心血管疾病中一种新型的危险因素。相关研究表明,相较于正常饮食的小鼠,高TMAO饮食的小鼠动脉粥样硬化及心脏纤维化进展加剧 [6,16] ;停止摄入TMAO或抑制TMAO生成,可缓解心肌纤维化,改善心脏重构 [17.18] 。心房纤维化是心房颤动重要的病理改变,有研究以快速心房起搏构建犬心房颤动模型,之后将TMAO注入心脏自主神经结中,结果显示,心房颤动发生率升高,神经节活性增强,心房重构因子(NGF)表达升高,且血清炎性因子上调 [19] 。提示TMAO可能参与心房颤动的发生发展,促进心房肌纤维化进程。
本研究选取心房颤动及窦性心律的瓣膜病病人31例,结果显示,心房颤动病人血清TMAO水平较窦性心律病人明显升高,且TMAO水平与LAD呈正相关。左心房扩大与心房颤动互为因果,一方面心房颤动发病后,晚期导致心肌胶原纤维沉积、心房结构重构;另一方面,左房扩大可促进血栓形成、心房颤动复发。因此,LAD可能提示心房颤动的严重程度。血清TMAO水平与LAD存在相关性,TMAO可能是预测心房颤动发生与疾病严重程度的生物标志物。由于两组LAD比较差异有统计学意义,因此进行分层分析以校正其对结果的影响,结果显示,心房颤动导致的TMAO上调及纤维化进展不受LAD的影响。本研究将术中获取的左心耳组织进行Western Blot试验和马松染色,结果显示,AF组心房肌组织纤维化程度高于SR组,且血清TMAO水平与左房aSMA表达呈正相关。上述研究结果表明TMAO可能与心房肌的纤维化有关,参与了心房颤动的维持与进展。
TMAO促进心房颤动发生发展的机制有以下几方面:1)TMAO与心房颤动的危险因素有关,如肥胖、糖尿病导致的代谢紊乱及心血管急症等 [20.22] ;2)TMAO使心房自主神经节活性增高,诱使心房电生理紊乱 [19,23] ;3)TMAO通过激活NOD样受体热蛋白结构域相关蛋白3(NLRP3)炎性小体、促进氧化应激、激活多种促炎信号通路等途径,促进机体炎症反应,从而导致心房结构重构 [6,8,24] 。
综上所述,心房颤动病人血清TMAO水平升高,并伴随心房胶原纤维沉积和LAD的扩大,即心房结构重构,表明TMAO可能在促进心房颤动病人心房肌纤维化过程中发挥着关键作用。基础实验和临床研究仍缺乏具体证据解释TMAO促进心房颤动病人心房肌纤维化的潜在机制。需进一步研究证实本研究结果, 以期为调整肠内代谢进而延缓心房颤动进展提供 依据。
参考文献:
[1] 中华 医学会心电生理和起搏分会,中国医师协会心律学专业委员会,中国房颤中心联盟心房颤动防治专家工作委员会.心房颤动:目前的认识和治疗建议(2021)[J].中华心律失常学杂志,2022,26(1):15.88.
[2] CHUGH S S, HAVMOELLER R,NARAYANAN K, et al .Worldwide epidemiology of atrial fibrillation:a global burden of disease 2010 study[J].Circulation,2014,129(8):837.847.
[3] HU Y F, CHEN Y J,LIN Y J, et al .Inflammation and the pathogenesis of atrial fibrillation[J].Nature Reviews Cardiology,2015,12:230.243.
[4] LAU D H, SCHOTTEN U,MAHAJAN R, et al .Novel mechanisms in the pathogenesis of atrial fibrillation:practical applications[J].European Heart Journal,2016,37(20):1573.1581.
[5] IHARA K, SASANO T.Role of inflammation in the pathogenesis of atrial fibrillation[J].Frontiers in Physiology,2022,13:862164.
[6] LI X L, GENG J,ZHAO J X, et al .Trimethylamine N.oxide exacerbates cardiac fibrosis via activating the NLRP3 inflammasome[J].Frontiers in Physiology,2019,10:866.
[7] LI Z H, WU Z Y,YAN J Y, et al .Gut microbe.derived metabolite trimethylamine N.oxide induces cardiac hypertrophy and fibrosis[J].Laboratory Investigation,2019,99:346.357.
[8] YANG W L, ZHANG S N,ZHU J B, et al .Gut microbe.derived metabolite trimethylamine N.oxide accelerates fibroblast.myofibroblast differentiation and induces cardiac fibrosis[J].Journal of Molecular and Cellular Cardiology,2019,134:119.130.
[9] SHI Y F, HU J X,GENG J, et al .Berberine treatment reduces atherosclerosis by mediating gut microbiota in ApoE ./. mice[J].Biomedecine & Pharmacotherapie,2018,107:1556.1563.
[10] LING L H, KISTLER P M,KALMAN J M, et al .Comorbidity of atrial fibrillation and heart failure[J].Nature Reviews Cardiology,2016,13:131.147.
[11] THIHALOLIPAVAN S, MORIN D P.Atrial fibrillation and heart failure:update 2015[J].Progress in Cardiovascular Diseases,2015,58(2):126.135.
[12] KORNEJ J, BRSCHEL C S,BENJAMIN E J, et al .Epidemiology of atrial fibrillation in the 21st century:novel methods and new insights[J].Circulation Research,2020,127(1):4.20.
[13] BRUNDEL B J J M ,AI X,HILLS M T, et al .Atrial fibrillation[J].Nature Reviews Disease Primers,2022,8(1):21.
[14] WILSON TANG W H, WANG Z N,LEVISON B S, et al .Intestinal microbial metabolism of phosphatidylcholine and cardiovascular risk[J].The New England Journal of Medicine,2013,368(17):1575.1584.
[15] WANG Z N, BERGERON N,LEVISON B S, et al .Impact of chronic dietary red meat,white meat,or non.meat protein on trimethylamine N.oxide metabolism and renal excretion in healthy men and women[J].European Heart Journal,2019,40(7):583.594.
[16] GENG J, YANG C C,WANG B J, et al .Trimethylamine N.oxide promotes atherosclerosis via CD36.dependent MAPK/JNK pathway[J].Biomedecine & Pharmacotherapie,2018,97:941.947.
[17] WANG G J, KONG B,SHUAI W, et al .3,3.Dimethyl.1.butanol attenuates cardiac remodeling in pressure.overload.induced heart failure mice[J].The Journal of Nutritional Biochemistry,2020,78:108341.
[18] ORGAN C L, LI Z,SHARP T E, et al .Nonlethal inhibition of gut microbial trimethylamine N.oxide production improves cardiac function and remodeling in a murine model of heart failure[J].Journal of the American Heart Association,2020,9(10):e016223.
[19] YU L L, MENG G N,HUANG B, et al .A potential relationship between gut microbes and atrial fibrillation:trimethylamine N.oxide, a gut microbe.derived metabolite,facilitates the progression of atrial fibrillation[J].International Journal of Cardiology,2018,255:92.98.
[20] JONSSON A L, BCKHED F.Role of gut microbiota in atherosclerosis[J].Nature Reviews Cardiology,2017,14(2):79.87.
[21] WILSON TANG W H, KITAI T,HAZEN S L.Gut microbiota in cardiovascular health and disease[J].Circulation Research,2017,120(7):1183.1196.
[22] BROWN J M, HAZEN S L.Microbial modulation of cardiovascular disease[J].Nature Reviews Microbiology,2018,16(3):171.181.
[23] SHARON G, SAMPSON T R,GESCHWIND D H, et al .The central nervous system and the gut microbiome[J].Cell,2016,167(4):915.932.
[24] CHEN M L, ZHU X H,RAN L, et al .Trimethylamine.N.oxide induces vascular inflammation by activating the NLRP3 inflammasome through the SIRT3.SOD2.mtROS signaling pathway[J].Journal of the American Heart Association,2017,6(11):e002238.
(收稿日期:2023.03.23)
(本文编辑 薛妮)

