探究影响氧化还原反应的因素
杜鹏程 赵丽娜


摘 要:本文介绍了电极电势的形成以及利用能斯特方程计算电极电势,并以2021年北京高考化学第19题为例进行分析总结氧化还原反应的本质.最终得出影响氧化还原反应的因素的重要结论,包括离子浓度、pH等,旨在为师生提供一些参考和借鉴.
关键词:高中化学;氧化还原;电极电势;能斯特方程;解题策略
中图分类号:G632 文献标识码:A 文章编号:1008-0333(2024)07-0143-03
在高考化学中,氧化还原反应是每年的必考点.在近几年的高考化学试题和模拟题中,对这部分的考查从价态判断、化学方程式书写、电子转移、物质性质等常规知识转向探究氧化还原反应的本质.在2021年北京高考化学第19题中,通过实验探究了氧化还原反应的本质.本文将以这道题为例解析氧化还原反应的本质和影响因素.
1 电极电势及能斯特方程解析
在分析题目之前需要解释电极电势以及能斯特方程,有了这两个前置知识,才可从本质理解氧化还原反应.
1.1 电极电势的形成
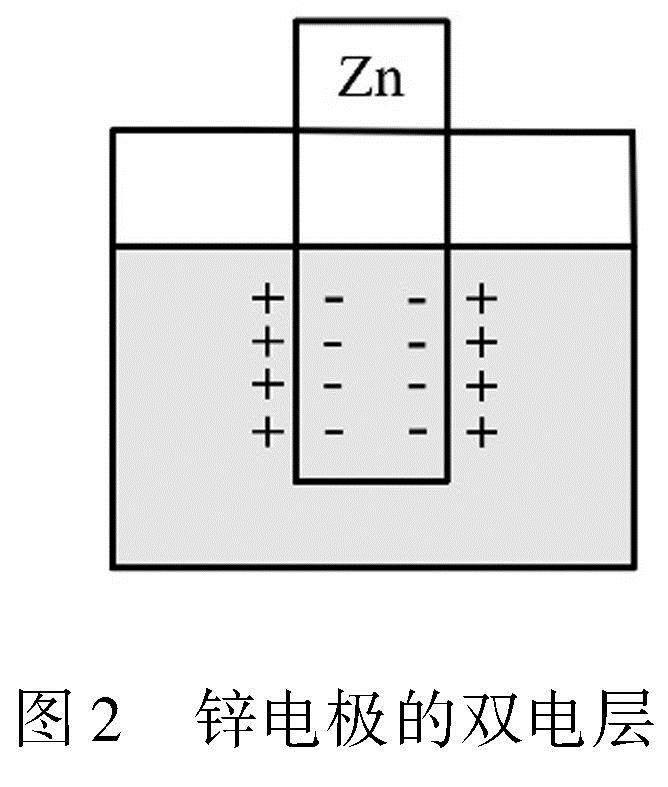
以人教版教材选择性必修1中的铜锌双液原电池中为例,如图1所示[1].对于Zn电极来说,Zn片插入ZnSO4溶液中, Zn片表面的Zn2+受到溶剂水分子吸引,形成水合离子进入溶液,将电子留在Zn片上.发生反应①:Zn-2e-Zn2+,溶液中Cu2+与金属上的电子结合形成Cu原子,沉积在金属表面上,发生反应②:Cu2++2e-Cu.
在反应①与②达到平衡时,对于Zn/Zn2+而言,一般情况下认为是Zn片上留下e-,而Zn2+进入溶液,所以溶液的电势高于Zn片.在Zn片和Zn2+溶液界面上,形成双电层,如图2所示.
电极电势就是双电层之间的电势差,用E表示,电极电势越高,氧化性越强.当电极处于标准状态(ci=1.00mol·L-1,压强为101kPa)时,该电极电势称为电极的标准电极电势,用Eθ表示[2].电极电势的测量通常使用标准氢电极作为标准,这个测量方法在2022浙江1月选考化学试题中有介绍.
铜锌双液原电池正是因为锌电极与铜电极之间存在电势差,铜电极电势高于锌电极电势,故电子由锌电极向铜电极移动产生电流[3].
1.2 能斯特方程
当电极处于标准状态时,可通过文献获得该电极的标准电势Eθ,若电极处于非标准状态时,则需要根据能斯特方程计算得出该环境下的电极电势E.对于电极反应Ox+ne-Red.
能斯特方程表达式:
2 试题分析
例题 (2021北京第19题)某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律.(1)浓盐酸与MnO2混合加热生成氯气.氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2.
①反应的离子方程式是.
②电极反应式:
ⅰ.还原反应:
MnO2+2e-+4H+Mn2++2H2O
ⅱ.氧化反应:.
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因.
ⅰ.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱.
ⅱ.随c(Cl-)降低,.
④补充实验(见表1)证实了③中的分析.
a是,b是.
(2)利用c(H+)对MnO2氧化性的影响,探究卤素离子的还原性.相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是,从原子结构角度说明理由.
(3)根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2.经实验证实了推测,该化合物是.
(4)Ag分别与1 mol·L-1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:.
(5)总结:物质氧化性和还原性变化的一般规律是.
解析 本题围绕影响氧化还原反应的因素进行探究,实际上也是在围绕能斯特方程进行探究氧化还原反应的进行程度.
(1)根据题目信息分析可知,考查实验室制取氯气的方法:浓盐酸与MnO2混合加热生成氯气,实验室制备Cl2的离子方程式为:
氧化反应为2Cl--2e-Cl2↑
③根据题目信息分析可知,物质的氧化性、还原性的强弱与某些离子浓度有关, MnO2氧化性减弱是因为c(H+)降低或c(Mn2+)升高,减弱到一定程度反应停止.氧化还原反应有“强强制弱弱”的规律,MnO2氧化性减弱导致反应停止.同理,c(Cl-)降低,导致了Cl-还原性的减弱,“两弱”难以反应.
答案为:Cl-还原性的减弱.这一问还有另外一个答案:Cl2的氧化性增强.
①和②中离子方程式的书写难度较低,但对于离子浓度
变化影响氧化性和还原性知识比较陌生,作答此问题需要对氧化还原的本质理解更加深入.
④问利用能斯特方程解释MnO2与浓HCl反应制备Cl2的反应机理.MnO2与浓HCl反应的半反应分别为:
氧化反应:2Cl--2e-Cl2↑
还原反应:MnO2+2e-+4H+Mn2++2H2O
查表可知,Eθ(Cl2/Cl-)=1.36 V,Eθ(MnO2/Mn2+)=1.23 V,由于Eθ(Cl2/Cl-)>Eθ(MnO2/Mn2+),所以Cl2氧化性大于MnO2,无法失去e-转化为Cl2,因此稀HCl与MnO2不发生反应.根据电极电势可知二者不發生反应的本质原因是电子无法由高电势向低电势转移,所以可以通过降低或升高电极电势改变反应方向.
上述2个氧化还原电对的能斯特方程分别为:
根据①与②的能斯特方程分析,随着c(Cl-)的增加,ECl2/Cl-降低;随着c(H+)增加,
E(MnO2/ Mn2+)升高,最终使ECl2/Cl-<EMnO2/Mn2+,即氧化性MnO2>Cl2.为了增加c(H+),所以使用的是浓盐酸,随着反应的进行c(H+)会下降,直至两电对电极电势
相等停止反应.为了提高相应的离子浓度,所以④中a是NaCl或KCl固体,b是MnSO4固体.
根据以上分析,可得出结论:电极电势受pH、反应物浓度的影响,也就是这两个因素会影响氧化剂与还原剂性质的强弱.如浓盐酸与MnO2制取Cl2,其他题目中常常见到的“酸化的高锰酸钾,酸化的重铬酸钾”等,究其原因是因为在酸性环境下会增强这些氧化剂的电极电势.根据能斯特方程可知,改变氧化态和还原态的浓度同样也可以改变电极电势.对于一些无法自发进行的氧化还原反应,可以通过外加电源强制电子转移的方法实现.基于此,定量解释了(1)题目中所有问题的本质原因.
(2)题基于(1)中分析可知,c(H+)增加有利于提高MnO2的氧化性,卤素离子如果与MnO2发生反应,需要提高c(H+)进而使MnO2的氧化性大于氧化产物卤素单质的氧化性即可反应.由于Cl、Br、I位于同一主族,从上到下电子层数依次增多,r(Cl) (3)题目中用溴氧化Mn2+,需要提高Br2的氧化性,只需要减少其还原产物c(Br-)即可,所以可以加入AgNO3或Ag2SO4溶液将Br-沉淀,降低c(Br-). (4)根据题目信息可书写反应的化学方程式: 2Ag+2HX2AgX↓+H2↑ 由金属活动性顺序表可知Ag在H后面,不能置换出H2,原因是标准状况下EθH+/H2<EθAg+/Ag,所以Ag不能置换出H2,因此需要改变电极电势使EH+/H2>EAg+/Ag才可置换出H2.根据题目可知盐酸,氢溴酸、氢碘酸 中c(H+)相等,故EH+/H2相同,只能提高EAg+/Ag,即减小c(Ag+). Cl-、Br-、I-可与Ag+发生反应生成沉淀,降低了c(Ag+),c(Ag+)越低,Ag越易被H+氧化,当E(Ag+/Ag) (5)根据以上可以得出结论:氧化剂的浓度越大,还原产物的浓度越小,则氧化剂的氧化性越强;还原剂的浓度越大,氧化产物的浓度越小,则还原剂的还原性越强. 3 结束语 2021年北京高考用探究的方式考查了这方面知识,难度较高.因此,作为化学教师需要结合自己所学,针对这一知识点深入解析,联系高中内容进一步开发电极电势在高中试题中可能出现的形式. 3 相关试题分析 例题2 (2021河北)关于非金属含氧酸盐及其盐的性质,下列说法正确的是( ). A.浓H2SO4具有强吸水性,能吸收糖类化合物中的水分并使其炭化 B.NaClO、KClO3等氯的含氧酸盐的氧化性会随溶液的pH减小而增强 C.加热NaI与浓H3PO4混合物可制备HI,说明H3PO4比HI酸性强 D.浓HNO3和稀HNO3与Cu反应的还原产物分别为NO2和NO,所以稀HNO3氧化性更强 解析 A选项错误,考查了浓硫酸的吸水性与脱水性的区别,炭化体现了浓H2SO4脱水性.B选项正确,前文分析了pH与氧化性的关系,可利用结论直接判断.C选项错误,利用浓H3PO4的难挥发性制备易挥发性的HI,与酸性强弱没有关系.D选项错误,氧化性与得失电子数量无关,与反应的难易程度有关.D选项:氧化性强弱顺序为:PbO2>MnO-4>Cl2>Fe3+. 例题3 (2022浙江1月选考)pH计是一种采用原电池原理测量溶液pH的仪器.如图所示,以玻璃电极(在特制玻璃薄膜球内放置已知浓度的HCl溶液,并插入Ag-AgCl电极)和另一Ag-AgCl电极插入待测溶液中组成电池,pH与电池的电动势E存在关系:pH=(E-常数)/0.059.下列说法正确的是( ). A.如果玻璃薄膜球内电极的电势低,则该电极反应式为: AgCl(s)+e-Ag(s)+Cl-(0.1 mol·L-1) B.玻璃膜内外氢离子浓度的差异不会引起电动势的变化 C.分别测定含已知pH的标准溶液和未知溶液的电池的电动 势,可得出未知溶液的pH D.pH计工作时,电能转化为化学能 解析 本题通过创设测量pH情景,引入电极电势概念,给出了pH与E之间关系式,陌生信息较多,难度较大.该装置为原电池,由于电势会发生改变,并不能直接确定正负极.A选项错误,如果玻璃薄膜球内电极的电势低,那么该电极为负极,失去电子,电极反应式应该为:Ag(s)+Cl--e-AgCl(s) .B选项错误,由题目中pH与电动势E的关系可知,c(H+)的不同会影响pH,进而影响电动势E的变化.C选项正确,对于已知pH的标准溶液进行测定,带入测得电动势E,可以求出式中常数值,就可以进一步计算未知溶液的pH.D选项错误,该装置为原电池,工作时化学能转化为电能. 3 结束语 虽然电极电势和能斯特方程是大学无机化学的知识,但近年一些地区的模拟题和高考题已经开始在这两个内容上“试探”.2021年北京高考用探究的方式考查了这方面知识,难度较高.因此,作为化学教师更是需要结合自己所学,针对这一知识点深入解析,联系高中内容进一步研究电极电势在高中试题中可能出现的形式,如确定难溶电解质的溶度积常数、计算弱电质的解离常数等.相信随着新高考改革的深入,作为氧化还原反应的核心内容的电极电势会在更多地区的考试中以不同的的形式进行考查. 参考文献: [1]人民教育出版社,课程教材研究所,中学化学课程教材研究开发中心.普通高中教科书:化学选择性必修1[M].北京:人民教育出版社, 2019. [2] 宋天佑.无机化学(上册)[M].第四版. 北京: 高等教育出版社,2019:6. [3] 杨天林.原电池与电极电势概念教学程序设计[J].固原师专学报,2002(03):60-64.

